正版印度神藥為何這麼貴?研究半世紀,兩奪世界第一,出了五位頂級醫學獎_風聞
剑啸易水寒-深知身在情长在,前尘不共彩云飞。2018-07-09 11:33
本文轉載自公眾號SME科技故事
國產電影《我不是藥神》在未正式上映前,就已藉着點映已先火了一波。
這兩天正式走入院線,更是刷爆了朋友圈。
“笑着走進電影院,哭着走出去”,是許多人的真實寫照。
其實早在幾年前,電影的原型人物——陸勇,就以“印度抗癌藥代購第一人”、“藥俠”等稱號火過一波了。

因患上慢粒白血病,一時又找不到合適配型做骨髓移植,陸勇只能靠藥物穩定病情。
而這種藥,正是電影中的“天價藥”——瑞士格列衞(電影中名為格列寧)。
每盒近兩萬四,只夠吃一個月,“感覺每吞一片藥,都是在吞錢”。
從2002年起的兩年內陸勇就花了近60萬,幾乎掏空家底。

電影原型陸勇
轉機發生在2004年,陸勇偶然得知了仿製藥——印度格列衞。
所謂仿製藥,並非什麼假冒偽劣藥,而是跳過了歐美製藥公司專利的廉價藥。
印度的專利法,在很長一段時間都是不承認藥品專利的。
所以印度的製藥公司,可以大規模仿製其他製藥公司研發的新藥。
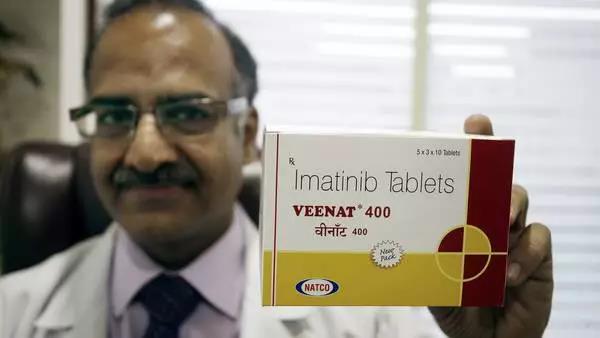
格列衞的印度仿製藥
從藥性上來看,印度格列寧與瑞士格列寧的相似度達99.9%,同樣救命。
但得益於“印度成本”,其價格僅售4000元,更是雪中送炭。到2014年,一盒價格已降至200元。
這巨大的差價,讓陸勇喜出望外。
自己託人買之餘,他還專門找到了一些“門路”,並把好消息告訴其他病友。
一來二去,陸勇也擔當起了“代購”的角色。
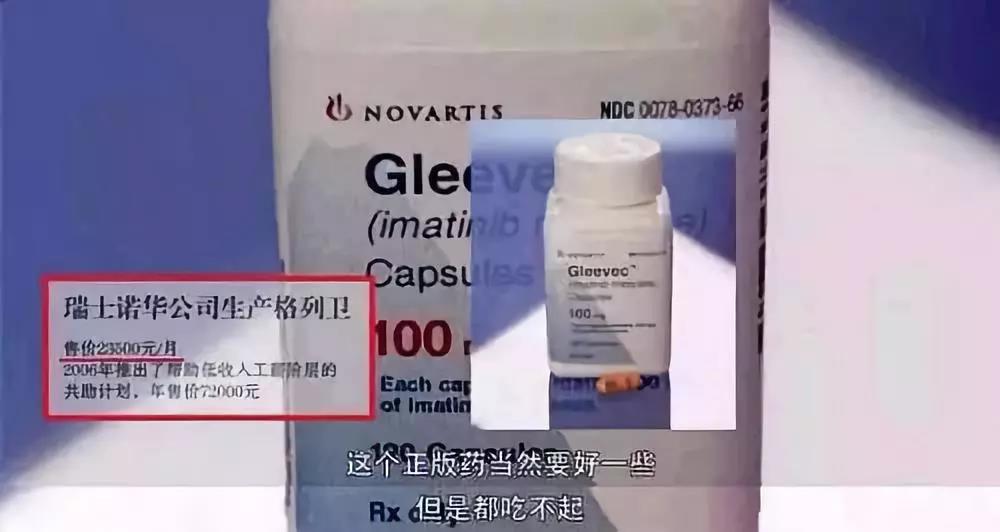
高價瑞士格列衞
雖並未從中牟利,但麻煩還是找上了他。
根據《中華人民共和國藥品管理法》,藥品進口必須經過藥品監督管理部門審查、批准和註冊,才能夠在中國合法銷售;
而未經註冊的,即以“假藥”論處。
此外,為病友提供幫助的過程中,他也從網上購買了他人名下的信用卡和銀行卡。
2014年7月,他被以“妨礙信用卡管理罪”和“銷售假藥罪”提起公訴。

其實電影的內容已經過改編,與原型陸勇出入頗多(陸勇本人還曾吐槽過,所以説不用被擔心劇透)。
但無論是藝術還是現實,始終都離不開格列衞這種藥物。
而它的定價,則是一切恩怨的源頭。
那格列衞究竟值不值這個價?是不是製藥公司使盡陰險手段,就算啃人血饅頭也要壟斷謀暴利?
瞭解這一藥物的研發過程,或許能幫助我們瞭解靶向藥物高價的原因。
其實這種藥物,本身就是一個傳奇。
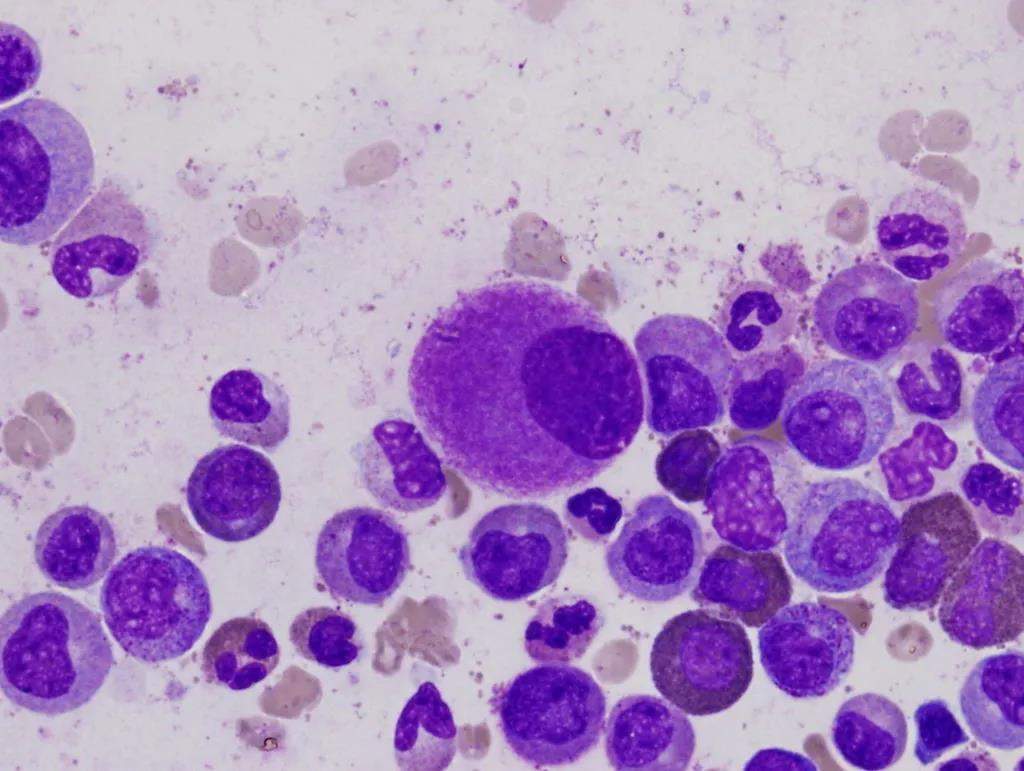
粒細胞惡性增殖
患了慢性粒細胞白血病,唯一的選擇只有骨髓移植。
但骨髓移植的難點也多,不但合適的配型難找,還總是伴隨着嚴重、甚至致命的副作用。
所以這樣一層層篩選下來,僅有20%至25%的患者擁有移植的資格。
而在未找到合適配型之前,病人只能靠其他手段來維持生命。
過去的方法如化療、干擾素治療,副作用極大。
使盡了渾身解數,也只有30%的患者能活過第五年。
直到格列衞的出現,才改變了患者的命運。
它成功地將慢粒白血病,變成了一種像糖尿病或高血壓的慢性病。
只需規範服藥即可控制病情,效果甚至比骨髓移植更好。
這也使原來的30%的倖存率,一下子提升到了近90%。
諾華格列衞
除了藥效神以外,製藥的整個歷程也堪稱典範。
作為首個上市的分子靶向治療藥物,它率先開創了腫瘤分子靶向治療的時代。
從摸清慢性粒性細胞白血病,到藥物的研製成功,耗時近半個世紀之久。
而在孕育格列衞的過程中,更是造就了兩個“世界第一”,五位美國院士,五位拉斯克獎(美國生物醫藥最高獎)。
這其中缺少任何一環,都有可能導致這種神藥胎死腹中。
上個世紀五六十年代,“病毒引起癌症”是醫學界的主流觀點。
不過當時,隨着DNA雙螺旋模型提出,遺傳學也迎來了生機。
雖有些離經叛道,但諾威(Peter Nowell)和亨格福德(David Hungerford)兩位學者,還是想在慢粒白血病細胞中尋找遺傳物質的變化。

諾威和亨格福德
果然利用改進的技術,他們竟發現了患者普遍存在着22號染色體變短的現象。
而這也是世界上首次在腫瘤細胞中發現染色體變異。
因這一現象是在費城首次發現,兩位發現者也稱之為“費城染色體”。
雖然這次實驗已經將“癌症的病因”往遺傳物質的變異上靠攏。
但科學家始終沒搞清楚,費城染色體為什麼會變短。
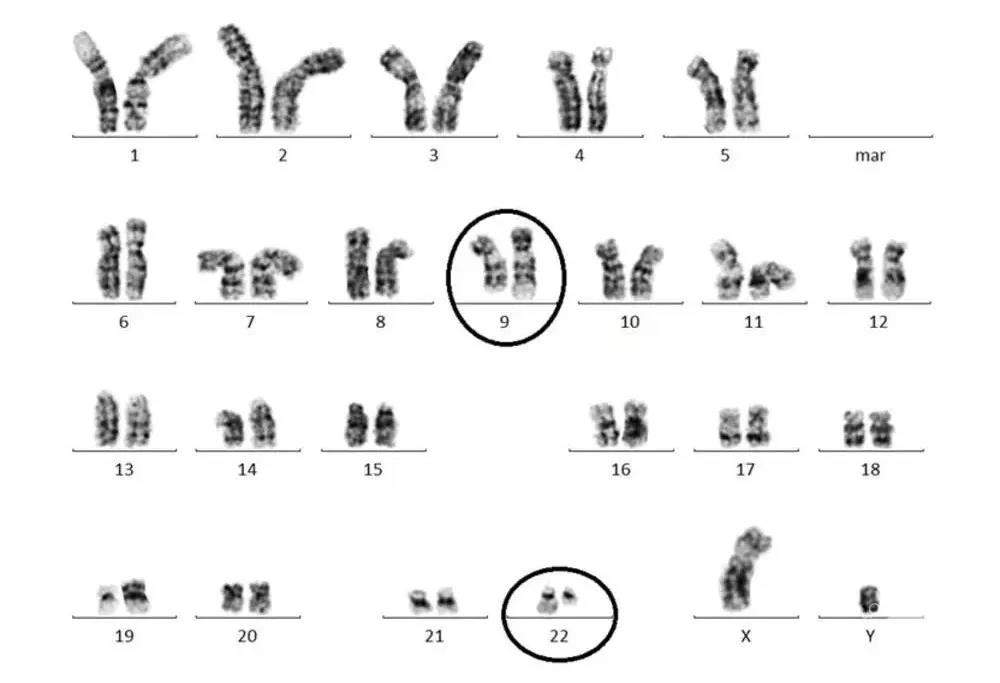
現在我們知道,癌細胞一般是來自正常細胞基因突變或染色體異常。
但那時,全世界卯足勁找了近十年,都沒找到第二種癌症存在染色體異常。
所以大家只好暫且認為費城染色體是個特例,也傾向將遺傳異常當成的結果,而不是原因。
最後,費城染色體在那個年代的臨牀價值,只能屈身於疾病診斷的指標。

珍妮特·羅利(Janet Rowley)
工欲善其事,必先利其器。
直到新染色體帶型分析技術的出現,使分辨率極大提高,這項研究才有了新突破。
1972年,藉助新技術芝加哥大學的遺傳學家珍妮特·羅利(Janet Rowley),才能揪出了慢粒白血病的真兇。
原來,費城染色體並非因缺失而變短,而是22號染色體與9號染色體間發生了交換。
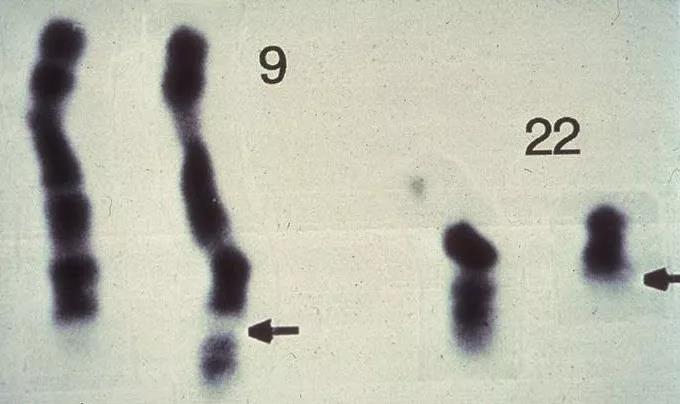
因22號染色體移出的片段較大,所以也造成了長度的明顯縮短。
在這之前,羅利已在顯微鏡下不知疲倦地找了十年之久,卻仍一無所獲。
除此之外,羅利還進一步在白血病中找出更多類型的染色體易位。
這些突破才讓科學界首次知道,染色體異常是引發癌症的一個重要原因。
幾年後,科學家發現的關鍵基因點更是個天大的好消息。
正常情況下,人類9號染色體上的基因ABL是不會致癌的。
但當染色體易位發生時,ABL就會與22號染色體上的基因BCR融合成一個新基因BCR-ABL。
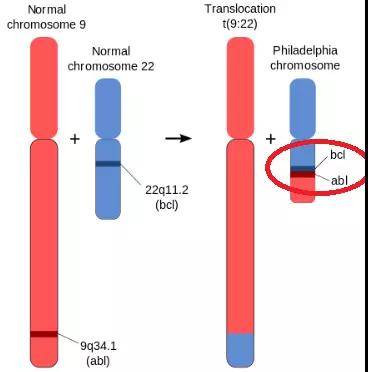
這個融合基因會導致ABL所擁有的酪氨酸蛋白激酶過度活化,從而引起細胞失控性增殖。
這種增殖會導致過量的未成熟白細胞產生和積累,而這正是慢粒白血病的標誌。
正常人每立方毫米血液含有約4000至10000個白細胞,但慢粒白血病患者則是正常量的10至25倍。
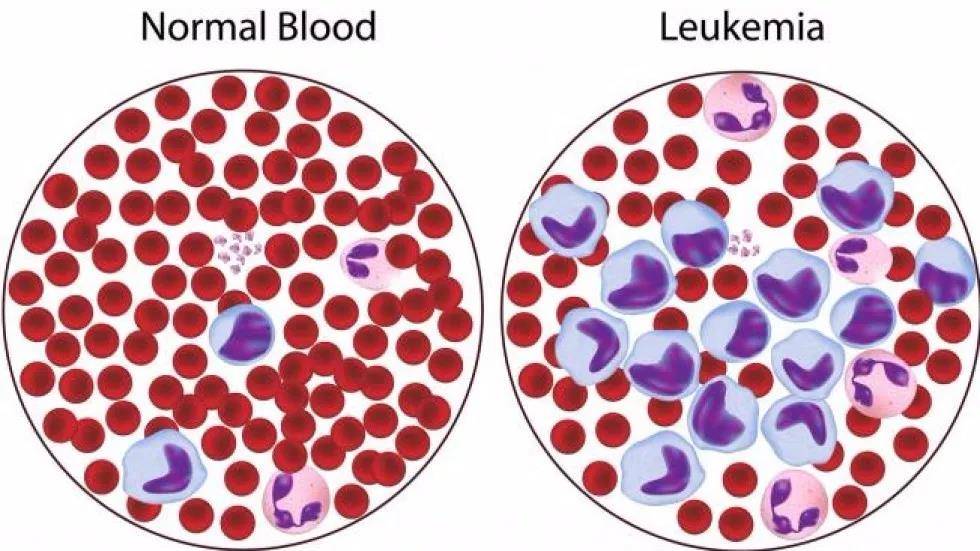
其實到這個時間節點,費城染色體導致慢粒白血病的作用機制已基本闡明,總共花了二十多年時間。
按照理論來説,只需要找到藥物選擇性地抑制ABL酪氨酸蛋白激酶的異常,病人可能就有救了。
那麼此刻,藥品的誕生應該指日可待了吧?前路可能還很漫長。

尼古拉斯·萊登(Nicholas Lydon)
1986年,Ciba-Geigy製藥公司的尼古拉斯·萊登(Nicholas
Lydon),便領導小組找到了化合物STI571,又名伊馬替尼(imatinib)。
傳統意義上,癌症治療是通過強力藥物對集體實施地無差別轟炸,健康細胞和癌細胞一起滅殺,也稱“細胞毒性藥物治療”。
靶向治療的概念則不同,有針對性地打擊癌症,且不會產生嚴重的附帶損傷。
而伊馬替尼,則可以選擇性地抑制ABL酶活性,對慢粒白血病擁有巨大的價值。
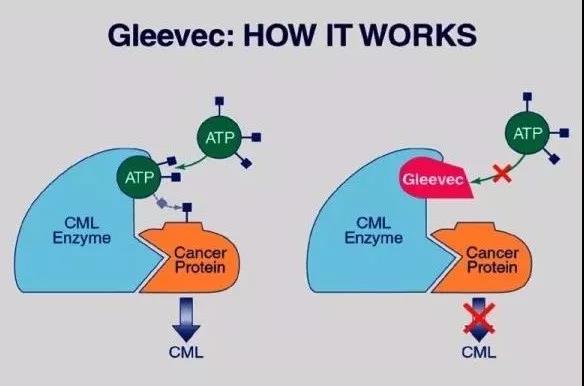
伊馬替尼(格列衞)的治療機制
但結果卻是,Ciba-Geigy製藥,仍對此興趣缺缺。
原因在於,慢粒白血病其實是一種較為罕見的疾病,屬四大成人白血病的其中一中。
在美國,每年得病的人數約為5千人,僅佔所有癌症的0.3%。
可以見得這種藥物的市場潛力也很低,盈利空間極窄。
當然,這還是在藥物開發成功的前提下。
一般情況下,研發一個新藥基本屬於九死一生(成功率只有9%)的狀態。
週期長,不確定因素有太多,失敗幾率極高都是需要考量的因素。

布萊恩·德魯克(Brian Druker)
不過,總有人不想放棄。
美國俄勒岡健康和衞生大學的腫瘤學家布萊恩·德魯克(Brian Druker)一直以來,就有個目標:“找到一家公司,該公司有這種BCR-ABL抑制劑,並將其帶去臨牀。”
於是1993年,德魯克和萊登這兩位富有激情的青年,便一拍即合,成立和合作小組。
萊登提供抑制劑,德魯克提供BCR-ABL白血病模型,冗長的實驗過程就這樣開始了。
而為了檢測伊馬替尼效果,加州大學洛杉磯分校的腫瘤學家查爾斯·索耶(Charles Sawyers)也加入了臨牀前測試團隊。

查爾斯·索耶(Charles Sawyers)
只是,Ciba-Geigy製藥仍然介懷市場太小,拒絕了開展進一步的臨牀試驗。
轉機發生在1997年,Ciba-Geigy和其他公司合併,成立了諾華公司。
德魯克的遊説下,諾華高層才同意在1998年6月啓動了Ⅰ期臨牀試驗 。
副作用極小,且臨牀效果極佳,讓所有人既意外又高興。
2001年,在臨牀試驗不足3年的情況下,美國FDA就為伊馬替尼開通了“綠色通道”,成為直接獲批的臨牀一線新藥。
之後諾華公司正式銷售伊馬替尼,商品正式命名為格列衞。
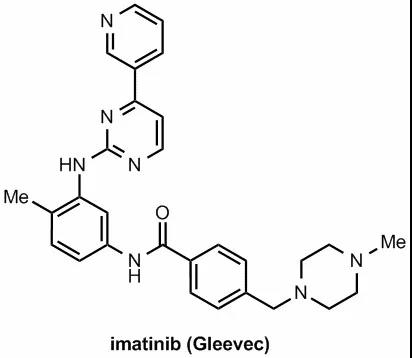
從費城染色體的偶爾發現,到格列衞正式誕生,風風雨雨已過去了近半世紀。
為表彰費城染色體的發現和機制闡明,諾威和羅利分享了1998年的拉斯克醫學獎(亨德福特早逝與此無緣)。
而在格列衞篩選、驗證和臨牀上做出卓越貢獻的三位科學家萊登、德魯克和索耶,分享了2009年的拉斯克醫學獎。
可以看出,格列寧的成功背後,凝聚着幾代科學家的共同堅持與智慧。

拉斯克醫學獎,是醫學界僅次於諾貝爾獎的一項大獎
其實那個單打獨鬥出奇跡的年代,早已經過去了。
從上個世紀末起,新藥研發的成分就一直在增長,沒個十億量級起步都無機會見到一種新藥面世。
如果沒有資本在背後支撐,整個流程也不可能順利完成。
而從1997年至2011年間,諾華的總研發花費就達836億美元。
其中只有21種新藥獲批,平均每個新藥花費為40億美元。
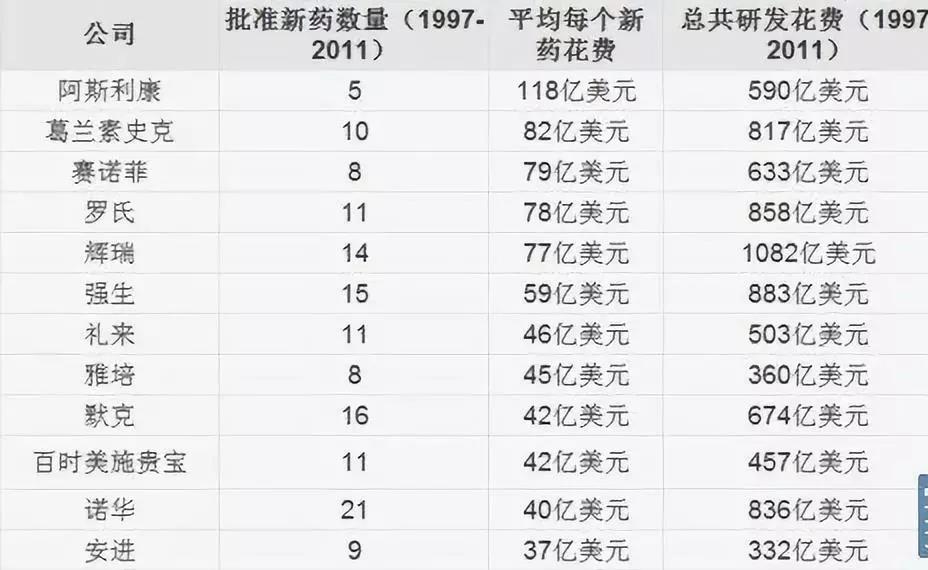
2016年,諾華的總銷售額為485億美元,淨利潤為66.98億美元。
低嗎?不低。高嗎?也不高。換算下來只夠研發一款半的新藥,銷量如何還未知。
投入鉅額的成本,能換來的成功率依然像買彩票一樣冒險。找到像格列衞這種藥,幾乎就像中了頭彩。
此外,一個新藥成功上市,其專利期一般只有10年。
過了專利期,這藥就不再是你的了,所有藥廠都能仿製。
如果賺不回本,撐不過去破產都是常有的事。
1996年,Ciba-Geigy與其他公司合併成立諾華公司,正是為了應對仿製藥的崛起。

研發公司冒大風險、斥巨資研發藥品,藥品價格自然高得離譜。
仿製藥確實解決了部分人眼前的問題,但也可能造成了研發公司利益的損失。
利潤是新藥研發最強的驅動力。
如果研發公司無法獲益,誰願意吃力不討好地開發新藥?最終受損的,可能仍是患者。

拿錢買命,幾乎是所有病人難以承受,卻又真實的寫照。
但對於癌症來説,有時候有錢都未必能夠續命,大部分中晚期病患者仍缺乏有效的治療措施。
無藥可醫,同樣也是一個血淋淋的現實。
相對其他癌病,患電影中的慢粒白血病,或許已是一種幸運。
從某種程度上來説,格列衞已是癌症治療中的特例。

它之所以能成功,除了科學家的努力以外,還在於慢粒白血病的特殊。
它只由染色體易位相關的單一異常蛋白引起,所以科學家能夠將所有的精力集中在單一的目標上。
然而現實中,一般癌症都由大量複雜的遺傳或環境因素引起,因此也具有許多個靶點,想要複製格列衞的成功並不容易。
而且同樣,只要研發關鍵節點缺一環,都有可能導致這種救命藥消失或是推遲送到患者手上。

其實,這部國產電影起初定的片名為《印度藥神》。
而在正式上映時卻改成了《我不是藥神》,給電影基調多加了幾分悲愴。
到底誰才是真正的藥神?是研發新藥的諾華,是“窮人福音”仿製藥公司,還是“劫富濟貧”的陸勇?可能都不是,也可能都是。
不過,值得高興的是電影最後提到的那個彩蛋,這個便不劇透了。