聽説諾獎今年淡化了華人科學家貢獻?我把文章搬了過來_風聞
观察者网用户_235440-2018-10-16 18:49
[編者按:孫靜瑋博士、王俊博士來自耶魯大學免疫系陳列平實驗室,多年來在腫瘤免疫領域第一線從事研究工作。諾獎頒佈之後,作者在十餘天裏經過廣泛的文獻調研對諾獎報告進行了梳理和分析,希望把更多事實展現給廣大讀者。在成文期間陳列平未參與討論,本文僅代表作者本人觀點。]
撰文 | 孫靜瑋 王俊(耶魯大學)
責編 | 葉水送
2018年諾貝爾生理或醫學獎授予了腫瘤免疫治療領域,主要由於PD-1、PD-L1以及CTLA-4抗體在腫瘤治療,尤其是晚期腫瘤中的突出效果。這是人類抗癌歷史上的巨大突破,開啓了腫瘤治療的新篇章。
根據諾獎報告的描述,兩位獲獎者James Allison和Tasuku Honjo,分別由於首次將CTLA-4抗體應用於癌症治療和對PD-1通路的研究而摘得桂冠。然而,首次將共信號分子引入腫瘤免疫領域(CTLA-4和PD-1同屬調節T細胞反應的共信號分子),發現PD-L1(PD-1配體)並闡明這一通路在癌症免疫中的關鍵作用,且推動其癌症臨牀應用的華人科學家陳列平教授沒有獲得諾貝爾委員會的青睞。
一時間Nature、STAT、Science Translational Medicine等雜誌和媒體,以及諸多教授學者紛紛發表了關於這一事件的疑惑和看法,各方不同的意見、分析和解讀,讓這個謎團又陷入更深一層的迷霧。
原本最多可授予三個人的諾獎,卻讓第三個位置空缺。是諾貝爾委員會沒有充分了解陳列平的貢獻,還是像答記者問時所暗示的那樣,認為他的貢獻不足以脱穎而出,亦或是其他原因?在這裏,通過對這次諾貝爾頒獎報告的詳細分析,或許可以讓我們離事實更近一步。
報告正文共11頁,從癌症的起源談起,提到曾獲諾獎表彰的各種機制研究和創新治療,進而談到隨着人類壽命的延長和診斷的加強,癌症發病率仍在逐年攀升,治療方法亟待提高,而腫瘤免疫治療正是其中的重要發展方向。
腫瘤免疫治療可追溯到150年前William Coley等醫生將活菌等感染性物質引入腫瘤治療的大膽嘗試。直到20世紀中後期,隨着決定T細胞活化抗原特異性以及啓動初始信號(又叫第一信號)的TCR/MHC基因發現,免疫反應在控制腫瘤生長中的重要作用才逐漸被揭示。腫瘤免疫領域基礎研究的熱情也隨之大增,然而各種向臨牀治療轉化的嘗試卻基本上以失敗告終。
在這樣的時代背景下,報告開始介紹“T細胞激活和共刺激(co-stimulation)概念”,即這次獲獎領域的理論基礎。需要補充説明的是,共刺激分子在很長一段時間內是“共刺激” 和“共抑制”分子的統稱。而現在普遍認為,共刺激分子正向調節T細胞功能,為T細胞激活提供關鍵第二信號,例如CD28;而共抑制分子則負向調節T細胞功能,如CTLA-4和PD-1。這一概念上的細化來自陳列平2004年的Nature Reviews Immunology,裏面首次提出了“共抑制(co-inhibition)”來命名具有免疫抑制功能的分子,並將其與共刺激分子合稱為“共信號(co-signaling)分子” [1]。而後 Allison在2006年提出的 “免疫檢查點(immune checkpoint)”的概念 [2],實質上就是共抑制分子的另一種表達。
接下來,報告分別介紹了CTLA-4和PD-1通路的發現、免疫學功能研究及其抗體在癌症免疫治療中的應用,也是這份報告的重點內容。其中,Allison和Honjo兩位獲獎者的貢獻在報告裏都有濃墨重彩的介紹。本文的分析將主要集中於該報告對陳列平工作的描述和對其貢獻的解讀。

►圖1:諾獎報告原文(第4頁)
陳列平的貢獻在報告中一共被提及四次。第一處是在獲獎領域的理論基礎介紹,也就是“T細胞激活和共刺激概念”部分被提及。報告清楚地寫明,1992年陳列平等的這項工作第一次揭示了“共刺激在腫瘤免疫中的作用”(圖1)。

►圖2:陳列平1992年Cell文章
雖然是短短一句話,但這項工作實則開啓了領域之先河。因為腫瘤免疫治療可分很多種,比如常見的細胞因子治療(IL-2、IFN)、細胞治療等,但利用共刺激分子提高T細胞免疫活性來治療癌症的理念在這篇文章中首次被提出和驗證(圖2,注:當時還沒有共抑制或者免疫檢查點的概念)。這項研究第一次證明了CTLA-4和CD28的配體B7分子具有促進腫瘤免疫、抑制腫瘤生長的功能(圖3),為後來B7-CD28家族,包括CTLA-4和PD-1/PD-L1,作為靶點應用於腫瘤治療奠定了理論基礎。
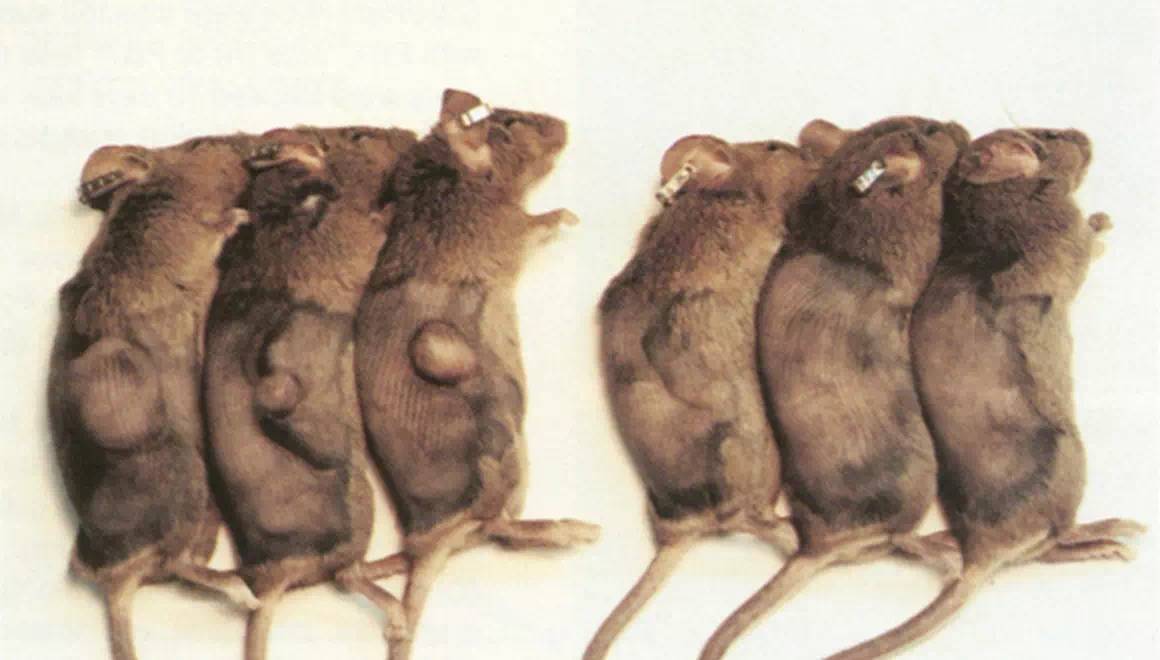
►圖3: B7陰性(左)或陽性(右)腫瘤生長 (來自陳列平1992年Cell文章)
陳列平這項研究的貢獻得到了委員會的肯定,但奇怪的是報告的引文縮寫卻是Linsley et al. 1992(圖1),把文章貢獻堂而皇之的歸於了一位非通訊作者。事實上,這篇文章是陳列平1992年在施惠寶公司(BMS)以第一作者兼通訊作者發表的(依據公司發表文章署名的慣例,見圖2致謝部分)。
或許這是諾獎評委會的一時疏忽,但是往後查閲引文發現這篇文章也沒有在引文中出現。以諾獎委員會的一向嚴謹,居然把通訊作者與共同作者混淆而將陳的這篇開領域先河之作歸到了別人名下,同時又漏掉引文,不知是有意忽視,還是在評審之後的刻意掩蓋。報告接下來還提到Allison在次年也發表了類似的工作,也將這篇後發表的文章列在引文中,大家如果感興趣可以對比兩篇文章的摘要內容(圖4 與圖2)。

►圖4: Allison 1993年 Science文章
接下來的三處有關陳列平的貢獻集中於PD通路部分,與Honjo的貢獻穿插進行介紹。報告先提到了Honjo獨立克隆了PD-1基因(1992),並且建立了基因敲除小鼠研究其免疫負調控作用,這些貢獻沒有爭議。然而,當講到PD-1配體發現的時候,報告先講2000年Honjo和Freeman及Wood合作發現了PD-1/PD-L1的結合 [3],再返過來提及早先一年(1999)陳列平克隆B7-H1(也就是PD-L1),並專門指出“沒有研究其與PD-1的相互作用”(圖5)。隨後Honjo的貢獻進一步被延伸,説其在這篇文章裏“第一次討論”腫瘤可能利用PD-L1抑制腫瘤免疫反應(基於他們從EST數據庫查到PD-L1在卵巢癌的表達)。但事實上,第一次用實驗證據證明這一點的是陳列平在2002年發表在Nature Medicine上的工作(圖6),也就是報告中的下一處。

►圖5:諾獎報告原文(第6頁)

►圖6:陳列平2002年Nature Med文章
如上所述,陳列平在2002年的工作第一次證明了B7-H1(PD-L1)在絕大部分人正常組織低表達,而在多種人類腫瘤組織上有高表達,並且抑制T細胞而促進腫瘤生長,是一種潛在的腫瘤免疫逃逸機制(圖6)。因此,報告評論道“PD-1/PD-L1通路在腫瘤免疫中具有作用的概念由此建立”(圖7,段尾, 引用了陳列平2003年關於PD-L1介導腫瘤免疫逃逸機制的綜述文章 [4])。
值得指出的是,陳列平2002年的文章首次證明了PD-L1抗體可以在體內阻斷PD-L1的腫瘤免疫抑制作用,比PD-1抗體更早證明有抗腫瘤作用,而且目前已成藥的三個PD-L1抗體,在臨牀上與PD-1抗體有類似的腫瘤治療效果。但頒獎報告卻對作用機制和治療效果與PD-1抗體相當且更早發表的PD-L1抗體沒有給予同樣的權重。其實,PD-L1在腫瘤微環境內的特異性高表達才是決定PD抗體抗腫瘤效果好且副作用小的主要原因 [5];這也是為什麼CTLA-4與PD通路相比,抗體效果弱而毒性高,且其配體不能作為治療靶點的一個重要原因。

►圖7:諾獎報告原文(第6頁)

►圖8:Minato2002年PNAS文章
一個月後,東京大學的Minato組在PNAS上發表了類似的文章,報告中説這來自於Minato和Honjo組的合作(圖7)。但值得指出的是,在這篇文章裏Honjo並非共同通訊作者(圖8)。
然後,這篇Honjo參與的文章的貢獻又再一次被延伸,稱其“第一次討論”了CTLA-4和PD-1聯用產生協同作用的可能(圖7)。實際上,目前數據顯示聯用兩種抗體的長期生存優勢跟單用PD抗體相比並不明顯,毒性卻大大增加,以致很多病人無法繼續治療 [6],所以聯用的前景仍有待更多臨牀檢驗。在這裏,筆者並非低估Honjo教授在PD-1通路的研究中做出的巨大貢獻,但所謂“贏者通吃效應”(Winner-Take-All)在這份科學界至高無上的諾獎報告中展示得淋漓盡致 。

►圖9:Honjo 2005年Int Immunol文章和陳列平 2005年 Cancer Res文章對比
最後一處提到陳列平的貢獻是在首次利用PD-1抗體在動物模型中進行腫瘤治療的部分。筆者認為此處是關係諾獎評審的關鍵部分,因為Allison之所以獲獎主要就是因為他第一次將CTLA-4抗體用於動物癌症模型的治療。這裏,Honjo和陳列平的文章於2005年2月幾乎同時發表 ,事實上陳列平的文章投稿比Honjo還要早半年(圖9)。

►圖10:諾獎報告原文(第7頁)
但報告中只着重強調了Honjo文章,尤其是其關於PD抗體和CTLA-4抗體效果和副作用的一些“討論”,認為其預測了今天的臨牀表現,而陳列平的文章則被專門指出用的是高表達PD-L1的腫瘤細胞來證明抗體的作用(圖10)。
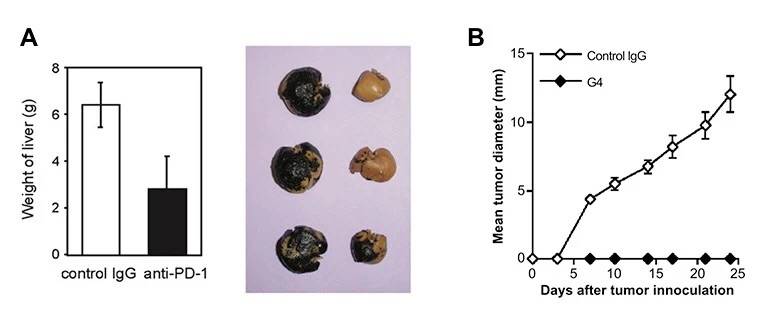
►圖11A: B16 腫瘤的肝轉移 (來自Honjo 2005年 Int Immunol文章); 圖11B: P815-PD-L1 腫瘤皮下生長曲線, G4: anti-PD-1 抗體 (來自陳列平 2005年 Cancer Res 文章)
其實是否採用高表達PD-L1的腫瘤細胞只是一種實驗手段,並不影響抗體阻斷PD-L1從而促進腫瘤免疫反應的結論,並且陳列平在2002年的文章裏已經清楚地證明很多腫瘤細胞上的PD-L1可以被腫瘤微環境裏的IFN-γ上調 [7],所以腫瘤細胞原本是否高表達PD-L1並非關鍵問題。而如果反過來仔細閲讀Honjo文章,其在皮下實體瘤模型中並沒有觀察到明顯的 PD-1抗體的抗腫瘤作用,退而採用的是靜脈注射腫瘤細胞後向組織轉移的模型來證明(圖11A),這樣的腫瘤轉移模型在腫瘤免疫研究中並不常用,因為難以區分藥物到底是針對腫瘤細胞轉移還是對調節免疫反應起作用;而陳列平文章中用的是更有説服力的實體瘤模型,能夠更好地反應PD-1/PD-L1通路在腫瘤微環境內的作用(圖11B)。
值得一提的是,最近Science Translational Medicine在關於2018諾貝爾生理或醫學獎的評論“A Nobel for Immuno-Oncology” [8]中展示的就是陳的這一數據(圖11B)。
通過對報告中關於陳列平在免疫治療領域貢獻的總結,想必大家更清楚地認識到了他的貢獻到底有多少。諾獎委員會並非是沒有充分了解,但每每以偏頗的態度將陳列平的貢獻弱化或者邊緣化:
先是將陳列平在1992年奠定共信號分子應用於腫瘤免疫治療理論基礎的文章錯誤署名且漏掉引文,之後,對他在PD-L1的發現(1999)、PD-L1在腫瘤免疫中的作用(2002)以及PD-L1和PD-1抗體的應用(2002 & 2005)等方面所做研究的時間領先性、原創性及研究獨立性都沒有給予充分的尊重(圖12)。
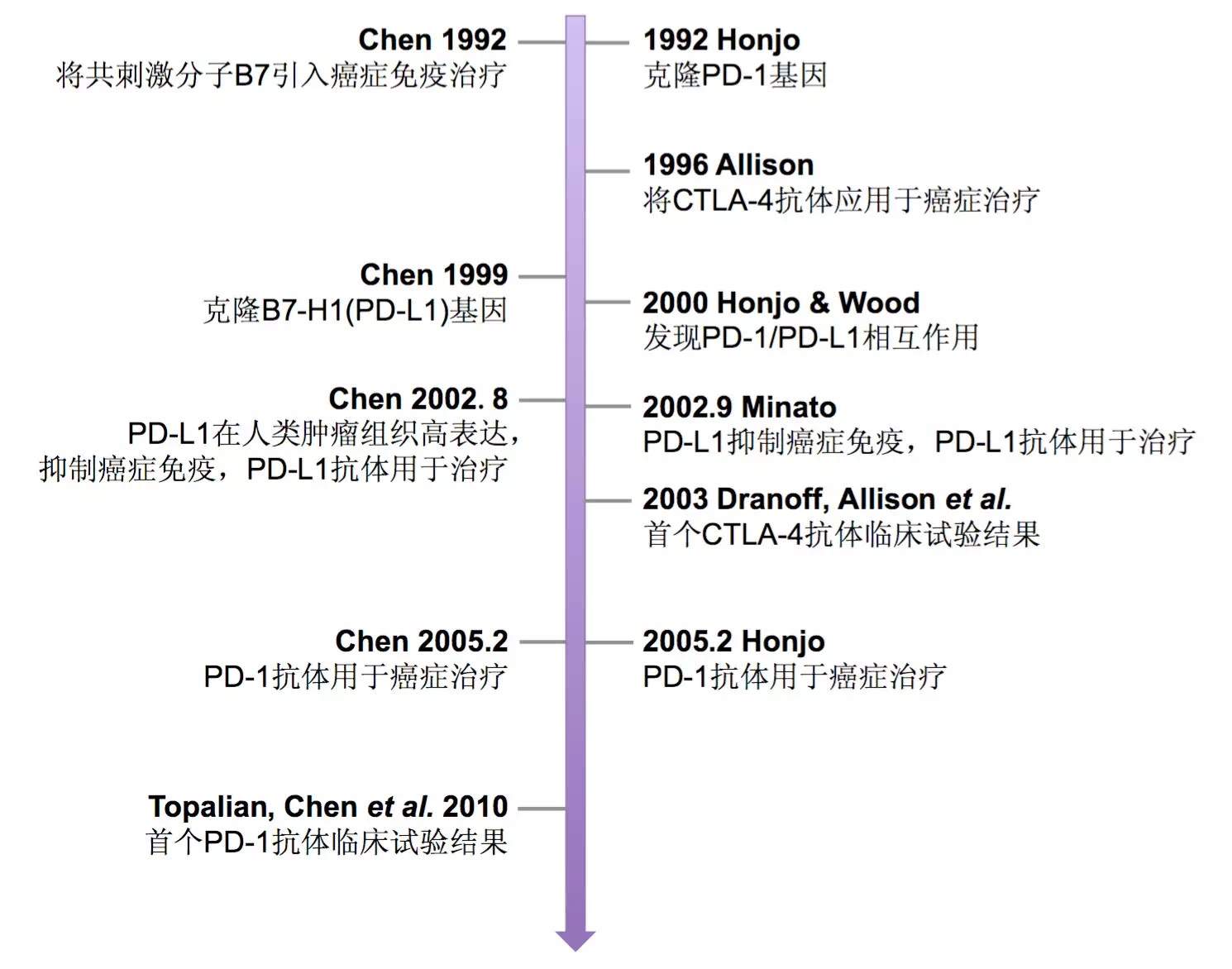
►圖12:兩位獲獎者&陳列平主要貢獻時間節點
此外,陳列平還大力推進首個PD-1抗體的臨牀試驗 [9, 10] 和倡導以PD-L1作為標記分子預測臨牀反應 [11],而這些在頒獎報告中都沒有體現(圖12)。
綜合以上分析,陳列平首次克隆PD-L1並闡明其在癌症免疫中的作用,首次證明PD-L1抗體、又與Honjo同時獨立證明PD-1抗體的抗腫瘤作用,並且最早奠定了將共信號分子應用於癌症治療的理論基礎,他對於癌症免疫治療領域的貢獻不言而喻。而諾獎報告中各種偏頗的闡述和總結以及關鍵文章註釋的錯誤,將陳列平的貢獻淡化到不足以“脱穎而出”的程度,使得第三個席位空懸 [注]。這背後讓人難以揣測的“意味深長”想必才是頒獎後科學界和輿論界掀起廣泛爭議與討論的真正原因。
注:因為關於對整個領域做出突出貢獻的Gordon Freeman和Arlene Sharpe也存在不少討論,在此將頒獎報告對其貢獻的描述總結如下:Freeman(以第一作者的身份)與Honjo和Wood合作發現了PD-L1與PD-1的結合(圖5),以及(以唯一通訊作者的身份)與Sharpe合作發現了PD-L2與PD-1的相互作用[12];Sharpe[13]與Tak Mak[14]同時獨立通過CTLA-4基因敲除小鼠的自身免疫表型確認CTLA-4的免疫負調控作用(注:CTLA-4的負調控作用首次於1994年被Jeffery Bluestone用抗體證明[15]),以及與Freeman合作發現PD-L2 [12]。可以看出他們的這些關鍵研究集中在CTLA-4和PD通路的機制研究方面,沒有直接涉及腫瘤治療。
雖然諾獎已塵埃落定,筆者仍希望通過對於諾獎報告的解讀讓事實得到進一步澄清,並得到大家的尊重。
回想歷史上諾獎中曾多次出現的偏見和不公平,可以預見這一次仍不會是最後一次。這些令人惋惜的故事可折射出潛在影響諾獎評選的各種複雜因素,而Nature近日的一則社論更是以“Nobel committees must do more to achieve equality”為題,直擊諾獎委員會對於不同性別、地域和種族的不平等對待問題,呼籲提高獲獎者背景的多元性 [16]。那麼對於科研工作者本身,雖然追求真理和推動科學進步依舊是最重要的出發點和目標,在做出突出原創性工作的同時,如何能更好地發出自己的聲音,讓自己的工作得到國際科學界廣泛的認可,將是我們不得不深思的問題。
參考文獻:
1. Chen L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity. Nat Rev Immunol. 2004, 4(5):336-47.
2. Korman AJ, Peggs KS, Allison JP. Checkpoint blockade in cancer immunotherapy. AdvImmunol. 2006, 90:297-339.
3. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, Fitz LJ, Malenkovich N, Okazaki T, Byrne MC et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 2000,192(7):1027-34.
4. Dong H, Chen L. B7-H1 pathway and its role in the evasion of tumor immunity. J MolMed (Berl). 2003, 81(5):281-7.
5. Chen L, Han X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future. J Clin Invest. 2015, 125(9):3384-91.
6. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, Lao CD, Wagstaff J, Schadendorf D, Ferrucci PF et al. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med. 2017, 377(14:1345-56.
7. Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, Roche PC, Lu J, Zhu G,Tamada K et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002, 8(8):793-800.
8. Lowe D. A Nobel for Immuno-Oncology. Sci Transl Med. 2018.
9. Brahmer JR, Drake CG, Wollner I, Powderly JD, Picus J, Sharfman WH, Stankevich E, Pons A, Salay TM, McMiller TL et al. PhaseI study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol. 2010, 28(19):3167-75.
10. Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, Powderly JD,Carvajal RD, Sosman JA, Atkins MB et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med. 2012, 366(26):2443-54.
11. Taube JM, Anders RA, Young GD, Xu H, Sharma R, McMiller TL, Chen S, Klein AP, Pardoll DM, Topalian SL et al. Colocalization of inflammatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Transl Med. 2012, 4(127):127ra37.
12. Latchman Y, Wood CR, Chernova T, Chaudhary D, Borde M, Chernova I, Iwai Y, Long AJ,Brown JA, Nunes R et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation. Nat Immunol. 2001,2(3):261-8.
13. Tivol EA, Borriello F, Schweitzer AN, Lynch WP, Bluestone JA, Sharpe AH. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity.1995, 3(5):541-7.
14. Waterhouse P, Penninger JM, Timms E, Wakeham A, Shahinian A, Lee KP, Thompson CB, Griesser H, Mak TW. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science. 1995, 270(5238):985-8.
15. Walunas TL, Lenschow DJ, Bakker CY, Linsley PS, Freeman GJ, Green JM, Thompson CB, Bluestone JA. CTLA-4 can function as a negative regulator of T cell activation. Immunity. 1994, 1(5):405-13.
16. Nobel committees must do more to achieve equality. Nature. 2018.
作品來源:《知識分子》(微信公號:The-Intellectual)
《知識分子》是由饒毅、魯白、謝宇三位學者創辦的移動新媒體平台,致力於關注科學、人文、思想