《紐約時報》:我的基因我做主?科學家説不_風聞
鹰击长空-黑名单专治乌贼、反智、喷子、谣棍和杠精2018-11-26 20:18
前言:由來自中國深圳的科學家賀建奎宣佈利用CRISPR技術成功培養出能夠抵抗艾滋病的人類嬰兒所引發的科學界和公眾對於基因編輯技術直接使用於人體細胞倫理道德方面的擔憂和反對。
與轉基因不同的是,轉基因在農作物和食品中的應用在全世界科學界獲得了一致認可,超過130位諾貝爾獎重量級科學家聯名支持,而此次涉及到CRISPR技術直接使用於人類嬰兒所帶來的巨大倫理風險,則引發了百位科學家的聯名反對。
那麼到底什麼是CRISPR技術,以及其涉及的倫理風險到底是什麼?有觀網網友在私信詢問了我這個問題,為了證明科學家在很早就對基因編輯技術在人體直接應用的擔憂,以及回答為啥外國科學家或者其他的科學家沒有進行這樣的實驗,我特地找了一篇較早的文章來解答這個問題。
2015年3月19日,一批世界頂尖的生物學家呼籲,在全球範圍內暫時禁止在可遺傳給下一代的人類DNA上使用一種新型的基因組編輯技術。
什麼是CRISPR技術?
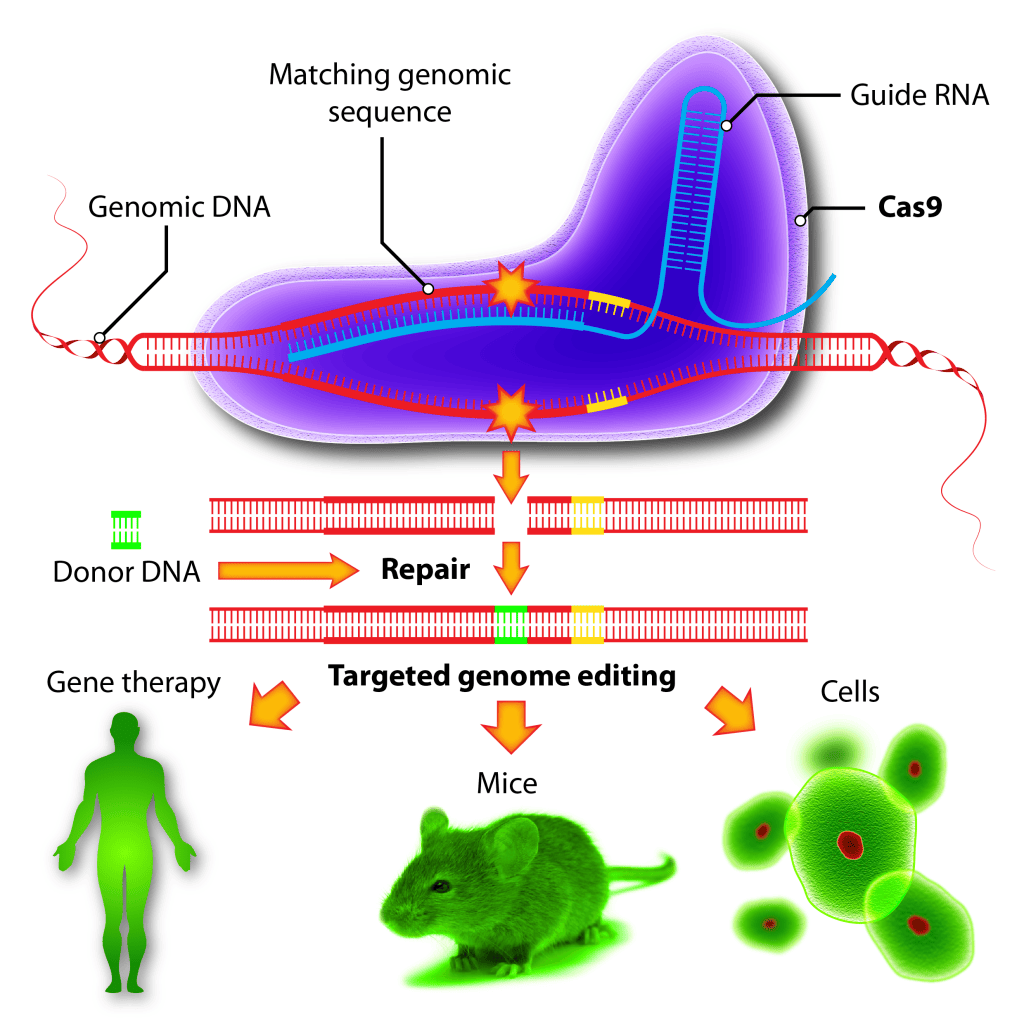
1987年,日本學者發現,在大腸桿菌的基因末端(鹼性磷酸酶基因的3’側翼區)有一段間隔重複的DNA序列。之後更多的研究證實,這種重複序列廣泛存在於細菌中。2002年,將其命名為CRISPR(clustered regularly inter spaced short palindromic repeats),即成簇的規律間隔的短迴文重複序列區域。
2005年,美國等國家進行的多項研究顯示,CRISPR中的間隔序列和噬菌體或質粒的序列之間存在同源性,有些甚至達100%。這表明這些間隔序列可能來源於噬菌體基因組。2007年,科學家通過實驗證實了該觀點,並在鏈球菌中通過增減CRISPR中的序列改變了其對噬菌體的免疫力。
在CRISPR序列位點的周圍存在着一組序列(Cas蛋白組),這其中包含有核酸內切酶、核酸外切酶和DNA-結合區等結構域。隨着對不同細菌的基因組的測序和更多相關研究的積累,越來越多不同細菌中的CRISPR系統和Cas基因被發現,其作用機理也逐漸清晰。而Cas蛋白就是其中位點的關鍵作用點,研究者們根據其作用方法的不同,將其分為了三類(Ⅰ型、Ⅱ型、Ⅲ型)。
2012年,CRISPR/Cas9技術開始嶄露頭角,源於杜德納(Doudna)和其同事發現了一個比較簡單的CRISPR(Ⅱ型)系統並對其進行了改造。在這套系統中,只需要一個Cas9核酸內切酶和一條合成兩種RNA(CRISPR-derived RNA,crRNA和trans-acti vating RNA,tracrRNA)的嵌合RNA,就可以對雙鏈DNA進行編輯。同時,他們還闡明瞭其中RNA和編輯目標DNA之間鹼基配對的原則。2013年1月,科學家用這項技術首次成功對人類細胞的特定基因進行了定向編輯。
CRISPR/Cas9技術較之前的基因編輯技術,如歸巢內切酶(HEase)、鋅指核酸酶(ZFN)和轉錄激活因子樣效應物核酸酶(TALEN)技術的優點有哪些呢?
首先,CRISPR/Cas9技術的可編輯位置較多,理論上每8個鹼基中就可以找到一個可進行編輯的位置。
其次,CRISPR/Cas9技術更具拓展性,如其可僅對DNA雙鏈中的單鏈進行編輯,規避染色體變異的風險。
再次,Cas9蛋白可以與其他功能蛋白連接,在特定DNA序列上進行相關蛋白作用的研究。
最後,也是最重要的一點,CRISPR/Cas9技術操作簡便且相對之前的編輯技術經濟得多,只須簡單的幾步就可完成,幾乎所有實驗室都可以進行。
節選自《引領基因編輯時代的革命》
生物學家們擔心,新的技術非常有效且容易使用,一些醫生有可能會在新技術的安全性尚未得到確認前推進其使用。他們希望公眾意識到關於這項技術的倫理問題——新的技術可以用來治療遺傳性疾病,但同時可能用來改善諸如相貌或智力等方面的品質,後者被許多倫理學家認為是一條絕對不應該走的道路。
“利用這項技術可以調控人類遺傳,這就是我們要提出這個問題的原因,”在《科學》雜誌撰文討論這一話題的作者之一、曾擔任加州理工學院院長的戴維·巴爾的摩(David Baltimore)説。
幾十年來,倫理學家一直對改變人類生殖細胞(germline)心存憂慮,改變人類的精子、卵子或胚胎等遺傳細胞可持續一生並能遺傳給下一代。直到今天,這些擔心還是理論上的假設。但是,2012年發明的這項技術使精確編輯基因組成為可能,而且更為方便。這種技術已經被用來編輯小鼠、大鼠和猴子的基因組,很少有人懷疑,它可能以同樣的方式用於人類。
這種技術有能力修復或增強人類的任何基因。“它提出了一個最根本的問題:我們將如何看待我們人類的未來,我們是否會採取戲劇性的舉措,修飾我們自己的生殖細胞,甚至在一定程度上控制我們的遺傳命運。這使人類面臨巨大的風險,”喬治·戴利(George Q. Daley)説。他是波士頓兒童醫院(Boston Children’s Hospital)的幹細胞專家,也是在《科學》雜誌發表這篇文章的作者之一。
此次在《科學》撰文的生物學家支持這項技術繼續在實驗室進行研究,幾乎沒有科學家認為這項技術可用於臨牀使用。**任何此類的使用在美國和歐洲都受到嚴格的監管。**例如,美國科學家在用這項技術改變人類生殖細胞以治療遺傳性疾病前,必須向美國食品與藥物管理局(Food and Drug Administration)提交治療方案。
不過,文章的作者們擔憂的是在科學領域缺少監管的國家。他們敦促,“在管轄不夠嚴格的區域,科學家應該避免嘗試在臨牀應用中對人類生殖細胞的基因組進行修改”,直至“科學和政府機構充分討論”所有的可能的影響和後果。
儘管這一禁令在法律上不會強制實施,看上去不太可能發揮全球性的影響力,但這樣的先例還是存在的。1975年,全世界的科學家被要求停止使用重組DNA技術操縱基因,直到相應的規則建立起來。
“那個時候我們要求任何人都不要做這方面的實驗,據我所知,實際上也是如此,”巴爾的摩博士説,他是1975年呼籲停止使用重組DNA技術的科學家之一,“所以,在美國你可以相信依賴道德的威信,這也是我們所希望的。”
DNA重組技術是第一個用來改進遺傳性物質的技術。但該技術的主要問題是它無法在標靶位置編輯DNA,而任何基因上的非精確改變都可能是致命的。最近的兩種方法,鋅指(zinc fingers)和TAL效應子(TAL effector),接近了精確編輯基因的目標,但是這兩種方法技術上難度較大。新的基因組編輯方法為加州大學伯克利分校的詹妮弗·A. 杜德納與瑞典于默奧大學(Umea University)的埃馬紐埃爾·卡彭蒂耶(Emmanuelle Charpentier)所發明。
這種基因編輯方法的首字母縮寫為Crispr-Cas9,在類似於自然免疫系統的機制中,其細菌能夠記住襲擊自己的病毒的DNA,當相同的病毒再侵略時可以做好防禦準備。研究人員通過對引導序列的選擇,能夠簡單地裝備好防禦系統,對於任何出現在防禦系統面前的基因組,這一系統都會破壞其DNA配對。杜德納博士以通訊作者的身份在《科學》雜誌發表文章,號召管制Crispr-Cas9技術的應用,並組織了形成這份聲明的會議。

詹妮弗·A.·杜德納(Jennifer A. Doudna,) 是新型基因組編輯技術Crispr-Cas 9的發明人之一,圖片為她在加州大學伯克利分校的辦公室。杜德納博士以通訊作者的身份撰文要求在世界範圍內禁止使用該技術,給科學家、倫理學家和公眾以時間充分理解圍繞這個科學突破的問題。
Crispr-Cas9技術雖然高效,但偶爾會在人們意想不到的地方誤切到基因組。臨牀中到底可以容忍多少錯位編輯而不發生問題和危險,杜德納小組希望對這一問題在人類基因被編輯前徹底探明。
科學家也表示,用一個正常的基因去替換一個異常的基因看似完全無害,但可能並非如此。
“我們擔心人們在不瞭解改變基因後的效應之前,就盲然地把基因組做了改變。我個人以為,在很長一段時間內,我們都還沒有聰明到對改變遺傳特徵的後果感到踏實,即使是在一個單一的個體中(做出基因改變)。”巴爾的摩博士説。
**許多倫理學家已經接受基因療法的觀念,這些基因改變在病人去世後也會隨之消失,但他們完全不接受改變生殖基因的做法,因為這些基因變化會遺傳給未來的幾代人。**今年2月,英國議會批准給自身線粒體缺陷的人類卵子轉移線粒體,這是一種含有DNA的小細胞器。不過,這種技術影響並不大,因為沒有基因被編輯。
威斯康星大學的生物倫理學家R. ·阿爾塔·沙羅(R. Alta Charo)説,對修改人類生殖細胞的態度大致存在兩大派別:一個是務實派,尋求利益與風險之間的平衡;另外一派則呼籲要“針對人類應該多大程度上改變自然,建立起內在邊界”。基督教的一些教義反對人類扮演上帝的做法,而在猶太教和伊斯蘭教的觀念裏,“人類應該改善這個世界”。沙羅認為自己更像是實用主義者,“我會試圖管控這些事情,而不是在一個新技術剛開始時就否定它。” 沙羅也是杜德納小組的成員之一。
愛德華·蘭菲爾(Edward Lanphier)和其他科學家上週在《自然》雜誌撰文,呼籲暫停修改人體生殖細胞,此前他們參與開發另一項基因組編輯技術——鋅指技術。蘭菲爾等人認為,對當前技術的使用可能“存在危險,倫理上不可接受”。
國際幹細胞研究學會(the International Society for Stem Cell Research)週四説,它支持該禁令。
以杜德納博士為首的科學家呼籲就這一事項進行公開討論,同時也力圖建立一些正式的程序,為使用人類基因組編輯技術建立指導原則,比如美國國家科學院召集了一個國際性的會議討論此事。
“我們需要建立原則性的協議以決定我們是否要以這種方式來提高人類的能力,” 耶尼施博士説,“必須有這種討論,因為有人正在躍躍欲試。”
原文作者: NICHOLAS WADE,發表於 紐約時報
關於CIRSPR在農作物和食品中的使用
《自然》雜誌於2015年10月19日發表報道稱,對基因組編輯的農作物,升級版的CRISPR技術可能會繞過生物安全法的審查。不過對於保守的歐盟來説,即使他們沒有外源DNA,人們還是可以將這類植物定性為基因改造生物的。
傳統上,研究者首先通過輸入與編碼生成Cas9酶的DNA序列,從而使植物中的CRISPR/Cas9系統開始工作。這種基因附着在質粒上,質粒是一個封閉環形DNA,它常常由農桿菌介導進入植物體內。因此,農桿菌DNA有可能融入在植物本身的基因組裏。即使不用農桿菌引入質粒,編碼cas9的基因片段本身也可能會被整合到植物體內的基因組裏。
目前,部分國家已經批准了CRISPR基因編輯技術在農作物和食品中的使用,由於其沒有轉基因技術通常涉及的外源基因,因此他不受現行部分國家關於轉基因作物使用的法律法規限制。不過,在我國,根據農業部相關法律的規定,凡是涉及基因編輯,修改的,都會被作為轉基因作物範圍管理,受轉基因相關法律法規的限制,其中,最著名的例子當屬袁隆平研發的除鎘大米,雖然不含有任何的外源基因,但因涉及基因敲除,因此仍受到轉基因相關管理規定的管轄。