哈佛單細胞全基因組測序已用於臨牀篩除基因缺陷生殖細胞,脱靶並非基因編輯應用障礙_風聞
Doufu-物理学博士-博士,研究员2018-11-27 07:01
南方科技大學的賀建奎副教授因為將基因編輯技術應用於臨牀,突然遭到鋪天蓋地的口誅筆伐。在閲讀了諸多關於 CCR5-Δ32基因相關的論文之後,我認為有必要為賀博士的研究做一些澄清和辯護。首先,我申明,我完全不認識賀博士,更與他沒有任何利益瓜葛,也不從事其相關學術研究。但是,據我所瞭解到的情況和技術手段,我不認為賀博士做這個研究是沽名釣譽,或是利慾薰心,反而認為其研究具有合理性和技術上的可行性——儘管CRISPR-Cas9基因編輯系統存在公認的脱靶的問題。當然,媒體報道給出的關於他的研究方法的信息非常有限,我只能從原理上給出其研究存在合理性的論證。
當然,既然我已承認自己是跨界發表看法,我想我也有必要讓大家對我的學術背景有大致的瞭解。我本科是生物工程專業畢業,碩士和博士轉入應用物理系生物物理專業(Biological
Physics),從事的研究內容涵蓋單分子熒光光譜技術,超分辨率顯微鏡技術開發,以及相關技術在生物醫學以及生物化學研究中的應用,包括新型微創癌症診斷方法的研發工作。我曾在跨國醫用設備企業從事研發用於產前篩查染色體異常的全自動熒光顯微鏡的工作,擔任光學設計工程師。目前我在瑞典卡羅林斯卡醫學院(諾貝爾生理或醫學獎頒獎院校)擔任資深研究員(senior
researcher),主要從事三維熒光原位雜交顯微鏡圖像新型分析方法的開發,用於研究細胞核內基因及染色體幾何構造和空間分佈,揭示核內基因結構和功能的關係。此處暫不詳述。儘管我自視為生物學領域的物理學者,以顯示我和絕大多數同事的區別(事實上區別是客觀存在的,我現在的工作涉及大量的複雜空間立體幾何以及結構力學等),但是畢竟我的工作均為醫學或者生物學的研究服務,長期和生物學家甚至臨牀醫生打交道,生物醫學相關的論文更在日常閲讀範圍之內,怎麼解讀生物醫學研究內容,我早已形成自己的獨立判斷。
且説很多非科研領域的讀者對於使用基因編輯技術敲除部分CCR5基因片段表示擔憂,擔心這種操作使得西方人有機會製作針對中國人的生物基因武器。事實上,如果大家稍微瞭解這個基因片段的話,反而會發現和想象的情況剛好相反。事實上,早在1998年,西方學術界就已經知道對HIV-1病毒具有抗性的CCR5的32個鹼基對缺失變異較為普遍地存在於白種人,也包括與歐洲地理位置相近的北非和西亞人種,而東亞人完全不存在這個基因缺失的變異類型即CCR5-Δ32[1]。賀博士的研究中把孩子的這個基因片段敲除,不僅使得孩子具有了相應的對HIV-1病毒的抗性,而且使得她們更不容易被針對——因為這種基因類型在白種人當中恰好較為普遍的存在。而對於CCR5-Δ32具有HIV-1病毒抗性,早在1996年就已經分別在Nature[2]和Science[3]雜誌有了相關報道。他們發現在美國有10%左右的白種人具有抗HIV-1病毒侵染的保護性變異:帶有CCR5-Δ32雜合子的人感染HIV-1病毒與普通人低35%[2],並且其感染者存活時間比普通人長超過10年之久[3],而CCR5-Δ32純合子無一感染。2005年,學者們繪製了該基因型在歐亞大陸的密度分佈圖[4],見下圖——很明顯可以看到CCR5-Δ32人羣分佈密度從北向南遞減的規律。
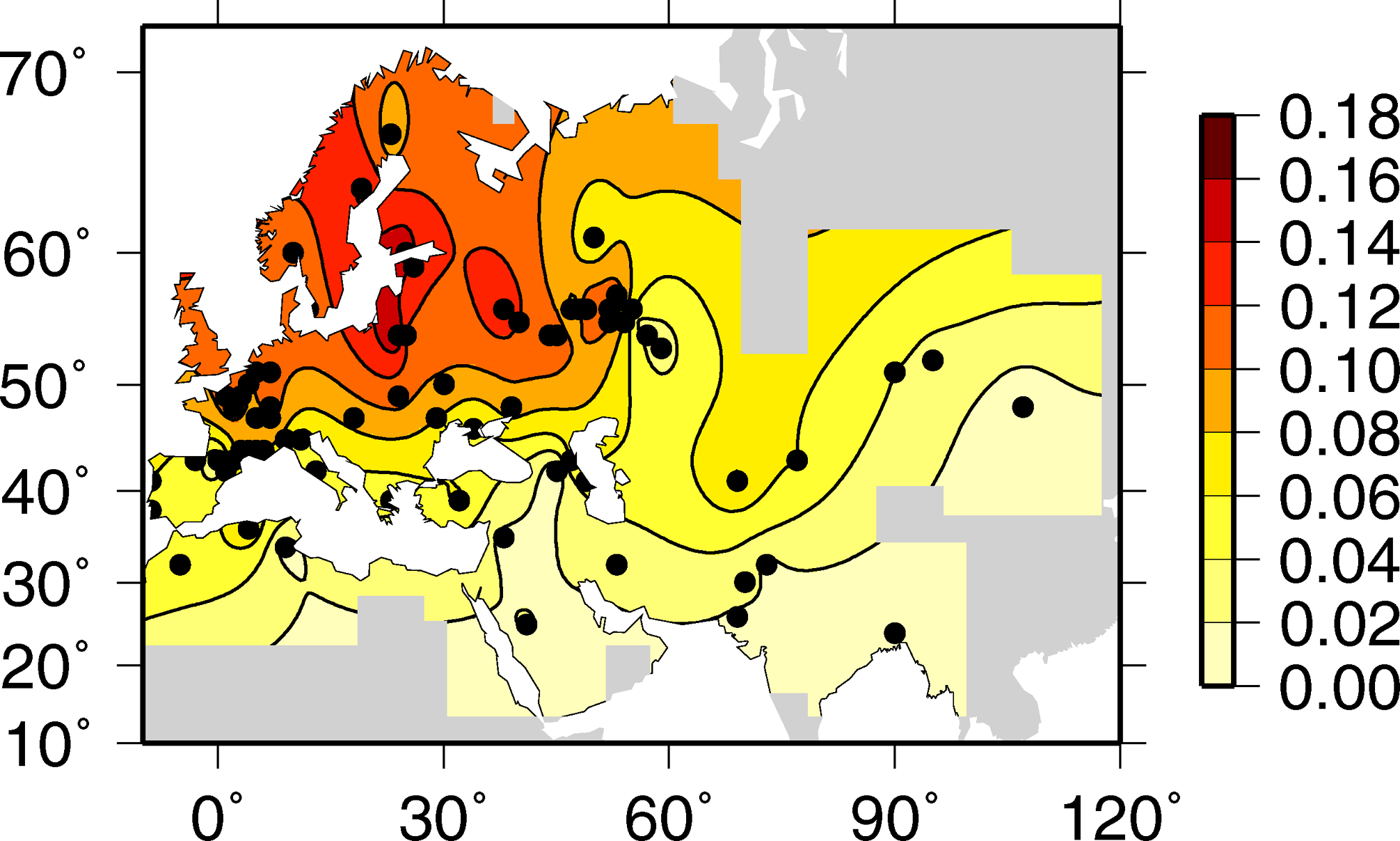
從整體上來看,歐洲人羣中大約有10%左右的人帶有CCR5-Δ32,而上文我援引的資料也提到美國人羣中這個比例也大約是10%,那麼西方帶有該基因型的人總數有大約一億人口了。他們並不存在什麼特殊的健康問題。當然,這當中絕大多數都是雜合子,純合子的比例比這低不少,舉估算,北歐人當中純合子的比例約為1%。以不到三千萬人口(兩千七百萬)總數來計算,這相當近似三十萬人口。重要的是,他們並無特別的健康問題。
對賀博士的研究的批評事實上主要集中於使用CRISPR-Cas9基因編輯系統公認的脱靶問題帶來的風險。所謂脱靶,顧名思義,就是儘管目的是要打A,但可能打到B。這確實是個非常關鍵的問題。因為如果把其他不該切掉的基因給切除了,那後果難以預測。如果只是做做細胞實驗,沒有誰會覺得是個大不了的事情,但是如果是活生生的生命,一旦出現這樣的失誤當然是難以接受的。為了安全起見,才有了這個倫理委員會的評定,要對實驗的可行性做預判,風險太大的當然應該要限制,這是體現對生命的尊重。這個態度是沒有問題的,也應當是學者秉持的行事標準。但是,同樣的,出於對生命的尊重,以及對現有技術的瞭解,我覺得這個研究依然是可以進行的。
究其原因,是因為我知道,由哈佛大學開發的基於單細胞全基因組測序的方法早已用於臨牀實驗[5],用來篩除具有基因缺陷的生殖細胞,並且誕生了健康的生命。雖然我不知道賀博士團隊採取的何種方法對CRISPR-Cas9編輯的產物進行測序,但是從新聞媒體的報道來看,他們給出了成功編輯的定量數據,甚至於他們明確指出有一個小孩只含有單條的CCR5-Δ32,而非百分之百成功的純合子,這説明他們有完備的測序數據。而基於單細胞全基因組測序的方法,是非常適合這種情況下用於篩除未成功編輯的脱靶生殖細胞的。到了2017年,學者們甚至開發出來可以檢測單個位點基因差異性,基於線性擴增的單細胞全基因組測序技術[6]。在這樣的情況下,完全可以使用來自父母雙親的生殖細胞受精卵分裂出來的單個子細胞作為參照進行全基因組測序,編輯脱靶的細胞完全可以通過測序篩除出去,這和通過單細胞全基因組測序篩除含有基因缺陷的生殖細胞並無兩樣。既然這個方法用於臨牀,而不被認為存在倫理問題,那麼賀博士的團隊的研究也不該被認為具有嚴重的倫理學問題——儘管CRISPR-Cas9基因編輯存在脱靶的風險,但是完全可以用已經獲得臨牀檢驗的單細胞全基因組測序技術把關。之所以我在這裏着重提單細胞全基因組測序技術,是因為這和傳統的全基因組測序手段最大的不同是因為它可以在單細胞水平上進行,這就極大的降低了倫理上的風險——除非大家認同為了測序破壞一個細胞也和殺死一個胎兒一樣不可饒恕。至少,我不認為這兩者是等價的!我也不認為科學倫理應該發展到這樣極端的程度!
最後,我再強調一點,我並不瞭解賀博士團隊如何進行的基因測序,我只是從我瞭解到的情況推導並不違背科學倫理而技術上可行的研究手段。
參考文獻:
[1]J. Claiborne Stephens, et. al., Dating the origin of the CCR5-Δ32 AIDS-resistance allele by the coalescence of haplotypes. Am. J. Hum. Genet. 62: 1507-1515 (1998).
[2]Michel Samson, et. al., Resistance to HIV-1 infection in caucasian individuals bearing mutatant alleles of the CCR-5 chemokine receptor gene. Nature. 382: 722-725 (1996).
[3]Michael Dean, et. al., Genetic restriction to HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 strutural gene. Science. 273:1856-1862 (1996).
[4]John Novembre, et. al., The geographic spread of the CCR5-Δ32 AIDS-resistance allele. PloS Biology. 3(11):e339 (2005).
[5]Lei Huang, et. al., Single-cell whole-genome amplification and sequencing: methodology and applications. Annu. Rev. Genomics Hum. Genet. 16:79–102 (2015).
[6]Chongyi Chen, et. al., Single-cell whole-genome analyses by Linear Amplification via Transposon Insertion (LIANTI). Science. 356(334):189-194 (2017).