多家公司基因編輯人體臨牀試驗將在美國啓動,申請已獲批准_風聞
今天敲钟人不来-2018-12-04 15:03
據新華社12月3日報道,美國一家基因編輯公司近日宣佈,將啓動一項利用CRISPR基因編輯技術治療某種遺傳性眼疾的臨牀試驗,相關申請已被美國監管部門接受。
據悉,在這一臨牀試驗中,基因編輯的對象是先天性黑朦病患者眼睛裏的感光細胞,這是一種體細胞,而非生殖細胞。體細胞的遺傳信息不會遺傳給下一代,所以不涉及倫理道德問題。

這一名為EDIT-101的療法由美國埃迪塔斯醫藥公司(Editas Medicine)與艾爾建公司共同研發。埃迪塔斯醫藥公司在聲明中表示,該療法“有望成為世界上第一種在人體內使用CRISPR技術的療法”。
聲明説,美國食品和藥物管理局已接受該公司為這一療法遞交的臨牀試驗申請,允許其使用CRISPR技術治療利伯先天性黑朦10型患者。
利伯先天性黑朦是一種由多個基因突變造成的遺傳性視網膜退行性病變,是兒童先天性失明的最常見原因,全球每10萬名兒童中有2至3人罹患該病。其中,10型是最常見的類型,佔該遺傳病患者總數的20%至30%。目前,利伯先天性黑朦尚無有效療法。
按計劃,此項臨牀試驗將招募10至20名患者,檢驗EDIT-101療法的安全性、耐受性和有效性。
而據新浪醫藥新聞早前報道,今年10月份,Vertex製藥公司與合作伙伴CRISPR Therapeutics就聯合宣佈,美國食品和藥物管理局(FDA)已經解除了實驗性基因編輯療法CTX001的臨牀擱置,並已接受了該療法用於治療鐮狀細胞病的實驗性新藥申請(IND)。這也將成為美國首例CRISPR基因編輯療法的人體臨牀試驗。


兩家公司最初在今年4月提交了IND,以支持一項計劃中的I/II期臨牀試驗。但在5月時,美FDA擱置了CTX001的IND,理由是需要解決IND中存在的一些問題。此次FDA解除此前的臨牀擱置,引發CRISPR公司股價在盤前交易中上漲近12%。不過,在宣佈解除臨牀擱置的簡短聲明中,兩家公司並沒有具體説明FDA之前究竟存在哪些顧慮,也沒有説明雙方是如何解決這些問題的。
Vertex和CRISPR於2017年12月開始合作開發CTX001,這進一步鞏固了雙方最初於2015年建立的合作伙伴關係。今年8月,雙方獲得了在歐洲開展CTX001針對β地中海貧血和鐮狀細胞病的I/II期臨牀研究的許可,這也是全球首個由製藥公司啓動的CRISPR基因編輯人體臨牀研究。目前,治療β地中海貧血的歐洲I/II期研究正在招募輸血依賴型β地中海貧血患者,雙方表示,將在2018年底開始進行CTX001治療鐮狀細胞病的歐洲I/II期臨牀研究。
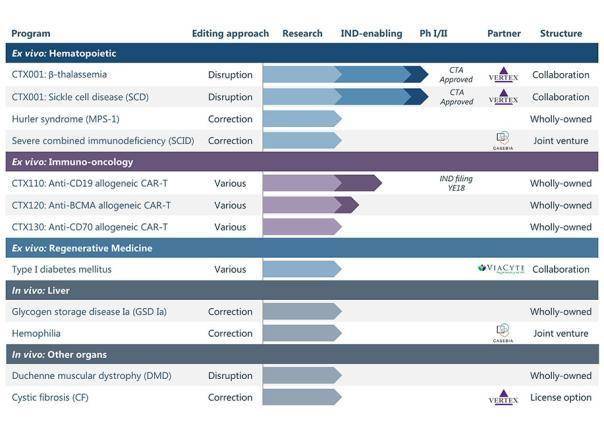
CRISPR公司在研管線(來自CRISPR Therapeutics官網)
β地中海貧血和鐮狀細胞病是由β珠蛋白基因突變引起,該基因編碼紅細胞的載氧成分——血紅蛋白的一個亞基。由於該基因突變導致血紅蛋白丟失或有缺陷,最終引發嚴重的醫療問題。不過,在一些罕見病例中,儘管成人血紅蛋白存在缺陷,但病情卻並不是那麼嚴重,因為這些患者在成年期會繼續產生胎兒血紅蛋白(HbF),這是在胎兒期產生的一種血紅蛋白,也是新生兒的主要血紅蛋白,在出生後逐漸減少,到大約6個月時,HbF幾乎停止產生,開始產生成人血紅蛋白。在成人中,HbF只佔總血紅蛋白的0.5%。與成人血紅蛋白相比,HbF對氧的親和力更大。目前已知,促進HbF的產生可以改善疾病的症狀。
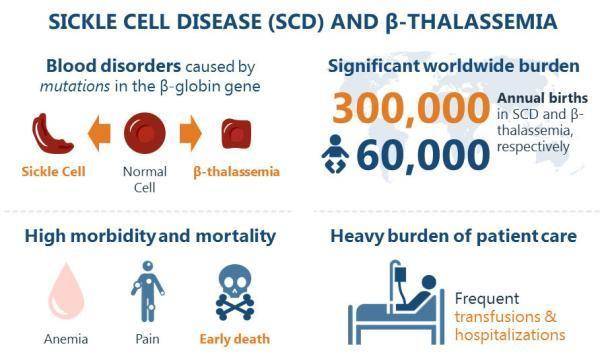
β地中海貧血和鐮狀細胞病(來自CRISPR Therapeutics官網)
Vertex和CRISPR採用的方法旨在模擬HbF的存在。CTX001是一種實驗性體外自體造血幹細胞CRISPR基因編輯療法,其製備和治療步驟包括:從患者中採集造血幹細胞,將CTX001導入,利用基因編輯技術產生一種基因改變,使造血幹細胞產生HbF,之後將這些經過基因編輯的造血幹細胞回輸至患者體內,生成含高水平HbF的紅細胞,從而克服導致這些疾病的血紅蛋白缺陷,緩解β地中海貧血患者的輸血需求以及鐮狀細胞病患者痛苦和致衰性的鐮狀細胞危象。
兩家公司決定啓動CTX001的臨牀試驗是基於2017年12月在美國血液學會(ASH)年會上公佈的臨牀前數據,數據顯示“CTX001具有高的編輯效率,並可引起臨牀相關的HbF水平增加”,這支持了CTX001在2018年進入臨牀試驗。
但CTX001的研究並不是FDA在今年擱置的唯一一個基因編輯研究。3月,FDA對Solid Biosciences公司治療杜氏肌營養不良的基因編輯療法SGT-001給予了擱置,這是一種新型腺相關病毒介導的基因轉移療法。6月,在Solid公司滿意地解決了FDA的所有擔憂之後,SGT-001的臨牀擱置被解除了。
對於CRISPR而言,FDA解禁的決定至關重要,因為CTX001是該公司臨牀推進最快的基因編輯項目。繼續推進該項目有助於緩解圍繞CRISPR基因編輯技術的一些困擾,尤其是對CRISPR-Cas9基因編輯技術可能引起一些危險副作用的普遍擔憂。
文章參考來源:
1、FDA Lifts Clinical Hold; Green-Lights Vertex and CRISPR’s Sickle Cell Gene Therapy Trial
2、OUR PIPELINE
(新華社/周舟、新浪醫藥編譯/newborn)