如何“擇業”?細胞也關心這問題_風聞
中科院之声-中国科学院官方账号-2019-01-21 10:29
我們的身體由200多種不同類型細胞組成。如人從事不同職業一樣,細胞們也有着自己不同的職責。比如,心肌細胞負責心臟的收縮和泵血功能,神經細胞負責神經信號的傳遞,胰島細胞負責分泌胰島素等。
其實,從1個受精卵分裂成200多種不同類型的細胞,細胞們也經歷過一個“擇業”過程,這個過程有一個專有名詞,叫做“細胞命運分化”。
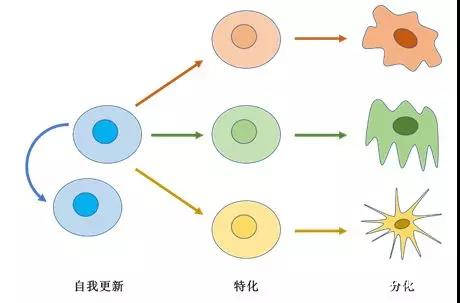
圖1 幹細胞的自我更新、特化及分化
我們先來了解胚胎髮育的幾個過程。我們知道,胚胎髮育是從受精卵開始的。受精卵是1個細胞,其細胞分裂稱為“卵裂”。受精卵第一次卵裂後,就會變成2-細胞,第二次卵裂變成4-細胞……當8-細胞卵裂變成16-32個細胞的時候,就變成了桑葚一樣的“胚胎”。隨着細胞的繼續分裂,胚胎開始着牀,一個新新的小生命就逐漸成長起來。
那麼,在這個過程中,細胞們是在什麼時候可以選擇他們的“職業”呢?他們又是怎麼去“選擇”呢?
研究越深入,被發現細胞的“擇業”的時間越往前推近
人們對哺乳動物胚胎髮育第一次細胞命運決定,也就是細胞“擇業”過程的認知,以小鼠為例,主要經歷了三個階段。
第一階段, 1967年提出“內外模型”,認為在囊胚腔出現後,胚胎細胞有了明確的內外分佈,導致第一次命運決定。
第二階段,1981年提出“極化模型”,認為8-細胞期的緻密化使胚胎外表面形成了緻密的細胞膜,隨着細胞分裂的進行,緻密化細胞膜會在子細胞中出現不同程度的繼承,導致第一次細胞命運分化。
第三階段, 2007年以來,越來越多的證據表明,早在4-細胞期不同卵裂球之間就已經出現分子層面的差異,例如組蛋白修飾水平差異,即第一次細胞命運決定發生在4-細胞時期(圖2)。其中最早發現的一個分子叫CARM1,是一種能夠催化組蛋白H3第26位精氨酸發生甲基化修飾(H3R26me)的酶。
圖2 對小鼠胚胎髮育第一次細胞命運決定的認知發展
誰在影響細胞“擇業”?基因
基因控制着細胞的一切行動,當然也就包括了“擇業”這個過程。一個細胞中有上萬個基因,加起來叫基因組,基因組內的每個基因都有其獨特的功能,開啓不同的基因,就會賦予細胞不同的功能。
“擇業”過程就是細胞選擇開啓哪一些基因的過程。如果細胞最終選擇開啓與心臟功能相關的基因,那麼這個細胞最終會變成心臟細胞。
哺乳動物細胞的基因被組蛋白包裹着,所以組蛋白能夠控制基因的打開或者關閉。H3R26me修飾可以打開基因,而CARM1就是通過建立H3R26me修飾來開啓某些“擇業”基因,從而影響細胞的“擇業”過程。在哺乳動物胚胎髮育早期,重要的“擇業”基因有Nanog等。
新研究:細胞的 “擇業”時間在2-細胞期
隨着高通量測序的發展,科學家們普遍認為,小鼠2-細胞期兩個卵裂球之間已經產生了差異。
中國科學院動物研究所周琪實驗室和李偉實驗室一直從事重編程及早期胚胎髮育的研究,對重編程的機制、細胞全能性的本質以及第一次細胞命運分化的機理充滿着好奇。
他們在一項最新研究中發現,一種名為“LincGET”、在小鼠2-細胞發育所必需的長非編碼RNA,在小鼠2-和4-細胞期各個卵裂球之間是不均等分佈的。
圖3 LincGET在小鼠2-和4-細胞期各個卵裂球之間不均等分佈
隨後,他們通過顯微注射的方法,對“LincGET”這個傢伙開展進一步的研究。
結果表明,過表達LincGET能使子細胞傾向進入胚胎內部,即選擇內細胞團命運。另外,在過表達LincGET的同時干擾CARM1,子細胞不再傾向內細胞團命運,表明LincGET調控內細胞團命運傾向依賴CARM1 (圖4)。
圖4 過表達LincGET能使卵裂球傾向內細胞團命運
科研人員進一步發現,擁有更多LincGET的細胞會在基因組內建立更多的H3R26me修飾,打開更多的基因,尤其是一些與內細胞團命運相關的“擇業”基因,比如轉座序列和Nanog,從而促進內細胞團命運傾向(圖5)。
圖5 LincGET調控命運傾向的機制模型
該研究表明,小鼠早期胚胎髮育的第一次細胞決定命運在2-細胞期,而其中的關鍵分子,就是這個內源逆轉錄病毒相關的長非編碼RNA——“LincGET”。
早期胚胎是最高全能性的代表,對細胞“擇業”過程的探索,將會讓人們對早期胚胎有更深入的認識,也為更高多能性甚至全能性幹細胞的建立提供新的理論參考,驅動幹細胞相關技術的發展,推動幹細胞治療走向臨牀。
來源:中國科學院動物研究所
【關注公眾號中科院之聲(ID:zkyzswx),看科學界的大事兒】



