美國轉基因動物監管的是是非非_風聞
鹰击长空-黑名单专治乌贼、反智、喷子、谣棍和杠精2019-03-25 13:04
基因農業網按:儘管美國的基因工程作物飛速發展,但其基因工程動物卻躊躇不前,究其本質,是美國將基因工程動物納入了食藥監管,是作物藥物來監管的。這也是美國轉基因三文魚姍姍來遲數十年的根本原因。這種政策的後果便是,監管混亂,企業研發資金匱乏,轉基因動物項目逃離美國。對此,加州大學戴維斯分校動物科學專業Alison L. Van Eenennaam博士在自然雜誌合作期刊npj Science of Food上撰文作了論述。基因農業網在此翻譯介紹此文。
(翻譯:panda)通常認為,日常食物中的DNA是安全可食用的,並且,它也是任何生物體來源食材中必然含有的常規成分。當我們將同一物種中任意兩個健康個體的基因組序列進行比較時,往往都能觀察到大量天然發生的DNA變異。正因為存在這些DNA變異,育種家們才有可能從中選擇出具有特定理想性狀的個體,並通過雜交選育等方法得到食源動物和植物的新品種。對於這類新品種,法規機構並不會在其商業化上市之前進行任何安全性評價。而今,由於基因編輯工具的發展,育種家們能夠對動植物進行精準的DNA編輯,向農業育種項目中引入有用的遺傳位點變異。美國農業部(USDA)宣稱,該機構不會對有可能通過常規育種手段實現的基因編輯作物進行額外的上市前監管。
不過,美國食品與藥品管理局(FDA)已經提議,針對所有利用現代分子技術(包括基因編輯技術在內)有目的地改變了基因組的食源動物,依據新型動物藥物法規進行強制性的上市前安全評價。這一提議與美國在生物技術上的政策方針相悖,此前,美國對於生物技術產品的評價指導原則是,法規監管的觸發條件應當是存在不合理的風險,而不是某個生物被某種特定過程或技術改變了的事實。育種家的意圖與產品風險之間並無直接相關性。非常有必要協調統一與食源生物的基因編輯相關的法規要求,以讓植物和動物的育種家們能夠獲得基因編輯這類強大的工具,將有用的可持續性狀引入美國農業育種計劃中,比如抗病性、氣候適應性和其他食品質量相關的屬性。
有一些牛長角,而另一些則沒有(圖1),一種名為Granny Smith的蘋果與普通的紅蘋果Red Delicious從外觀上看差異很大,這些都是基因組DNA序列發生了天然變異的結果。從技術角度看,這些變異被稱為等位基因差異,是由於突變而導致的DNA序列的變化或變異。事實上,**即使是同一物種中的任意兩個健康個體之間,其基因組中都存在數以百萬計的天然DNA變異。**這也就是像“23andMe”這樣公司的基因測試能夠分辨家屬和譜系的理論基礎:與不相干的人羣相比,我們與親緣關係近的人之間共同擁有更多獨特的等位基因或突變位點。

圖1 通過基因編輯得到的無角牛的後代,旁邊是長着角的對照牛。牛有不同的花色、有些長角有些不長角,這都是它們體內基因組中DNA序列發生了天然變異而造成的。這些DNA序列的變異也可以通過基因編輯的方法實現,比如這隻黑色的牛(#1)從她的父親那裏遺傳了編輯過的POLLED DNA序列變體(PC 等位基因),因此,遺傳編碼決定了她天生就不長角。圖片由加州大學伯克利分校的Alison Van Eenennaam提供。
為更好地理解這一點,**“1000公牛基因組計劃”中對2703頭牛的全基因組序列數據進行的一項研究顯示,不同品種的牛之間存在着8650多萬個位點的差異(變異)。**這些變異包括250萬個DNA鹼基對的插入和刪除,以及8400萬單個核苷酸的變異,即,構成DNA的四種核苷(A、C、G、T)由其中的一種改變為另一種。這些突變中有一小部分是由於對重要的農藝學特性具有有益影響而被育種家選擇出來。迄今為止,並未發現這些自然發生的變異會對牛奶或牛肉產品的消費者產生不良影響。**事實上,就基因組DNA序列而言,我們每一餐所吃的食物在基因上都與上一餐的食物不同。**從食品安全的角度來看,基因變異本身並不構成獨特的危害。DNA是所有未經加工的食物都含有的一種天然成分,而這種天然成分每個食源物種(包括植物和動物)的每個個體中都是各不相同的。
個體間DNA的變異(“基因型”)導致了外觀可見的差異,也就是我們常説的“表現型”。良種選育的每一個候選個體(可能被選擇用於育種的個體)的可觀察特徵,都是由其基因型與環境的相互作用而共同產生的,在常規的表型評估中被記錄下來。而所謂的“off-type”則是偏離了預期特徵的個體,被識別出來後不再繼續用於育種目的。育種家只選擇最有活力、最有生產潛力和最健康的個體作為下一代的親本。用一位動物遺傳學家的話説,“千百年來,動物育種家已經進行了大規模的基於表型選擇的誘變篩選活動。”
對於通過傳統育種方法得到的動植物品種,雖然會在生產力、繁殖效率、對疾病的反應和質量特性等變化方面進行例行評估,但不會對其在分子水平上是否存在非預期效應進行例行評估。在傳統育種得到的新品種商業化之前,監管機構並不會對其進行健康和環境安全的評估。選擇出產量更高、適應性更強的動植物品種是提高產量、同時降低單位面積耕地上糧食生產環境足跡的一個非常重要的組成部分。自1960年以來,全球牲畜的生產力提高了20-30%,這在很大程度上是人工選擇而帶來的遺傳改良結果。
自上世紀30年代以來,傳統的植物育種項目一直在利用甲烷磺酸乙酯或快中子輻照等致突變化學物質,誘導整個基因組中隨機位點上的DNA序列突變或改變,試圖產生新的性狀變異。這種做法增加了可用於育種項目的遺傳變異。**在世界各地的植物育種項目中,廣泛應用的誘導突變技術已經在數以百計的作物類型種產生了數千個作物新品種。突變品種數據庫(https://mvd.iaea.org/)中收錄了來自70多個國家的214個不同植物品種的3200多個突變品種。**對於這些品種,並沒有獨特的監管指南或跟蹤要求,而且似乎沒有任何記錄表明這些突變品種由於意外或非預期的不利事件而退出市場。
大多數農作物天然地含有過敏原、毒素或其他抗營養物質。在2004年的報告中,美國國家研究委員會(the National Research Council)指出了一些與傳統植物育種有關的罕見安全問題,如獼猴桃中的過敏原、土豆中的高水平的茄氨酸。圖2所示為不同個體之間存在的生物變異的大小,以及由於測序平台、錯誤和基於文獻估計的生物信息學分析時可能發生的技術變異的來源。
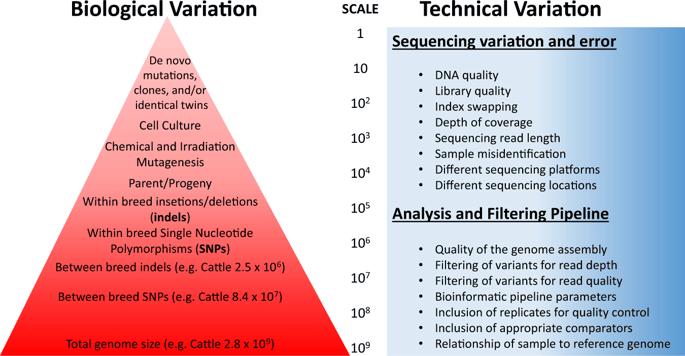
圖2 不同個體之間存在的生物變異大小的可視化表示,以及由於測序平台、錯誤和生物信息學分析中存在差異而可能發生的技術變異來源。由於植物育種家經常在環境釋放前使用自交的方法來培育品種,同一個植物品種的個體之間的變異往往比同一個雜交牛品種的個體之間的變異要小得多。序列變異的量化和檢測對測序結果和生物信息學分析中的差異非常敏感。
基因編輯是一種可以將有用的基因變異引入育種項目的技術。它涉及到使專用的酶(位點特異性核酸酶,如CRISPR-Cas9)來切割特定序列的DNA,從而在目標位置引入DNA鏈的斷裂。利用細胞內天然存在的可用於修復這種斷裂的DNA修復機制,可以引入核苷酸缺失或插入,或是將一個核苷酸替換成另一個核苷酸之類的遺傳變異。**基因編輯為引入有針對性的基因變異開闢了新的機會,並培育出那些不需要的性狀被精確剔除或消除、而需要的性狀被精確引入基因組的品種和品系。**這種改變產生的表型將完全取決於所編輯的目標基因。例如,植物育種家已經使用這些工具來提高可持續性特徵,包括抗病性、抗旱性和耐鹽性,以及產品的質量性狀。
2018年3月,美國農業部(USDA)宣佈,只要不具有植物有害生物的特性,或者不是利用植物有害生物開發的作物,在投入商業生產之前,該機構無意就這類有可能通過傳統育種得到的基因編輯植物對人類健康和環境安全進行評估。根據這項決議,只要是可能通過傳統雜交而產生的基因缺失、單鹼基對替換和來自近緣植物的核苷酸序列的插入(轉移)都不在美國農業部的監管範圍之內。
2017年初,美國食品和藥物管理局(FDA)發佈了最新的《行業指南第187號》草案,題為《對有目的改變基因組DNA動物的監管》。該指南旨在規範所有使用現代分子技術(包括用於開發獸藥的基因編輯技術)有目的地改變基因組的食源動物的管理。自2009年以來,FDA一直採用這種方法來監管轉基因改良動物。遺憾的是,由於這種嚴苛的監管方法,沒有任何基於重組DNA(rDNA)的技術在食源動物育種項目中得以應用。截至2019年3月,美國市場上沒有出現任何一例利用rDNA技術生產的具有改良基因型的動物來源食品。
要了解目前這種尷尬的情況是如何產生的,需要一些背景知識。記錄利用基因工程技術得到的轉基因食源動物的第一篇論文發表於1985年。**1986年,白宮科技政策辦公室(OSTP)發佈了“生物技術協調監管框架”,文件中稱,該框架“試圖將需要一定程度聯邦審查的生物體與那些不需要審查的區分開”。這一理念遵循了傳統的監管方式。**例如,在農業領域,植物、動物和微生物新品種的引進長期以來一直是慣例,只有一些非本地的或具有致病性的植物、動物和微生物才需要監管部門的批准。該文件進一步闡明,監管審查應限於有意形成包含來自不同屬的遺傳物質的“屬間組合生物體”,即後來被稱為“轉基因”的生物體。
在2009年FDA發佈的《行業指南第187號》中名為“對包含可遺傳重組DNA構造的遺傳改良動物的監管法規”一文中,FDA宣佈其有意依據“聯邦食品,藥品和化妝品法案(FD&C法案)”中有關動物新藥的相關規定,對所有含有可遺傳重組DNA的遺傳改良動物進行監管,包括含有遺傳改良成分動物的整個家族後代。在上述法案中,動物新藥被定義為“一種旨在影響……動物身體結構或任何功能的物品(食品除外)”。FDA澄清説,他們認為轉基因動物體內的重組DNA構造就是藥物,而不是轉基因動物本身。雖然FDA的監管評估看起來是基於產品(轉基因動物)的屬性,但實際上,用於產生基因變化的方法(即rDNA與其他育種方法的差別)才是這類嚴格監管的觸發器。換句話説,FDA的監管是基於生產轉基因動物的過程,而不是基於這種動物或其來源食品(牛奶、肉類或雞蛋)的特定特徵。
這種做法已經背離了OSTP在1992年的政策聲明中所闡述的方法,1992年的聲明中指出:“在法規所限定的自由裁量權範圍內實施監督應以引入物所造成的危險為基礎,而不應以某一生物體已被某一特定程序或技術所改變這一事實為依據”。此外,該聲明還澄清説,“只有在引入物所造成的風險是不合理的情況下,即通過額外監督所減少的風險的價值超出了由此產生的成本時,才會行使監督權。”
**為獲得監管機構批准而付出的高昂成本和無法預期的時間,限制了公共部門科學家和小型公司開發轉基因動物改良品種的積極性。**儘管在過去近35年中對多種轉基因作物品種進行了研究和批准,目前仍無一例轉基因食源動物成功進入美國消費者市場。轉基因三文魚是唯一依照《食品與藥品法》中有關動物新藥條款獲得食品批准的轉基因動物。這種名為AquAdvantage的轉基因三文魚多年來一直遊走在監管框架邊緣,導致其累計研發和監管成本高達數千萬美元。儘管其飼料轉化率更高,也能夠更有效地地利用膳食中的蛋白質,**在2015年11月終於獲得FDA的法規批准時,距離最初1989年科學研究人員在加拿大首次得到這個品種祖先已經過去了四分之一個世紀,現在,該公司正儘量避免在美國進口和銷售其產品。**這是由於美國政府在2017財年預算中的一項由Alaskan Senator Lisa Murkowski提出的條款,指示FDA禁止出售這種轉基因的三文魚,直到開發出一種程序來告知消費者,他們所購買的三文魚正是遺傳改良或生物工程產品。
2017年FDA就基因編輯動物的監管起草了一份指南,建議將所有通過基因編輯而引入的動物基因組改變同樣作為動物新藥進行監管,進一步將該類產品推入深淵。這包括許多與常規育種中可能發生的類似核苷酸的插入、取代或刪除。轉基因重組DNA結構的存在不再是觸發FDA對產品上市前強制性監管的驅動力,任何“有目的改變的基因組DNA”在動物體內的存在成為了引發監管的觸發器。從公共安全的角度來看,這沒有任何意義,因為**有目的的更改與產品本身是否具有風險沒有任何關係。**如果要求經過基因編輯的動物遵守與轉基因動物相同的監管標準,那麼有能力負擔這種監管成本的公司可能會勝出。
缺失、突變,以及天然發生的一個等位基因轉換成同一物種(cisgenic)中另一個等位基因,這些都可能通過傳統育種手段實現,對這類變化實施強制性上市前監管與OSTP政策、美國國家科學院、工程院和醫學院在2016報告中的建議背道而馳,後者推薦“由產品而非過程”監管觸發的方法,即USDA對基因編輯植物的監管方法。FDA的做法同樣也與世界上許多國家的其他管理機構所作的決定不一致,這對全球貿易產生了影響。
最後的最後,**有目的改變基因組的食源動物是用來產生食物的,如果他們所產生的食物通過口服途徑被食用時並不具有生物學活性,對這些有意進行基因組改變的動物當成藥物來監管就毫無意義。**將一種DNA序列的變體當成一種“藥物”來監管,可能會讓消費者感到迷惑和恐慌,他們可能會由此想當然地認為自己所吃的食物中含有生物活性物質。DNA的改變不是藥物,而是任何生物體獨特的遺傳密碼特徵的一部分。DNA通過其在細胞內的自然功能,控制生物體如何生長,並表現出其獨特的形態和功能。表型最終將由生物體的基因組DNA序列和其所在環境的相互作用來決定。我們不對食物中數以百萬計的天然基因變異進行監管,因為通常來説DNA是安全的,無論序列如何,這類物質都是我們每頓飯中從任意有機體中獲得的食物常規成分。
這件事為什麼很重要?
鑑於目前美國尚無一例轉基因食源動物產品上市,動物育種家或許是最清楚監管僵局對潛在有價值的育種技術的應用造成的可怕影響的羣體。這將表明FDA的監管方法無法滿足該應用目的,因為**似乎沒有一個可行的路徑讓安全產品進入市場。**此外,以往對基因間重組DNA作為一種新型動物藥物而關注於其潛在效應的做法並不適用於不產生任何重組DNA的基因編輯技術。轉基因動物的例子包括抗病動物、具有改進的質量性狀和/或減少常見過敏原的產品,以及減少環境足跡影響的生產動物。**獲得監管部門批准的高昂成本,限制了公共部門科學家和小型企業開發轉基因動物改良品種的積極性。**該技術在動物育種項目中應用的延遲或禁止,與放棄基因改良方面的實際機會成本有關。
基因編輯的出現為我們重新思考現代生物技術產品的監管方法提供了一個機會,許多作者認為,監管審查的觸發因素應該是新產品的潛在危害/風險(如果有的話)與由此帶來的好處之間的利弊權衡。研究人員已經在一系列有益的基因編輯食品動物應用項目中作出了努力,用以解決重要的人畜共患病和增加動物福利,如去角和閹割。公共資金對食用動物基因組測序項目的重大投資已帶來了深入的理解,而基因編輯在將這些知識轉化為有用的實踐方面具有巨大的潛力。這類技術在食源動物中最知名的應用包括抗病動物,如帶有刪除基因的豬,可抵禦毀滅性的豬繁殖與呼吸綜合徵(PRRS)病毒,以及攜帶一種自然產生的POLLED等位基因的牛,它們不長角,因此倖免於痛苦的物理去角手術。這兩個例子都有利於動物的健康和福利,而這類性狀的改善往往會得到公眾的好評。
在這兩個例子中,都不涉及到遺傳物質的轉基因DNA重組,然而在2017年草案FDA的指導下,這兩個例子在商業化釋放之前均須遵循FD&C法案中有關新型動物藥物的相關要求,受到強制性的監管審查。在其中的一個例子中,DNA的缺失(基因刪除)是一種可通過動物繁殖傳給所有後代的“藥物”。在另一個例子中,所謂“藥物”是源自於另一個品種中自然產生的一段212個鹼基對的DNA序列,我們經常從那種牛來源的食物中吃下這種“藥物”,而它卻不需要受到額外監管。同樣一段序列,在經過基因編輯操作後被引入另一個奶牛的基因組中(這種操作完全可能通過自然變異產生),卻需要受到嚴格的監管(圖1)。監管程度應與潛在風險相匹配,意味着不具有風險或是低風險的產品應該受到最少的監管,而那些構成高風險的產品則應該經受全面的監管審查。此外,監管應該是公平的,這意味着無論生產過程如何,具有相同風險水平的產品都應該受到同等的審查。
Genus PLC是一家大型育種公司,已經宣佈將耐受PRRS的基因刪除豬將由FDA監管審查。鑑於這種抗病性狀對全球養豬業的重要性,以及像Genus這樣的大公司所擁有的資源,這或許是一個合理的決定。然而,學術研究人員和小公司所面臨的情況則完全不同。FDA指南草案建議需要對多個世代進行基因型和表型持久性研究,在可行的情況下,包括至少兩代(最好更多)的遺傳數據,並建議來自非連續世代(例如F1和F3)的至少兩個採樣點。此外,指南草案建議,所有過剩的調查動物及其生物製品應通過焚燒、掩埋或堆肥處理。對大型食源動物(如牛)的多代研究需要數年時間,而且超出了大多數學術實驗室的能力範圍,尤其是如果研究動物必須在試驗結束後被焚燒而不是用於食品銷售的話。雖然這些要求在表達藥物蛋白(即真正的藥物)的改良動物中可能具有一定的意義,但在食品中發生的DNA缺失或天然存在的等位基因的背景下,這類做法幾乎沒有任何意義。有哪些理由能夠認為,一小段DNA的缺失會是一種藥物呢?
指南草案中闡述的另一項要求是“對有目的更改、任何非預期更改(例如偏離目標的更改、意外插入、替換或刪除)的位置進行全面描述”,並進一步建議研究人員對是否存在編碼或調控區域的意外中斷進行評估。考慮到數以百萬計的任意兩個個體之間存在的自然的基因變異,以及觀察到的減數分裂中發生的意外插入、替換或刪除,目前尚不清楚以何種方式滿足這一要求,同時區分非目的的改變和自發的插入、替換、刪除以及其他非預期的自然產生的改變,如圖2所示。全基因組測序數據的分析和註釋在所研究羣體中的個體之間也可能不一致,使得從監管的角度進行標準化管理變得十分困難。與此同時,用傳統育種方法生產的動物則不要求在分子水平上對非預期效應進行例行評估。
可預期,如此沉重的監管負擔與高風險產品有關。然而,**實際上很難提出一個與同樣可以通過傳統育種技術得到的動物有關的獨特危害(傷害),更不用説風險(傷害的可能性)了,對其進行監管僅僅是因為它們攜帶有目的改變的基因組是通過基因編輯技術引入的。**該指導草案將食品安全風險分為兩大類,第一類是要求檢查食品消費“主體所表達的產品”是否有任何直接毒性,包括過敏性。雖然這種風險可能與轉基因的表達產物有關,但這對那些同樣能夠通過傳統育種技術培育出來的動物來説,這種評估仍然沒有什麼意義。從監管的角度來看,對通過傳統育種技術培育的動物不要求進行這類研究,令這一要求顯得格外不公平,特別是考慮到傳統動物育種從歷史上一直具有較低的食品安全風險。
第二類所謂的食品安全風險要求進行研究,以確定與動物生理學上是否存在任何具有生物學相關的變化而產生的間接毒性,並確定有意改變基因組的動物的可食用部位的組成是否不同於傳統產品。如此高水平的監管審查要求可能是為了緩解公眾的恐懼或安撫那些持反對意見者。然而,對那些有可能通過使用傳統育種而得到的產品而言,不成比例的監管負擔可能會阻止基因編輯技術在美國食源動物育種計劃中的應用,並導致純粹出於躲避上市前監管的障礙而最終選擇低效的育種流程來引入有用的遺傳變異。
應該強調的是,現有的育種計劃已經對候選品種進行了徹底的表型選擇,以尋找可能存在於重要選擇目標之間那些非期望或負相關的表型。例如,一家大型育種公司從表現型上對肉雞候選品種進行56個性狀的評估,其中超過50%的性狀是衡量健康的指標。這些特徵包括骨骼和腿部畸形、心臟和肺功能的多種生理指標,以及特定的死亡原因。就像植物育種一樣,“off-type”不會進行繼續作為親本保留在育種產線上。在繁殖金字塔的譜系層次上,有活力且健康個體的選擇壓力非常大,在這個金字塔中,每一個成功被選出的候選個體都有可能產生數百萬後代。
最後,FDA提出的監管方法與動物育種計劃在結構上不相匹配。許多品系和/或品種,以及由此產生的多個“祖先”動物可能需要進行編輯以具備完全相同的特徵。例如,在肉雞行業中,大多數初級育種家在多個不同的育種品系間選擇雜交,以滿足不同行業的需求。就乳製品行業而言,需要向有角的品種(如荷斯坦和澤西)中引入POLLED的無角等位基因。並且,為了防止基因近親繁殖和多樣性的喪失,常常需要向許多優良的人工授精公牛品種中引入同樣的改變。
FDA的指導草案建議,每一項新型動物藥物的申請通常只涵蓋來自單一變更事件的動物。如果每一個編輯動物在上市前都需要經歷一個多世代的強制性監管評估,那麼,所提議的美國對基因編輯動物的監管原則就與遺傳改良計劃的現實之間產生根本的脱節,遺傳改良計劃中未來的父母本都會從後一代中選出,因為那些動物在遺傳表現上往往會優於他們的父母。
**基因編輯食源動物的應用正轉移到那些對基因編輯動物具有更寬容態度、有着基於新產品特性觸發監管機制的國家,這種現象並非偶然。**阿根廷是第一個公佈其對基因編輯生物體的監管方法細則的國家。他們計劃以相同的方式來監管植物和動物,監管的觸發因素將是植物或動物產品是否含有“新的遺傳物質組合(即屬間轉基因)”。圖3中所示為那些根據阿根廷法律會被視為“GMO”的情況和那些無論育種過程中是否使用現代生物技術或重組DNA技術均不會觸發額外的監管的情況。加拿大是唯一允許轉基因動物商業化銷售的國家,2016年批准AquAdvantage三文魚上市,加拿大有一個由產品的新穎性觸發、基於產品的監管體系,無論獲得植物或動物終產品過程中使用了何種育種技術。
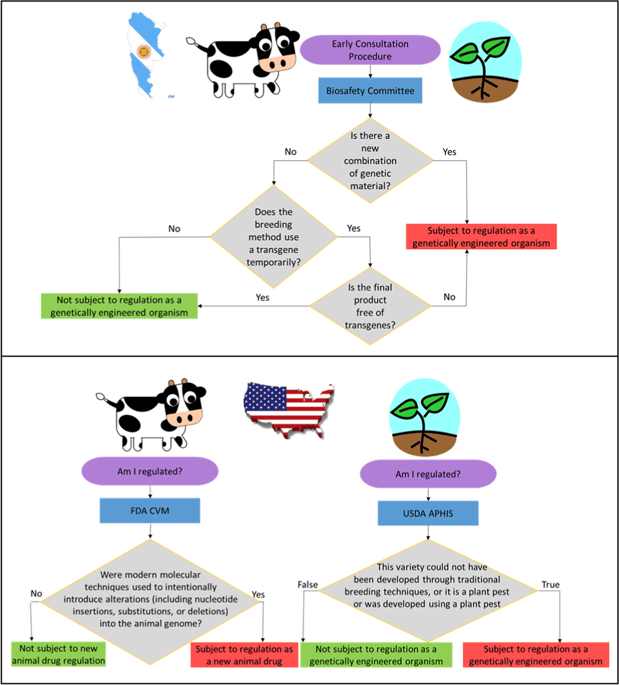
圖3 (a)阿根廷(由Whelan和Lema修改)和(b)美國擬議的基因組編輯在食源動物品種中應用的法規流程對比圖。改編自Van Eenennaam (2018)
基因編輯公司Recombinetics宣佈與加拿大的牛類遺傳學技術供應商Semex合作,利用基因編輯技術,將自然產生的POLLED 等位基因導入他們的優良奶牛品種的遺傳背景中。2018年10月,巴西國家技術生物安全委員會(CTNBio)得出結論,根據他們的監管模式,經編輯後攜帶PC POLLED 等位基因的公牛的精液不會被視為“轉基因生物”。同樣,阿根廷國家農業生物技術諮詢委員會(CONABIA)評估了擬議的基因編輯動物,並判定這些不包含任何外來DNA或新的遺傳物質組合的動物不受轉基因法規的約束。這些動物包括使用基因編輯改良的魚(羅非魚)、牛和馬。在缺乏監管框架一致性的情況下,一些國家的育種家將有能力在農業育種計劃中使用基因編輯技術,而其他國家的育種者則沒有能力,這將導致育種在對這類高效育種工具的可獲得性上產生差距,並最終可能導致貿易中斷。
FDA題為“對有目的改變基因組DNA動物的監管”的《行業指南第187號》草案並不能滿足既定目標的使用,因為它涉及到那些能夠通過傳統育種技術得到的食源動物。我們拒絕接受“有目的的基因組DNA改變應當被視為食源動物獸藥進行監管”的想法,並認為草案中提議的方法會阻止公共部門研究人員和小公司對這類遺傳學方法的使用,比如通過基因編輯解決美國的人畜共患疾病和動物福利問題。我們進一步支持多位科學家在2019年動植物基因組會議上的動議(www.gopetition.com/petitions/harmonize-us-gene-edited-food-regulations.html),即美國監管體系應該協調一致,僅僅基於有目的的基因組改變的事實(無論育種過程中是否使用現代生物技術或重組DNA技術),使那些完全有可能通過傳統育種技術開發得到的基因編輯改良動植物無需受到額外的上市前監管要求。
原始文獻:
www.nature.com/articles/s41538-019-0035-y