我們身體裏沒有一個細胞不受它的影響!3分鐘瞭解2019諾貝爾生理或醫學獎_風聞
德不孤-新闻搬运工2019-10-07 20:13
文匯報 2019-10-7
北京時間10月7日下午5點30分,2019年諾貝爾生理學或醫學獎公佈,三位獲獎者分別是:哈佛醫學院達納-法伯癌症研究所的威廉·凱林( William G. Kaelin, Jr.),牛津大學和弗朗西斯·克里克研究所的彼得·拉特克利夫( Peter J. Ratcliffe) ,以及美國約翰霍普金斯大學醫學院的格雷格·塞門扎(Gregg L. Semenza)。
人和動物需要氧氣才能將食物轉化為能量。氧氣的重要性已是毋庸置疑,但細胞如何調節自身以適應氧氣水平的變化,這一問題一直懸而未決。三位科學家的研究回答了這一難題。他們從分子水平找到了對應不同氧含量的基因調節機制。
今年的諾貝爾獎獲得者的開創性發現揭示了生命中最重要的適應過程之一的機制。他們為我們瞭解氧水平如何影響細胞代謝和生理功能奠定了基礎。他們的發現也為抗擊貧血,癌症和許多其他疾病的新策略鋪平了道路。
一個優雅的開關
氧與氧的化合物,約佔地球大氣的五分之一。氧氣是動物生命所必需的,1931年諾貝爾獎獲得者在生理學或醫學上,揭示了這種轉化是一種酶的過程。
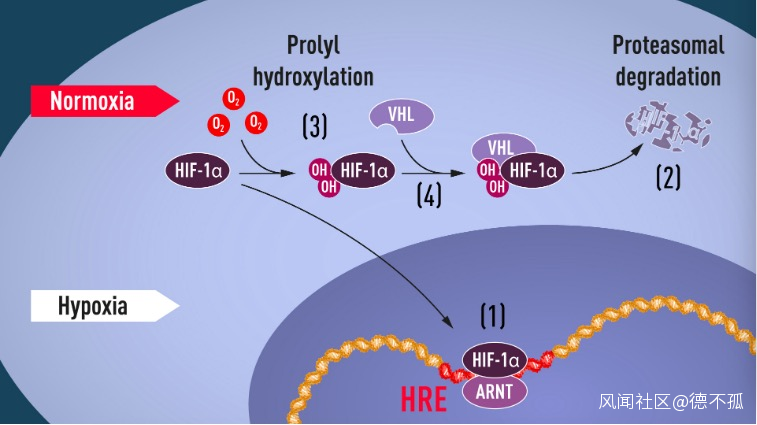
當氧氣缺乏時,腎臟分泌EPO刺激骨髓生成新的紅細胞。比如當我們在高海拔地區活動時,由於缺氧,人體的新陳代謝發生變化,開始生長出新的血管,製造新的紅細胞。這幾位科學家們做的正是找出這種身體反應背後的基因表達。他們發現這個反應的“開關”是一種蛋白質,叫做缺氧誘導因子 (Hypoxia-inducible factors, HIF),但其功能遠不止開關那麼簡單。
20世紀90年代初,塞門扎和拉特克利夫開始研究缺氧如何引起EPO的產生。他們發現了一個不僅會隨着氧濃度的改變發生相應的改變,還可以控制EPO 的表達水平的轉錄增強因子HIF,如果將其DNA 片段插入某基因旁,那麼在低氧的環境下,則該基因會被低氧條件誘導表達。也就是説,這段DNA序列其實起到了低氧環境下的調控作用。後續研究也表明,一旦這段序列出現突變,生物體就對低氧環境無所適從。
隨後,塞門扎和拉特克利夫又擴展了低氧誘導表達基因的種類。他們發現,除了EPO,HIF-1在哺乳動物細胞內可以結合並激活涉及代謝調節、血管新生、胚胎髮育、免疫和腫瘤等過程的眾多其他基因。
後續研究發現,這段序列在細胞內調控了一種叫做HIF-1的蛋白質,HIF-1能夠結合並激活許多哺乳動物細胞內的特定基因。有趣的是,這些基因都不負責生產促紅細胞生成素。這些結果表明,缺氧引起的紅細胞生成,背後有着更為複雜的原因。而在人們後續闡明的調控通路中,HIF-1扮演了核心的地位,調控了包括能促進血管生成的諸多關鍵基因。
威廉在研究一種叫做希佩爾-林道綜合徵(VHL disease)的癌症綜合徵時發現,在典型的VHL腫瘤裏,經常會有異常形成的新生血管。此外,他也發現了較多的VEGF與促紅細胞生成素。因此他自然而然地想到,缺氧通路是否在這種疾病裏有着某種作用。
研究的廣泛意義
許多研究小組的工作已經證明了HIF通路的健壯性,以及它在調節氧影響基因表達中的中心作用。塞門扎、拉特克利夫和凱林一直是這項工作的中心人物,他們最初的探路者。他們已經參與了進一步闡明HIF途徑的分子生物學研究,增加了我們對低氧應答在健康和疾病中所起的生理作用的理解。
調節HIF-1α穩定性的脯氨酸羥化酶的發現使人們能夠尋找羥化酶抑制劑來提高HIF水平;這為藥理學發現開闢了新的途徑。事實上,通過抑制PHD酶來增加HIF功能的一些潛在藥物已經在臨牀試驗中取得了很大進展,最近的一系列出版物證明了它們在治療貧血方面的臨牀療效。
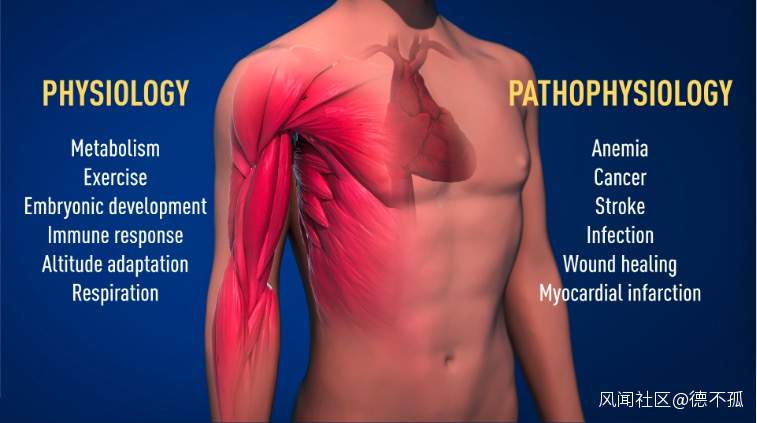
抑制HIF通路的未來應用也在視野中,這些被設想為減緩一些癌症進展的手段。
通過藥物增強HIF的功能可能有助於治療許多疾病,如免疫功能,軟骨形成和傷口癒合;相反,抑制HIF功能也可以有很多應用:比如許多癌症以及一些心血管疾病,包括中風、心臟病發作和肺動脈高壓。
綜上所述,揭示生物氧氣感知通路,不僅在基礎科學上有其價值,還有望帶來創新療法。這三名科學家的發現在基礎研究和臨牀應用上,都有着重要價值。