生物科技的下個10年:RNA藥物“王者歸來”_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2019-12-23 10:27
**撰文 |**謝雨禮 博士
編輯 | 同寫意 @Jingyu
來源:同寫意
引言
今年9月份的藥品集採中,降脂藥物阿託伐他汀競爭激烈。未中標藥企就地解散銷售隊伍的消息震動業界。
試想,如果有一天,病人只需要每半年打一針,既不需要吃藥,也不需要節食,就能維持正常的體重和血脂。到那一天,現有的降脂藥物可能被淘汰,那又將是怎樣一番景象。隨着RNA藥物Inclisiran三期臨牀的成功,這一天也許就在眼前了。
Inclisiran是由Alnylam開發後轉讓給The Medicines Company的一款靶向PCSK9的小干擾核酸(siRNA)藥物。PCSK9是人體變異自證的降脂靶點,已有兩款單抗藥物批准上市。單抗藥物主要是通過抑制PCSK9蛋白與肝臟中低密度脂蛋白受體(LDLR)的結合發揮降脂作用,需要每月注射;而Inclisiran直接降解PCSK9的信使RNA,抑制PCSK9蛋白合成,只需每半年注射一次。多個臨牀試驗表明,Inclisiran降脂效果優於單抗,且副作用與安慰劑相當**[1****]**。其療效和安全性如果在大規模人羣中得到驗證,極有可能帶來降脂的革命性療法,甚至實現在健康人羣中模擬PCSK9變異,預防與高血脂相關的慢性疾病。正是如此,諾華先下手為強,已於11月25日宣佈97億美元併購The Medicines Company,將Inclisiran納入囊中。
早在2018年8月,FDA就批准了第一個siRNA藥物Patisiran,用於治療神經退行性疾病hATTR變性;2019年11月20日,又批准了用於治療急性肝卟啉症(AHP)的第二個siRNA藥物Givosiran。他們都是由Alnylam的siRNA技術平台研發成功的罕見病藥物。使用脂質納米顆粒(LNP)技術遞送的Patisiran副作用比較明顯,注射前需要使用抗組胺藥物和激素預防過敏反應。Givosiran和Inclisiran使用的則是更加安全的GalNAc偶聯技術。
Inclisiran如果最終獲批,標誌着siRNA藥物進入對安全性要求高,但市場更大的慢病領域。命運多舛的RNA藥物將真正迎來“王者歸來”的高光時刻。
RNA藥物的發展歷程
RNA很長一段時間被認為只是在基因與蛋白質之間傳遞信息的分子。其實在生命起源之初,RNA才是唯一的生命分子,既可儲存信息,也具有酶的功能。億萬年的進化和演變,才產生了DNA和蛋白分子**[2****]**。毫不奇怪,RNA除了充當蛋白合成的信使(mRNA)外,還具有非常重要的調控功能,這樣的非轉錄RNA包括miRNA, siRNA,lncRNA,piwiRNA等等。其中,僅miRNA分子就有400多種,調控至少三分之一的人類基因。自1953年Watson-Crick發現DNA雙螺旋結構,人們就產生了根據核酸包含的遺傳信息和鹼基配對規律實現“程序化”製藥的夢想。
在追求這個夢想過程中,RNA藥物起步最早,種類包括反義核酸(ASO)、小干擾核酸(siRNA)、適配體(aptamer)、核內小核酸(snRNA)、信使RNA(mRNA)等5種。最近有人將基因編輯工具比如GRISPR-Cas9包含的RNA分子也歸於RNA藥物之列。這樣,RNA藥物就可以全面覆蓋DNA,RNA和蛋白質三大靶點類型。U1snRNA和基因編輯處於非常早期,下面以ASO、siRNA、aptamer和mRNA為重點,簡單介紹RNA藥物的發展歷程。
1)反義核酸(ASO)藥物
1978年,哈佛大學科學家Zamecnik等人使用配對的核酸分子抑制RNA病毒的複製,第一次提出了反義核酸(ASO)的概念**[3****]**。
當時的想法比較簡單,就是通過鹼基配對,封堵DNA或者RNA的翻譯和轉錄。超出人們預期的是,ASO還可以招募RNase酶降解mRNA,干擾pre-mRNA的剪接,甚至還可以間接增強某些蛋白的表達。這些功能都可以被利用,設計針對各種靶點的ASO藥物,比如最近獲批的藥物Nusinersen和Eteplirsen就是通過調控RNA剪接發揮作用。
目前已有7款ASO藥物被批准上市,兩款由Sarepta開發外,其餘都來自ASO藥物的領先公司Ionis(表1)。
表1.上市的ASO藥物
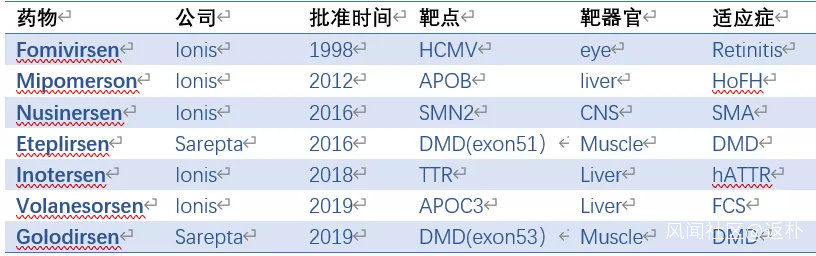
反義核酸藥物一路走來,道路並不平坦。1998年,Ionis的第一款藥物Fomivirsen批准上市,用於治療艾滋病人的眼部CMV病毒感染。因為抗HIV藥物的快速發展,CMV感染的艾滋病人急劇減少,Fomivirsen最終退出市場。時隔14年,Ionis推出治療家族性高血脂的APOB反義核酸藥物Mipomersen。可惜,由於肝毒性和流感症狀,先是被歐洲拒絕批准,後來美國市場也被小分子藥物Lomitapide取代,商業上又是一敗塗地。2016年,Sarepta開發的Eteplirsen是在DMD患者苦求下獲批的,被認為療效證據不足,許多商業保險機構拒絕報銷,市場前景可想而知。
好在Ionis屢敗屢戰,最近相繼推出治療SMA的藥物Nusinersen, hATTR變性藥物Inotersen,以及治療家族性高乳糜微粒血癥(FAC)的藥物Volanesorsen。其中至少Nusinersen曾經因為療效太好提前中止臨牀試驗,Inotersen則面臨副作用更小的siRNA藥物Patisiran的強勁競爭。靶向APOC3的藥物Volanesorsen與諾華合作,在心血管領域已進入二期臨牀,能否與Inclisiran匹敵,讓人期待。就在昨天,FDA又批准了Sarepta的第二款DMD藥物Golodirsen上市。
當前,全球有超過50個ASO藥物處於臨牀研究階段,治療領域覆蓋中樞神經系統,心血管,抗感染和腫瘤等。曾經被逼改名的Ionis註定成為未來的巨星,目前管線中擁有5個三期,16個二期,5個一期產品。其中一款治療糖尿病的二期產品GCGR反義核酸的中國權益轉讓給了國內小核酸領軍企業瑞博生物。
2)小干擾核酸(siRNA)藥物
RNA藥物真正引起製藥界的重視,是因為諾獎成果RNAi的發現。1990年,美國亞利桑那大學的植物學家Jorgensen希望培育五顏六色的牽牛花,於是嘗試將深紫色的色素基因插入到植物當中。讓人意想不到的是,他只得到了不含色素的白花,檢查發現色素基因的表達大大降低了。這個現象讓人百思不得其解,因此Jorgensen等人提出了一個所謂基因“共抑制”概念**[4****]**。
後來,Ambrose和Kemphues等科學家發現RNA可以抑制基因的表達,即所謂的RNA干擾現象(RNAi)。1998年AndrewFire和CraigMello 揭示了RNAi的工作機制**[5****]**。
RNAi現象其實是一種降解mRNA的後轉錄基因沉默(PTGS)。雙鏈RNA在胞質中可以被核酸內切酶Dicer切割成多個小片段(21~23 bp,即siRNA)。siRNA再與體內解旋酶等結合形成沉默複合物(RNA-induced silencing complex,RISC)。RISC誘導降解與siRNA中反義鏈互補結合的mRNA。RNAi現象高度保守,陸續發現於多種真核生物中。之前提到了植物中的基因共抑制也是因為人工轉錄基因過程中意外產生的siRNA所介導的干擾現象。 RNAi的特異,高效和簡便性使得siRNA迅速成為最流行的基因調控工具。2001年,RNAi技術被《科學》雜誌評為2001年的十大科學進展之一。2002年斯坦福大學的Mark Kay在Nature上發文證明人工合成的siRNA可以在小鼠上有效敲低目標基因的表達,這讓製藥界意識到siRNA在臨牀應用的可能性。2003年,RNAi被美國財富雜誌稱為價值億萬美金的生物科技突破。這一年,正值DNA雙螺旋結構發現50週年,還發生了一件里程碑事件:人類基因組項目宣佈完成。後基因組時代和RNAi技術的突破,讓人們覺得“程序化”製藥的夢想即將實現。
先前成立的,擁有大量專利的siRNA生物科技公司Alnylam和Sirna迅速成為跨國公司眼裏的香餑餑。siRNA藥物的第一次繁榮在2006年達到高潮:當年的諾貝爾生理或醫學獎頒給了發現RNAi的Fire和Mello;默沙東用11億美金收購了Sirna;武田,羅氏和諾華紛紛與Alnylam簽署鉅額合同。
可惜好景不長,在隨後的幾年內siRNA藥物由於遞送和免疫反應的問題屢遭挫折。2010年,先是諾華和羅氏中止與Alnylam的合作,隨後輝瑞和雅培中止了自己的RNA項目。默沙東堅持多年,於2014年將Sirna以低於原收購價20%的價格賣給了Alnylam。這些動作被媒體放大後,業界普遍認為siRNA只能作為研究工具,成藥的希望渺茫。
具有諷刺意味的是,大公司放棄這些資產時,正是siRNA技術取得突破並重新崛起的時候。比如2010年加州理工大學的一項研究證明siRNA人體有效,並能夠進入腫瘤組織**[7****]。2013年,Alnylam公司在新英格蘭雜誌上發表了patisiran安全有效的臨牀數據[8****]**。當然也有慧眼,Arrowhead從2011年到2015年藉機收購了大量別人放棄的RNA資產。Alnylam和Dicerna等公司也沒有放棄,通過裁員等措施度過了最艱難的時期。
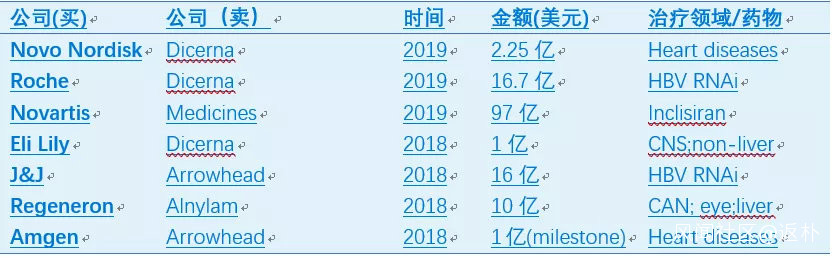
在Alnylam等公司的努力下,siRNA藥物目前已有兩個上市,至少5個處於三期,9個二期,8個一期(表2)。自2018年起,大公司又開始大肆收購siRNA資產,代表性Deal如表3所示,預示着siRNA藥物迎來了第二次浪潮。
表2:上市和處於三期的siRNA藥物
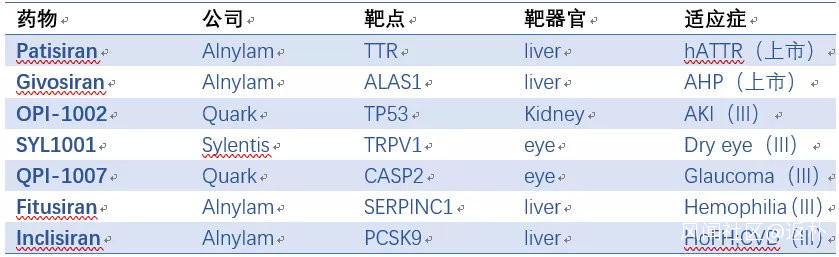
表3:最近的siRNA Deals
3)核酸適配體藥物(Aptamer)
在RNA藥物裏,Aptamer算是一個異類。因為他們不是通過鹼基配對來發揮作用,而是類似於蛋白質,依靠自身的三維結構與配體結合。
1990年8月份,美國Colorado大學和麻省總醫院的科學家分別在Science和Nature發表文章,顯示通過體外進化和篩選,可以得到與目標分子緊密結合的RNA分子,親合力和特異性與單抗相當**[9, 10****]**。
他們把這個篩選過程叫做”Systematic Evolution ofLigands by Exponential Enrichment(SELEX)”。而Aptamer這個名字則是來自拉丁文字“aptus”,意思是“to fix”,中文翻譯成適配體。
SELEX符合適者生存的進化原理,RNA文庫與靶標孵育一定時間後,未結合的分子被移除,而結合的分子洗脱後經RT-PCR擴增形成新的化合物庫,重複上述過程,經過8-20輪篩選,一般能得到高特異性和高親和力的適配體。這個方法也適應於DNA適配體的篩選。基因測序技術的發展大大加速了適配體的發現,而且這些適配體還可以進一步進行化學修飾,目前學術報道的用於治療和診斷的適配體超過1000個。
適配體作為藥物也有過榮光時刻,2004年FDA批准了第一個適配體藥物Pegaptanib,靶向VEGFR,用於治療老年黃斑病變(AMD)。可惜“既生亮,何生瑜”,那時也正是單抗技術飛速發展的時代。FDA同年批准了治療腫瘤的VEGFR單抗Avastin,處方外可以用來治療AMD,療效和安全性優於Pegaptanib。2006年更優的,治療AMD的Lucentis上市,Pegaptanib淘汰出局。隨後,Fovista(anti-PDGF)和Reg1(anti-FIXa)兩款臨牀階段的適配體藥物相繼失敗,Reg1甚至造成了一個病人死亡(PEG過敏),適配體逐漸被工業界邊緣化。
理論上,適配體免疫原性小,易於合成,靶點範圍廣,甚至能夠結合活性細胞,也能靶向細胞內的靶點,還是有不少獨特的優點。然而,隨着單抗技術的成熟,大公司已經沒有興趣進行大的投入。有意思的是,長期研究適配體,從學術界轉行到工業界的科學家Matthew Levy於2018年發表綜述文章,從另一個角度審視了適配體領域衰退的原因**[11****]**。
他認為學術不端造成適配體研究結果不可重複,是藥物臨牀失敗和工業界放棄該領域的一個重要原因。Levy試驗室用FCS技術重複了大量文獻報道的適配體分子,相當一部分根本不可重複。聯繫文章作者,經常得到的回覆是“你們試驗做得不對”。指望這種只在自己手裏工作的分子將來變成一個藥物,Levy認為是在愚弄自己。
Levy指出還有很多試驗室專注於表型研究,而不願意花時間驗證適配體本身與靶點的結合是否可靠,而很多時候,觀察到的表型是其他原因造成的。更有甚者,為了發文章而罔顧科學事實。比如AS1411是一款結合腫瘤細胞表面抗原nucleolin的抗癌藥物。研究表明,AS1411雖然結合nucleolin,但是不能造成nucleolin內吞,但是仍有大量通過AS1411/nucleolin遞送藥物進入腫瘤細胞的文章發表。Levy呼籲,適配體是好的藥物分子,但研究領域需要改變,提高結果的可重複性,讓工業界重拾信心。中國科研誠信問題最近成為熱點,Levy提到的這些教訓尤為應景,值得思考。
4)信使RNA(mRNA)藥物
1961年,在DNA雙螺旋結構發現8年之後,Brenner等人發現DNA和蛋白質之間原來還有“中間人”,即mRNA**[12****]**。沒有這個中間人,基因這個生命的藍圖除了一串化學符號之外什麼都不是。mRNA的結構,功能和代謝立即成為研究的熱點。
1990年,威斯康辛大學科學家首次證明,在動物上直接注射體外轉錄的mRNA可以表達蛋白**[13****]。1992年,美國Scripps研究所的一項工作展現了mRNA治療疾病的潛力,他們通過腦內注射Vasopressin mRNA,成功緩解了大鼠的尿崩症[14****]。可惜,在隨後的20年內,這是唯一的,mRNA作為蛋白替代療法的嘗試。主要是由於mRNA穩定性和免疫原性問題,人們把注意力更多地放在體外穩定的plasmid DNA上。然而,人們逐漸發現DNA作為藥物,問題也很多。比如,藥物需要入核,還容易造成基因插入突變等。隨着化學改造和藥物傳遞技術的發展,RNA藥物的穩定性和免疫原性逐漸得到克服[15****]**,mRNA作為藥物的優點和潛力慢慢展現。
首先,mRNA雖然是核酸分子,但與DNA不一樣,他們的作用是暫時的,完成工作後即被降解,造成基因突變的風險很小;
第二,一旦靶點確定,mRNA藥物的發現和設計幾乎是程序化的,無需費時費力;
第三,鹼基及其類似物,RNA合成酶和固相合成設備的商業化讓mRNA的合成變得簡便。生產成本也大為下降。有專家估計,在當前的技術水平下,mRNA藥物的生產成本是單抗的十分之一左右。這些特點讓mRNA的研發和生產的速度大大加快。2013年,中國爆發禽流感,中國疾控中心公開病毒基因序列後第8天,諾華疫苗部門就完成了一個mRNA疫苗的發現和驗證,創造了一個目前還無人打破的紀錄**[16****]**。這種速度完全可以與病毒變異保持同步,有望徹底解決棘手的耐藥問題。
第四,一個mRNA藥物可以同時表達多種蛋白,這為多價疫苗,比如腫瘤個性化疫苗,以及多蛋白聯合用藥提供了獨特的便利性。這個特點甚至可以用來設計自我複製的mRNA藥物組合,也就是靶點mRNA加全套複製蛋白的mRNA。受制於遞送效率, mRNA分子只有極少(0.01%)能成功進入細胞質並表達蛋白,因此需要大劑量給藥,帶來副作用。藥物自我複製的功能有望幫助降低給藥劑量。
第五,ex-vivo細胞治療的應用。電轉等技術使得體外遞送mRNA進入細胞變得十分便利。將靶細胞經體外導入mRNA操作後,再回輸病人體內,可以避開直接給藥的困難。還可以利用mRNA重編程,體外產生用於治療的iPSC幹細胞。最後,只要遞送技術允許,mRNA幾乎可以在任何組織或細胞,表達任何蛋白,包括基因編輯工具TALEN和Cas9等。這樣CRISPR-Cas9就可以變成一種真正意義上的RNA藥物組合,包括sgRNA和Cas9mRNA。
mRNA藥物理論上可以覆蓋包括單抗,細胞治療和基因編輯在內的所有當前最熱門的新技術。有這樣的故事,就不難理解為什麼2010年成立的,聚焦mRNA技術的Moderna會成為Biotech歷史上最大的IPO。截止今年4月份,Moderna累計募資19億美元,估值已超過50億美元。對於這樣一個沒有任何臨牀數據出來biotech,投資者的厚愛讓人瞠目結舌。
表4. Moderna的管線(摘自公司官網)

但是世界上恐怕沒有比生物科技翻臉更快的了,從高峯到低谷,有時就在一夜之間,只需一個病人的意外死亡。mRNA技術目前還處於非常早期。分子量大,以及蛋白翻譯機器對於去免疫原性和增加穩定性所必須的化學改造容忍度低等原因,讓mRNA藥物的發展滯後於小核酸藥物ASO和siRNA。
mRNA領域發展得比較順利的還是疫苗的開發,這有幾個原因:1)疫苗所要求的蛋白表達量比較低;2)mRNA的免疫反應一定程度度上有利於疫苗的效果;3)抗原遞呈的DC細胞天生善於吸收各種外來分子,有利於藥物的吸收;4)ex-vivo免疫細胞治療積累的經驗比較多。蛋白替代療法發展就相對難一些。除了前面提到的遞送和免疫等因素外,還要一個很重要的原因就是很多蛋白只有正確的摺疊,切割,修飾和分泌後才能發揮正常的功能,而這些轉錄後的調節,有時是組織或者細胞類型依賴的。也就是mRNA需要正確地遞送到特定的組織或細胞裏,目前的技術水平還很難達到。另外,治療蛋白的表達量要求高,這意味着大劑量給藥,製劑輔料以及化學改造後非天然核酸的副作用難以克服。還要,mRNA本身不是治療分子,需要體內“生產”蛋白後起作用,其藥代動力學比單抗類蛋白藥物更加複雜,個體差異更大,難以控制**[17****]**。
推動RNA藥物發展的關鍵技術
RNA藥物的潛力巨大,但要進入體內卻要面臨進化了數億年,大自然設計的防火牆:1)核酸的分子量和負電荷讓其不能自由通過生物膜;2)RNA容易被血漿和組織中RNase酶降解,被肝臟和腎臟快速清除和被免疫系統識別;3)進入細胞後“卡”在內吞小體中無法發揮功能。
所以半個世紀以來,RNA藥物發展面臨的技術障礙一直沒有變,那就是藥物遞送。解決遞送有兩個思路,一個是改造核酸分子,讓其穩定並躲避免疫系統的識別;另外一個就是利用藥物傳輸系統,比如説脂質納米顆粒(LNP)和GalNAc偶聯技術。
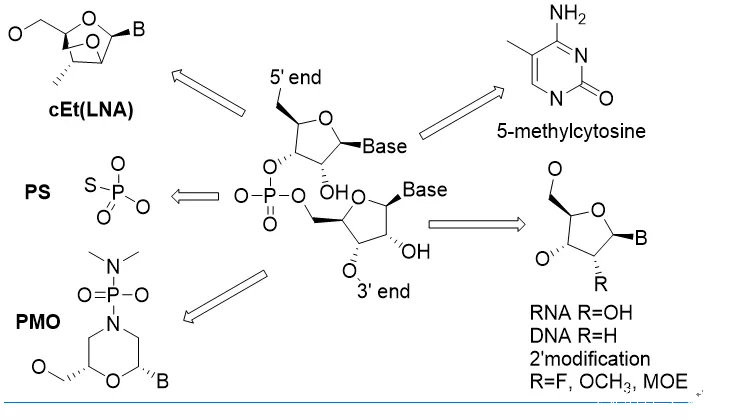
1)核酸分子的化學改造(Chemical Modification)
如圖1所示,核酸分子的化學改造按部位分三類:鹼基,糖環和連接基團磷酸的改造。改造的核酸分子需要考慮多方面的性質,主要包括穩定性,藥代性質,鹼基配位親和力,避開免疫系統但確保能夠被功能酶所識別,因為ASO、siRNA和mRNA等藥物都需要在各種酶(RNase, Ago2 and RNA Polymerase)的作用下才能發揮作用。到目前為止,最具突破性的改造是磷酸連接基團中的一個氧(PO)換成硫(PS)和糖環2位修飾。
德國Max-Planck研究所的科學家在1966年第一次合成報道了PS核酸分子,並意外發現一個原子的改變使得核酸分子可以抵抗酶的降解**[18****]**。雖然穩定性也很重要,但PS對核酸藥物最大影響其實是因為硫原子的疏水性增加了藥物的血漿蛋白結合,從而大大改善了核酸的藥代動力學性質。50多年過去了,雖然有大量的其他嘗試,但PS仍然是核酸藥物中最常用的磷酸連接基團。
PS提高了穩定性,但卻降低了核酸分子鹼基配位的親和力。因為這個原因,第一代ASO藥物需要大劑量反覆給藥,缺點明顯,其他改造變得非常必要。這次,老天爺給了些提示。我們知道,RNA分子中糖環的2位是羥基(OH),而DNA的2位沒有取代基。早在50年代,人們就發現在自然界存在微量的2位是甲氧基(OCH3)的核酸分子。這提示2位可能可以耐受化學改造。
過去30年,Ionis的化學家在2位改造做了大量工作,為核酸藥物的發展做出了不可磨滅的貢獻。目前,核酸藥物中2位最常見取代包括OCH3,F和MOE,其中MOE表現最為突出。糖環的改造還包括構象鎖定類似物(locked nuclearacids, LNA)和嗎啉酰胺(PMO)等。這些改造提高了核酸分子的穩定性和親和力,並可以維持酶識別所需的C3‘-endo構象,以及RNA干擾中RISC識別所需的A-form雙螺旋結構。
核酸藥物對鹼基的改造耐受性較差。ASO和siRNA藥物中常見的改造有胞嘧啶的甲基化(5-methylcytosine)。mRNA藥物中的嘗試相對多一些,包括peudouridine,2-thiouridine, N6-methyladenosine以及各種鹼基的5位甲基化。另外,mRNA轉錄需要5‘-capping,化學改造的cap類似物常用來提高蛋白的轉錄水平。
RNA藥物是多個核酸分子組成的高分子,各種改造的數量和組合對分子的成藥性影響很大,比如一般認為需要14個PS才能保證足夠的血漿蛋白結合。某個特定修飾可能造成酶識別能力的丟失。因此在藥物設計中,需要反覆設計測試最合理的組合。有時還需保持一段天然的系列,比如ASO藥物中被RNase識別的Gapmer。核酸分子的單體改造與小分子藥物不同,如上所述,只有有限的改造空間,而且專利早已過期。因此不同改造的組合,對於IP的產生很重要,這對藥物開發至關重要。
圖1:核酸分子的化學改造
2)核酸藥物的遞送技術(Delivery Tech)
早期核酸的遞送主要是病毒載體,以及dextran等非病毒高分子材料。第一代載體的低效和免疫原性等缺點大大限制了核酸藥物的發展。
1987年,Felgner等發現帶正電荷的脂類分子如DOTMA形成的脂質納米顆粒(lipid nanoparticle, LNP)能夠高效地轉染DNA,效率是dextran的5-100倍,被命名為“lipofection”。隨後,通過添加輔助的其他類脂物質如DOPE,得到進一步改善的“lipoplexes”。
然而,這些早期的陽離子LNP在體內的應用仍然受到很大限制,比如容易被巨噬細胞清除和產生有害的ROS等。為了解決這些問題,“可離子化“LNP的概念被提出。這些脂質分子在體內保持中性,從而避免被清除和帶來副作用,當進入強酸性環境如內吞體,即可以質子化形成陽離子從而與內源的陰離子脂質結合提高跨膜效率。經過篩選,DODAP,DODMA,MC3等一系列可離子化LNPs被開發,從而真正解決了核酸藥物的臨牀應用障礙(圖2)。前面提到的第一個上市siRNA藥物Patisiran就是使用的MC3-LNP技術。
“可離子化”LNP雖然大大促進了核酸藥物的發展,但仍然不盡人意。納米顆粒的體積比較大,一般需要靜脈注射,只能有效進入肝臟,脾臟和腫瘤等空隙較大的組織。另外,LNP的過敏反應也比較嚴重,在注射之前需要使用抗組胺和激素藥物控制。這些缺點讓LNP藥物只適用於罕見病和癌症等嚴重疾病。
近年來,ADC等偶聯靶向技術在藥物傳輸中得到廣泛應用。核酸藥物中最先嚐試的是脂質偶聯(lipidconjugation),比較常見的是與膽固醇偶聯。脂質偶聯的RNA能夠形成類似於低密度脂蛋白(LDL)的聚合物,不但延長了循環時間,而且能與LDL受體或者其他受體結合,通過內吞進入細胞。由於LDL受體在肝臟中高表達,脂質偶聯藥物系統給藥也主要是靶向肝臟,但如局部注射,也能進入皮膚,眼睛和大腦等組織。
讓人意外的是,通過偶聯技術,RNA藥物進入細胞後經常沒有功能。研究發現,主要是因為RNA分子通過內吞進入細胞後,被“卡”在內吞小體內,只有約0.01%的分子能夠逃逸進入細胞質發揮功能。因此,內吞小體逃逸(endosome escape)成為偶聯給藥的限速步驟。為了解決這個問題,Arrowhead的科學家做了一個非常有意思的嘗試。他們在遞送抗乙肝RNAi偶聯藥物時,同時給予一種從蜜蜂毒素中分離的,可以裂解內吞體膜的多肽melittin,大大提高了RNA分子逃逸的比例。十分遺憾,可能是內吞體的正常功能受到影響,melittin也帶來了不可耐受的毒性,Arrowhead停止了三個乙肝項目的臨牀開發。
RNA偶聯藥物似乎走進了死衚衕。然而,天無絕人之路,一項叫做”GalNAc“的技術橫空出世,不但挽救了偶聯技術,還成為RNA藥物王者歸來的真正推手。雖然僅限於肝臟靶點,但GalNAc技術的優勢顯露無遺:1)只需2-5mg/kg劑量;2)皮下給藥;3)一次給藥持續6個月以上;4)製劑簡單穩定性好。諾華97億美元收購的降脂藥物Inclisiran就是使用的GalNAc技術,安全性和便利性甚至超越了口服小分子。
神奇的發現一般源於意外,GalNAc也不例外。1965年,美國NIH的教授Gilbert Ashwell來到紐約哥倫比亞大學進修。閒暇之時經常去拜訪他的好朋友,在Albert Einstein醫學院做研究的Anatol Morell教授。Morell當時正在研究糖蛋白ceruloplasmin的代謝,但苦於沒有辦法測試它的半衰期。做多糖出身的Ashwell建議他用酶剪切水楊酸後,用放射性元素標記糖蛋白末端的乳糖 (Glactose) 。他們發現這種放射性物質注射到兔子體內,5分鐘就從血漿中消失了,幾乎100%聚集在肝臟中**[20****]**。
從這開始,他們發現肝臟中存在一種識別乳糖的受體,最後鑑定為哺乳動物中的第一個凝集素蛋白Lectin,並被命名為Ashwell-Morell受體(AMR)。糖蛋白或者表達糖蛋白的細胞暴露末端乳糖即會被AMR回收進入肝臟。每個肝細胞所含AMR超過50萬個,這些受體結合乳糖及其類似物後內吞,內吞體中的酸性環境讓其釋放貨物並recycle至細胞表面,這個過程大約只需15分鐘。
早在1971年,AMR就被聰明的科學家利用進行靶向肝臟的藥物傳輸**[21****]。隨後,各種乳糖類似物包括親合力最強的GalNAc被發現可以與AMR結合,並可以用做偶聯載體,遞送包括小分子,多肽,蛋白和核酸之內的各種藥物進入肝臟。1995年,GalNAc被發現可以有效遞送核酸分子[22****]。GalNAc的數量,linker及連接方式對遞送效率的影響得到了廣泛的研究。2015年,Alnylam科學家證明GalNAc-siRNA偶聯藥物可以在小鼠和猴子中抑制抗凝血酶的表達,顯示了治療血友病的潛力[23****]**。
圖2:核酸藥物的遞送技術
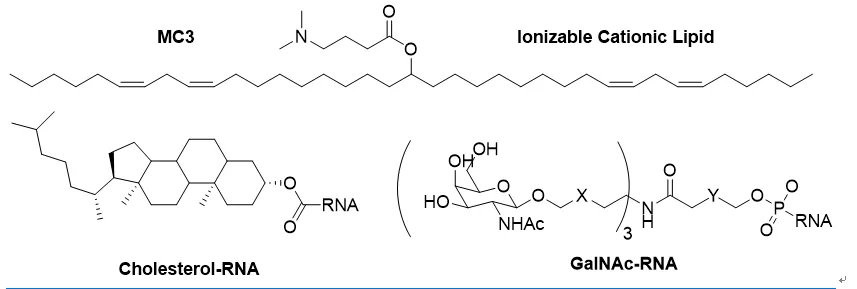
雖然有紮實的基礎研究,GalNAc-RNA藥物的臨牀研究並不是一帆風順,差點胎死腹中。Alnylam的第一個GalNAc-siRNA臨牀候選藥物Revusiran,靶向hTT基因,用於治療退行性疾病ATTR。Revusiran二期臨牀12個月降低血漿TTR水平達90%,卻不明原因增加病人的死亡率,導致2016年試驗中止。
分析發現,死亡原因可能是這款RNA藥物的穩定性不夠,需要大劑量給藥,而經化學改造的非天然核酸分子大劑量下可能帶來毒性。Alnylam隨後推出了更加穩定的所謂“ESC”化學骨架(包含2’-OMe/F;PS),成功地解決了這個問題。第二代anti-TTR產品一年的用量只需100mg, 而第一代Revusiran需要28g,劑量降低了280倍,療效和安全性大為改善。
最近幾年,基於GalNAc的技術平台層出不窮,比如Alnylam的ESC,Dicerna的GalXC和Arrowhead的TRiM等。GalNAc-RNA藥物已迎來蓬勃發展的時期,至少9個GalNAc-ASO產品處於臨牀階段(表5);GalNAc-siRNA發展更為迅速,僅三家公司Alnylam,Dicerna,和Arrowhead產品線即包括一個上市產品(Givosiran),2個三期,4個二期和7個一期產品(表6)。
表5:GalNAc-ASO藥物
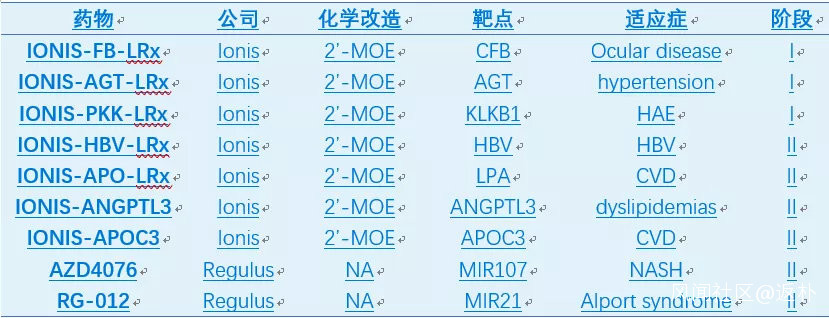
表6:GalNAc-siRNA藥物
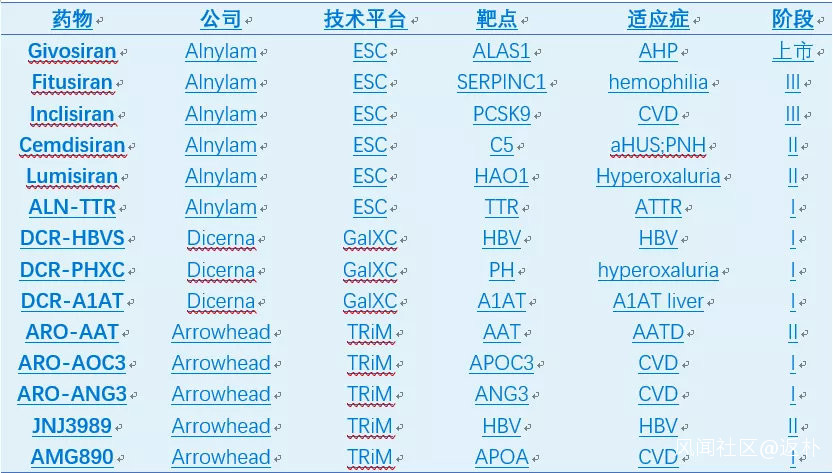
RNA藥物的未來發展方向
RNA藥物近年來獲得了長足的進步,已有7個ASOs,2個siRNA和1個Aptamar上市,超過50個處於臨牀的各個階段。Inclisiran明年可能上市,成為第一個進入慢病市場的RNAi藥物。取得這樣的成績是過去50年化學,生物和遞送技術積累的結果。未來發展方向,可以分為科技和商業二個方面。科技的重點是如何突破肝臟以外的靶器官,這其中的關鍵是破解內吞體逃逸(endosome escape)的機制,而商業上最大的看點是RNA藥物能否帶來真正的“單病人”時代。
1)RNA藥物科技的發展方向
RNA藥物發展的一個最大障礙是靶點侷限在肝臟。雖然通過局部注射,在眼睛和中樞神經等其他組織也有成功案例,但療效和安全性都不盡如人意。繼續改造核酸分子的化學骨架,以及優化核酸系列的排列組合,針對不同靶點選擇合適的鏈結構,顯然是持續努力的方向,但改善的空間十分有限。
突破肝臟侷限最大的希望還在於遞送技術的發展,包括改善LNP的設計和結構,國內mRNA領先企業斯微生物的Core-Shell雙層遞送系統就是一個很好的例子。但終極解決這個問題的關鍵可能在於破解內吞體逃逸的機制。
前面提到,內吞體逃逸是RNA藥物發揮作用的最後一道坎。如果能夠提高目前0.01%逃逸率的一個百分點,藥物劑量即可大大降低,很多當前困擾RNA藥物的問題可以迎刃而解,比如製劑和非天然核酸的副作用,免疫反應等。GalNAc偶聯技術就是一個例子。GalNAc在RNA藥物上獲得巨大成功,除了肝靶向外還大大提高了RNA的逃逸率。不幸的是,我們並不知到為什麼。有人猜測是其受體AMR快速 recycle需要高頻率打開內吞體膜,給了RNA分子逃逸的機會。在不知道機制的情況下,GalNAc就只能是一個意外,它的成功不可複製。因此,理解生物膜的結構和調控規律,破解內吞體逃逸機制是促進RNA藥物發展亟待解決的科學難題。
當然,發現更多肝臟高表達,疾病相關的靶點,短期裏也許更切合實際。乙肝和NASH等肝病重症顯然是優先發展的領域。深入理解RNA的生物學也是推動領域發展的關鍵因素,這些RNA既可以是靶點比如致病miRNA和lncRNA等,也可以是藥物本身。
另外,促進蛋白表達的,非mRNA藥物發展相對滯後,比如ASO,以及華人科學家李龍承教授發現的RNAa等**[24****]**。外源性mRNA有其侷限性,比如有時不能被正確摺疊和修飾,因此提高內源蛋白表達的RNA“激動劑”有獨特的價值。第一個RNAa藥物已進入臨牀研究,通過上調轉錄因子CEBPA治療肝癌。相信,隨着遞送技術的完善,該類藥物還有很大的提升空間。
最後,拓展RNA藥物的應用範圍。基因編輯工具CRISPR-Cas9的核心部件是sgRNA,Rarkau等2019年報道了一種靶向sgRNA的核酸藥物,可以抑制CRISPR-Cas9的功能,將來也許可以用作基因編輯的解毒劑**[25****]**。
2)RNA藥物帶來“單病人”時代
今年2月份,52歲的美國黑色素瘤晚期病人Brad Kremer遇到了一個“要命”的麻煩。他的一個從德國來的包裹被扣在海關,裏面是生物科技公司Bio NTech為他量身定做的腫瘤個性化疫苗BNT122。好事多磨,三個禮拜後他收到包裹並注射了疫苗,隨後早已擴散的腫瘤在他身上慢慢消失了。腫瘤個性化疫苗已經帶有“單病人”的特點,因為這些疫苗是根據病人所特有的腫瘤新生抗原所設計的mRNA,每個病人的藥物獨一無二。
“單病人”這個概念是今年10月份新英格蘭雜誌報道Mila的案例後,FDA兩位主任Dr.Woodcock和Dr.Marks在同期雜誌上發表評論時提出來的**[26****]**。2017年,6歲的小女孩Mila被診斷患有罕見疾病“Batten’ disease”,是由於基因MFSD8插入SVA變異造成的。如果沒有治療,女孩很快將會因為大腦退化而死。波士頓兒童醫院的Dr.Tiothy Yu為她設計了一款靶向SVA的反義核酸藥物,取名”Milasen”,並委託CRO公司完成了定製合成。
通過與FDA的反覆溝通,FDA第一次批准了為單個病人研發的藥物進入臨牀研究。Mila注射“Milasen”後,症狀得到了控制。FDA兩位高管提出了一系列“單病人”時代所面臨的監管挑戰,比如有效的客觀性,安全性的最低要求,批准臨牀需要什麼證據,緊迫性對監管做決定的影響,產品特徵的要求,劑量和用藥方案,持續生產的問題,以及其他倫理和社會問題。
但一旦開了先河,就很難停止。在病人家屬的強烈要求下,Dr.Yu目前正在計劃為一名患有Ataxia telangiectasia的嬰兒開發反義核酸藥物。

Mila(right),from Science
“單病人”是個性化藥物,或者説是精準醫療的極致,這個時代的開啓顯然是因為核酸藥物的技術發展所推動的。當前技術水平條件下,siRNA藥物的一年用藥量可以降到100mg以下,給藥頻率每年二次。mRNA和ASO等藥物的設計在計算機輔助下,幾乎是分分鐘的事情。委託CRO公司生產十分便利,費用也不高。稍微麻煩一點的是製劑的研發和藥物的優化測試。隨着技術的發展,這些環節也極有可能模塊化。
大數據,基因測序,人工智能和3D打印技術必將進一步推動核酸藥物和“單病人”時代的發展。試想一下,將來的一天,你感到不舒服,智能手機抽取一滴血,分析發現你的某個基因或者蛋白不妥,指令發給一台藥物設計,合成和組裝一體化的3D打印設備,1個小時後你就拿到了你自己的藥物,用藥後疾病一次治癒,終身不再發作。如果不是人體生物這個黑洞,這個夢想從藥物技術上看並不遙遠。
結語
幾十億年前,是核酸分子孕育了生命。今天,人類面臨諸多重大疾病的威脅,解鈴還須繫鈴人,基因治療和RNA藥物的發展,從深層次上顯得非常自然和諧。
下個十年,核酸藥物有望成為繼小分子和單抗之後的第三大類型藥物,中國有沒有機會,就看我們的科研,監管,資本,和市場能不能形成一個創新生態。在這個生態下,像Ionis和Alnylam這樣的公司,30年如一日,可以屢敗屢戰,經歷幾起幾落,最後王者歸來。
中國創新藥面臨所謂的醫保懸崖,有人説me-too新藥難做了,急需轉向原始創新和原創技術。大方向沒有錯,但從RNA藥物的發展歷程來看,原創更難,風險很大。如果,我們不能接受或者無法承受失敗,不要輕言從跟隨向原創的轉型。
參考文獻
[1] BioDrugs, Nov 28th2019
[2] Gilbert, W. Nature319, 618 (1986)[3] Zamecnik andStephenon. PNAS, 1978, 75, 285
[4] Jorgensen R, etal. Plant Cell, 1990, 2(4), 279
[5] Fire A, et al. Nature 1998, 391, 806
[6] McCaffrey AP, KayMA et al. Nature 2002, 418, 38
[7] Davis ME et al.Nature 2010, 464, 1067
[8] Coehlo T et al.NEJM 2013, 369, 819
[9] Gold L. Science. 1990 Aug 3;249(4968):505-10
[10] Szostak JW. Nature.1990;346(6287):818-22.
[11] Matthew Levy.Nucleic Acid Therapeutics. 2018, 3:194
[12] Brenner S.Nature 1961, 576
[13] Wolff JA. Science. 1990; 247(4949 Pt1):1465-8.
[14] Jirikowski GF. Science.1992;255(5047):996-8
[15] Kariko K.Immunity 2005, 13, 165
[16] Hekele A. Emerg.Microb. Infect. 2013, 2, e52
[17] Ugur Sahin etal. Nature Review Drug Discovery 2014, 13:759
[18] Eckstein F. J AmChem Soc 1966,88:4292–4294
[19] Felgner et al.ProcNatl Acad Sci U S A.;84(21):7413-7.
[20] Ashell G et al. J Biol Chem. 1971, 246,1461
[21] Roger JC et al.Biochem Biophys.Res.Commun 1971, 45:622
[22] Hangeland JJ etal. Bioconjug Chem 1995, 6:695
[23] Sehgal A et al.Nature Medicine 2015, 21:492
[24] Li LC et al.PNAS 2006, 103(46):17337
[25] BarKau CL et al.Nucleic Acid Ther 2019, 29:136
[26] “Regulation inthe Era of Individualized Therapies” NEJM, online, Oct9th ,2019

本文經授權轉載自微信公眾號“同寫意”。
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。