新冠損傷男性生殖功能出現首個臨牀證據:性激素水平顯著改變_風聞
心之龙城飞将-2020-03-26 16:16
來源:澎湃新聞網
43人蔘與1評論性激素水平為新型冠狀病毒影響男性性腺提供了首個臨牀證據。研究人員再次提醒應關注育齡男性患者的生殖功能。
武漢大學中南醫院生殖醫學中心副教授張銘等人近日在預印本網站MedRxiv(未經過同行評議、未正式發表)上傳了一篇論文,題為《新冠感染對男性性腺功能影響的單中心研究》(Effect of SARS-CoV-2 infection upon male gonadal function: A single center-based study)。
研究對比81名育齡男性新冠患者和100名年齡相仿的健康男性後發現,前者的血清促黃體生成素(LH)和催乳素水平顯著升高,而睾酮與卵泡刺激素相對LH的比值顯著降低。
LH是由腺垂體細胞分泌的一種糖蛋白類促性腺激素,可促進膽固醇在性腺細胞內轉化為性激素。論文作者認為,雖然精液參數才是生殖腺功能的直接反映,但上述指標的改變也為新冠攻擊睾丸功能提供了首個間接的臨牀證據。
致病靶點
眾所周知,新冠病毒攻擊細胞的靶點是簡稱為ACE2的受體血管緊張素轉換酶II。這個靶點並不僅僅出現在肺部。
2月中旬,南京醫科大學附屬蘇州醫院泌尿外科樊彩斌等關注到一部分新冠患者出現腎功能異常甚至損傷。在驗證新冠攻擊靶點在腎臟高度表達的同時,他們還意外發現這類靶點在睾丸中的蛋白質和mRNA表達幾乎是人體內最高的,包括間質細胞和輸精管細胞。
2月下旬,美國國立衞生研究院(NIH)的兩個研究者同樣指出新冠病毒的靶點主要富集於睾丸中的精原細胞、間質細胞和支持細胞。
從理論上來説,任何有這種靶點的細胞都易受新冠病毒攻擊。而且,因為血睾屏障無法完全隔離病毒,相比起細菌感染通常侵襲附睾和副腺,血液中的病毒主要攻擊睾丸。
寨卡、埃博拉、馬爾堡病毒等都曾在男性睾丸和精液中被發現,並引起性傳播。HIV和腮腺炎也可誘發睾丸炎甚至不育症。
而與新冠具有同樣靶點的SARS,曾被發現引起睾丸炎。
綜上,研究人員推測新冠感染可能會使細胞與生殖相關的功能被抑制,從而生精失敗。
不過,這個推測此前尚未得到臨牀驗證。
81例患者
武漢大學中南醫院生殖醫學中心的這個團隊對81名男性新冠患者的血清樣本進行了回顧性研究。他們於3月5日在3月18日期間入住武漢雷神山醫院,年齡從20至54不等(中位數38歲)。
81人中,2例是胸片無陽性改變的“輕型”患者,70例被診斷為“普通型”,即有發熱、咳嗽等常見呼吸道感染症狀,胸片陽性改變;7例為“嚴重性”,即具有一定程度的呼吸困難等症狀;餘下2例“非常嚴重型”則出現呼吸衰竭、休克或多發性器官功能失調。
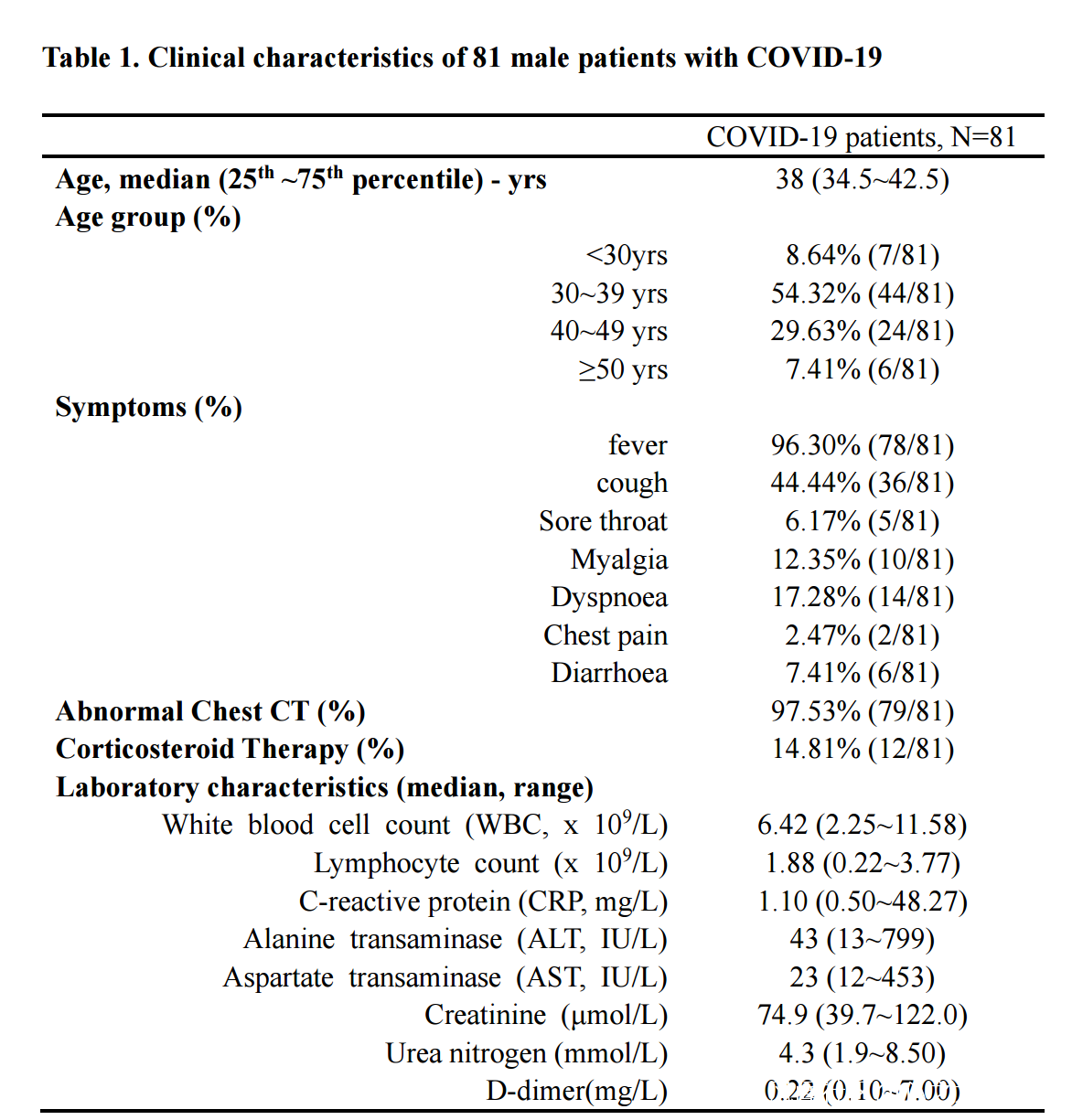
81例男性新冠患者的基本數據
共有31例出現血清丙氨酸轉氨酶(ALT)和/或血清天冬氨酸轉氨酶(AST)升高,表明肝功能受損
對照組則是隨機抽取的100名年紀相仿、生殖功能正常的健康男性。
被檢測的激素包括睾酮(T)、雌二醇(E2)、孕酮(P)、催乳素(PRL)、黃體生成素(LH)、卵泡刺激素(FSH)和抗苗勒氏管激素(AMH)等。
性激素水平改變
與對照組相比,新冠患者的黃體生成素和催乳素水平顯著升高,睾酮和卵泡刺激素相對黃體生成素的比值則顯著降低。
研究人員認為,雖然睾酮水平並無明顯變化,但睾酮和LH存在一種微妙的負反饋機制。在性腺功能減退的早期,睾酮產生受損可能刺激LH釋放,使得睾酮水平得到暫時的維持。
因此,性激素之間的比例,如睾酮/LH,能更好地反應男性的生殖腺功能。

實驗組和對照組的性激素水平
催乳素水平的提高則可能導致垂體抑制和促性腺激素減少。
而由支持細胞產生的激素抑制的FSH水平也無明顯改變,這暗示着新冠病毒對支持細胞的影響可能小於間質細胞。
綜合來看,論文作者認為LH升高和睾酮/LH比值降低可能由睾丸功能障礙引起,如間質細胞損傷。
————————————————————
美國新冠疫苗開發進度受阻?疫苗專家:一鼠難求!
第一財經網
在當前的美國,針對新冠疫苗研發,他們有足夠的經費、足夠的專業科研人員,然而,卻沒有足夠的疫苗試驗所需的小鼠。
新冠疫情在美國爆發以來,全美的實驗室都在爭分奪秒地研製相關疫苗。如今,他們面臨的一個窘境是:有足夠的經費、足夠的專業科研人員,然而,卻沒有足夠的疫苗試驗所需的小鼠。
“10年前在SARS爆發期間,我們研製疫苗時曾經使用過一種轉基因小鼠做實驗,當時不可能有足夠的經費一直供養着這些小鼠,我就提取了當時那批小鼠的精子樣本凍在冰箱裏,現在我們把這些小鼠精子提供給能夠生產相同基因小鼠的實驗室,他們可以通過人工授精的形式,生產出試驗新冠肺炎疫苗所需的小鼠。”艾奧瓦大學醫學院新冠肺炎專家普爾曼教授(Stanley Perlman)告訴第一財經記者。
據美國約翰斯·霍普金斯大學實時監測系統統計,目前美國新冠肺炎確診病例增至68572例,死亡1031例。
 與眾不同的新冠疫苗試驗所需轉基因小鼠
與眾不同的新冠疫苗試驗所需轉基因小鼠
緬因州的傑克遜實驗室(The Jackson Laboratory)是一家為科學家培育科學研究所需要動物的非贏利組織,他們就是普爾曼教授所説的,能夠生產轉基因小鼠的實驗室。
傑克遜實驗室主任、神經學專家魯特茲(Cat Luzt)表示,雖然他們目前大概有1.1萬種同小鼠有關的“材料”,但是這些卻都不能用在培育和生產新冠肺炎疫苗試驗所需要的小鼠,因為科學家需要的是一種人工培育基因為ACE2的小鼠,只有擁有該基因的小鼠才會“感染”上新冠病毒,因此能夠用於相關疫苗的試驗。
魯特茲指出,把上千種轉基因的小鼠一直飼養在籠子裏並不現實,所以大部分的實驗用小鼠都是通過人工授精的形式,即把小鼠的精子和卵子儲藏在低温冰箱,在需要的時候進行人工受精的形式“現用現生”獲得。
魯特茲表示,在他們接到大量研究新冠肺炎的科研人員“下單”要求訂購相關小鼠後,他們查找庫存卵子後發現,只有一種小鼠符合條件,當時這種小鼠被用於SARS的疫苗試驗。
於是,傑克遜實驗室聯繫了普爾曼教授的實驗室詢問是否能夠提供相關小鼠的精子,在收到普爾曼教授實驗室寄出的小鼠精子樣本後,傑克遜實驗室開始進行人工受精,第一批可用於新冠疫苗試驗的小鼠已在3月2日出生。
魯特茲指出,小鼠從受精卵到出生需要3周左右的時間,新生的小鼠需要數週左右的時間發育成熟才能開始“上崗”接受試驗,“從出生到長成‘大鼠’,大約需要12周的時間。”
魯特茲指出,目前他們的實驗室已經收到50多家實驗室所求購帶有ACE2基因的小鼠訂單, 總數約為3000多隻。
合格的“轉基因疫苗鼠”要求也很高
普爾曼教授告訴第一財經記者,在選擇一種疫苗進行動物試驗時有很多考慮因素,最重要的一點在於,它要對相關病毒“易感染”,也就是説,在接觸病毒之後,要能確診感染。
“即使這樣也不一定表示它們就可以作為最佳的試驗動物,因為有時它們即使被感染了,也不會出現相關症狀,很多動物甚至根本不在乎被感染了病毒。”普爾曼教授表示,“如果一種動物感染了相關病毒而沒有表現出生病的症狀,那它就不是最好的試驗動物,利用的價值也將非常有限,因為研究疫苗的有效性時需要觀察相關症狀是否減輕。”
普爾曼教授指出,最好的試驗動物是那種一感染就生病,並且症狀要和人類相似,這樣它們就能給出最有用的信息。
3月17日,第一位志願者在美國西雅圖接受了新冠疫苗實驗性疫苗接種,這也是新冠疫苗首次接受人體試驗。但是,科研人員認為,雖然新冠病毒席捲全球讓疫苗研發面臨巨大的時間壓力,但跳過動物試驗階段直接進行人體試驗有很大風險。
“我們無法將風險降至最小,因為我們面臨着時間的壓力。”賓夕法尼亞大學醫學院教授琳池(Holly Luych)表示,她理解研製新冠病毒疫苗的緊迫性,但是再快的疫苗研發速度也趕不上當前疫情爆發的速度。“我們不能認為中間可以跳過很多步驟讓我們在下週或者下個月就能拿到疫苗。”她説。
然而,也有專家認為,因為當前全球疫情突發亟需疫苗來預防,跳過“動物試驗”階段也可以理解。
“傳統疫苗的研發有的需要15~20年時間。”國際艾滋病倡議項目CEO費恩伯格(Mark Feinberg)表示,“當我們聽到説有疫苗能夠在一年到1年半的時間研製出來時,除非採取新的方式,否則按照正常的時間表是絕對不可能的。” 他認為,鑑於目前形勢異常緊急,直接開始人體試驗是可以理解的。