“神藥”瑞德西韋在華兩項臨牀試驗被叫停_風聞
观察者网用户_227725-2020-04-16 09:32
第一財經4月16日報道,備受關注的瑞德西韋在中國的兩項臨牀試驗日前正式宣告提前結束,原因都是由於沒有更多符合要求的病人入組。

4月15日,第一財經記者查詢相關臨牀試驗註冊網站發現,瑞德西韋中國重症組臨牀試驗的最新狀態已經更新為“終止”,意味着臨牀試驗提前結束,將不會重新開始,參與治療的病人將不再接受觀察或者治療。
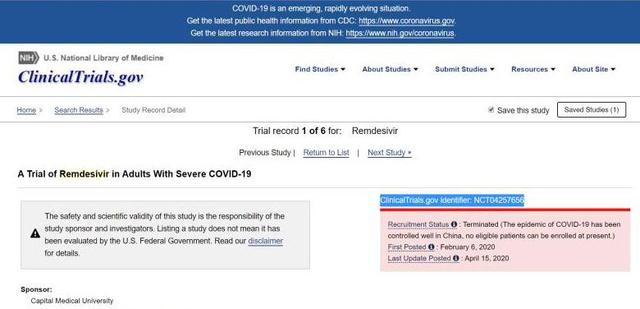
同時,瑞德西韋中國輕度和中度症狀組的臨牀試驗的最新狀態也已更新為“暫停”,意味着臨牀試驗提前結束,但是未來有可能重新開啓。
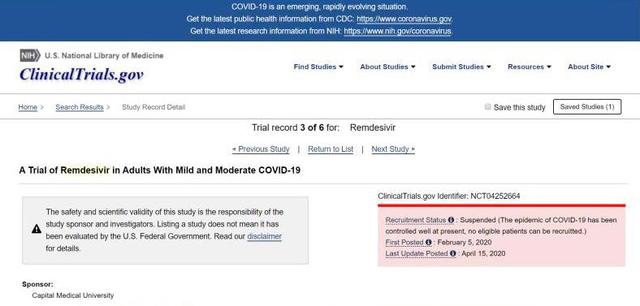
對於兩項臨牀試驗提前停止的解釋,研究人員在原因説明中寫道:“新冠病毒疫情目前已經被較好地控制,無法招募到符合要求的病人。”
瑞德西韋在中國的臨牀試驗自2月6日正式開始,至今已經超過兩個月時間。中國的兩項臨牀試驗採取隨機雙盲對照試驗的嚴格標準,試驗結果一度被寄予厚望。
上述兩項臨牀試驗宣佈停止後,吉利德科學股價隨即大跌近4%。因看好瑞德西韋藥物的前景,近三個月來,吉利德科學股價已經累計上漲超過16%。
瑞德西韋中國臨牀試驗的研究負責人中日友好醫院副院長曹彬教授沒有在第一時間就兩項臨牀試驗的停止做出回應。
本週早些時候,面對瑞德西韋重症組臨牀試驗終止的傳聞,曹彬教授曾表示:“正在對瑞德西韋重症組的數據進行分析研究。”他還堅持最初選擇的隨機雙盲對照的試驗設計。
4月10日,權威醫學期刊《新英格蘭醫學雜誌》(NEJM)在線發表的瑞德西韋同情用藥的回顧性分析結果,納入分析了53例新冠重症患者,得出重症患者病死率13%的結論。
曹彬教授對此發表評論稱:“這項研究只能認定為一項病例報告,因為沒有對照組試驗,沒有安慰劑研究的控制。不管是10例還是50例患者數據,證據的等級都是一樣的。”
瑞德西韋在中國臨牀試驗的停止,也讓美國正在開展的一項全球性的瑞德西韋臨牀試驗得到更大關注。
美國國立衞生研究院(NIH)已經於2月21日啓動了這項臨牀試驗,同樣採取隨機安慰劑對照,該試驗正在入組800例不同程度症狀的患者。這項臨牀試驗的重症患者結果有望於4月底前公佈,輕度和中度症狀患者的結果有望於5月下旬公佈。
我還找到了新浪醫藥關於此事的報道,大家可以綜合着來看一看。
以下內容來自新浪醫藥新聞:
據悉,這項隨機、雙盲、安慰劑對照、多中心3期臨牀研究(NCT04252664)始於今年2月初,計劃入組308例輕中度患者,隨機分配到瑞德西韋治療組或安慰劑組。治療組患者在第1天給予瑞德西韋200mg負荷劑量,隨後每天一次100mg靜脈內維持劑量,持續9天。對照組患者則給予同樣方案的安慰劑。主要終點是在最長28天內患者的臨牀恢復時間,定義為研究治療開始到患者發熱(<37度)、呼吸頻率(≤24次/分鐘)、血氧飽和度(>94%)、72小時咳嗽症狀(輕度或無咳)等指標緩解。次要終點為全因病死率、呼吸症狀的進展、退燒時間、呼吸困難減輕的時間、上呼吸道樣本中2019-nCoV RT-PCR轉陰性的時間、上呼吸道樣本中2019-nCoV病毒載量減少的變化、機械通風需求的頻率以及嚴重不良事件的發生頻率。
此前研究人員認為,在發展為重症之前接受瑞德西韋治療,患者更有可能從該藥物受益。但由於缺乏入組患者,這已經是吉利德一週內在中國停止的第二項瑞德西韋研究。上週末,吉利德宣佈暫停該藥在重症患者中的3期臨牀。許多投資者對該消息表示震驚,因為這兩項試驗是目前瑞德西韋用於COVID-19唯一的隨機研究。
幾天前,吉利德在《新英格蘭醫學》雜誌上發表的一篇針對接受瑞德西韋同情用藥治療效果的論文,在最終53例患者的可分析隊列中,有超過一半需要機械通氣的患者已拔管,幾乎一半的患者出院。結果顯示出,該藥療效“50/50”,即對半數患者有效。但該研究分析存在一個很大的缺陷,就是缺少控制對照組,因此很難從數據中得出確切、嚴謹的結論。但一個明顯的積極現象是,該藥物缺乏安全危險信號,這一點從瑞德西韋在更大規模的埃博拉感染患者研究中的表現就可以看到。
但研究人員懷疑,最新的研究數據是否具有某種暗示意義。英國倫敦衞生與熱帶醫學學院藥物流行病學教授Stephen Evans對彭博社表示:“有一些證據表明瑞德西韋有療效,但是我們不知道如果不給患者藥物,他們會發生什麼。”加拿大皇家銀行的分析師Brian Abrahams也表示:“所有的研究結果均暗示出該藥的療效有限。”吉利德也承認現有研究存在侷限性。
吉利德針對瑞德西韋治療COVID-19已進行了至少五項臨牀試驗,目前其在歐洲和美國的其他試驗仍在進行中,並且對暫停的研究也會分析、提取數據結果。本月將至少有一至兩項研究計劃發佈結果。
Abrahams指出:“4月下旬吉利德將公佈一項瑞德西韋用於重症COVID-19患者的3期臨牀試驗SIMPLE關鍵分析結果,但由於缺乏控制組,對結果的解釋可能有限。5月份還將公佈該試驗針對中度患者的研究數據。美國國家過敏和傳染病研究所(NIAID)領導的瑞德西韋研究數據最快也可能在5月發佈。”
即使吉利德曾一再聲明瑞德西韋不會成為其未來產品線中重要的基石,但許多人押注,即使不能成為吉利德的利潤中心,但瑞德西韋也將是一款重要產品,尤其是考慮到需求的廣泛和迫切性。Needham分析師Alan
Carr表示:“相信在確定該瑞德西韋能上市用於COVID-19治療後,吉利德就會評估後續批次的定價策略選擇。”據知情人透露,吉利德已經生產了150萬瓶瑞德西韋,將用於患者治療。
參考來源:
1、Gilead Suspends a Remdesivir COVID-19 Trial in China
2、UPDATED: Gilead takes a hit after a closely-watched Covid-19 trial of remdesivir is quietly terminated, raising fresh doubts