人類準備好迎接轉基因的蚊子了嗎?_風聞
biokiwi-biokiwi官方账号-用生命科学的角度看世界(公众号/微博/知乎同名)2020-08-29 13:37
本文作者 Tadpole | 公眾號 biokiwi
本文關鍵詞 轉基因 蚊子 Oxitec 科學技術
你可能吃過轉基因大豆等植物,也聽説過實驗室中會有轉基因小白鼠等;但如果常常在你身邊縈繞的生物也變成轉基因的,你能接受嗎?
這種狀況可能在不遠的將來就會發生。
美國佛羅里達羣島地區8月19日批准了一項轉基因蚊釋放計劃,將於2021年開始累計釋放約7.5億隻轉基因雄蚊,用以控制埃及伊蚊(Aedes aegypti)的數量,減少其攜帶的戈登熱、寨卡病毒等疾病的傳播。

(圖源:unsplash)
事實上,這並不是轉基因蚊的第一次實驗,此前已有累計超過10億隻轉基因蚊,被投放在世界不同地區,進行轉基因蚊滅蚊相關的實地實驗(field test)。
此次被大眾熱議的轉基因蚊,來自一家成立於2002年的科技公司——牛津昆蟲技術(Oxford Insect Technologies,現名Oxitec)。這家公司將轉基因技術運用到滅蚊中,利用顯性致死基因攜帶昆蟲釋放技術(release of insects carrying a dominant lethal,RIDL),打造“活體滅蟲劑”(living insecticide)。
高中生物必修二中講過,顯性基因的特徵是隻要存在這個基因就能夠表達、並體現在對應的生物性狀當中。因此攜帶有這個顯性致死基因的雄蚊,和它產生的後代都會因為這個基因而死亡。
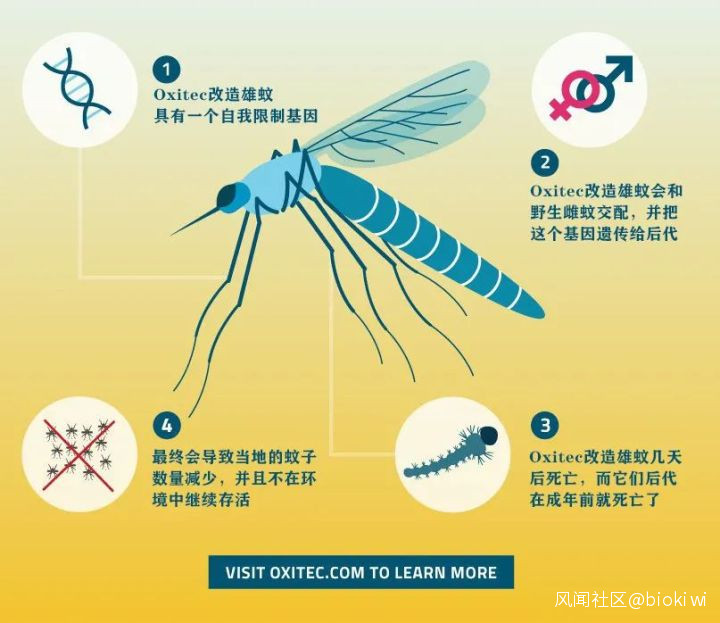
Oxitec公司官網上介紹的簡要滅蚊原理(圖片翻譯自:Oxitec)
為保證轉基因雄蚊在投放自然前好好地活着,研究人員在植入顯性致死基因的同時,加上了一個可以控制該基因表達的“開關”——四環素轉錄調控系統。
在實驗室環境裏,因為四環素的存在,致死基因的轉錄、表達被抑制,雄蚊能夠正常的生長;一旦進入缺少四環素的自然環境,這個開關便被打開,轉基因雄蚊後代因致死基因,生長發育受到抑制,難以存活。
2007年,名為 “OX513A” 的轉基因雄蚊研製成功,隨後開展了一系列實地實驗。自2009年開始,約330萬轉基因雄性埃及伊蚊被投放在開曼羣島。該實驗的結果不僅證明這些轉基因雄蚊能夠在自然環境下生長繁殖,還在約11周後讓埃及伊蚊的數量減少了80%左右。

(圖源:Oxitec)
2016年5月,開曼羣島希望嘗試用同樣的方法對抗埃及伊蚊攜帶的致命病毒,減少這些病毒對人類的傷害,這也意味着在有人居住的區域進行轉基因蚊的投放。該項目最終得到了積極的結果:在1800人居住的西灣地區(West Bay)投放轉基因蚊後,相比其他類似地區,埃及伊蚊的數量下降了約88%。
另一方面,Oxitec在巴西也開展了實地實驗,從2011年開始向巴西東部巴伊亞州的雅科比納市累計投放了5000萬隻轉基因雄蚊,當地野生埃及伊蚊數量下降了80~95%。
2016年1月27日在巴西Fiocruz研究所顯微鏡下拍攝的埃及伊蚊(圖源:VOA)
但 “OX513A” 存在一個不利於傳播和降低效率的缺陷,因為其後代不論雌雄都活不下去,所以需要持續投放轉基因雄蚊,以達到控制埃及伊蚊數量的目標。
為提升效率,新一代的轉基因蚊 “OX5034” 問世,該類型僅導致會吸血、傳染疾病的雌蚊死亡;部分雄蚊後代可以攜帶致死基因,並繼續傳遞給下一代埃及伊蚊。在反覆消滅雌蚊的同時,該致死基因也會隨着一代代的繁殖被稀釋,最終消失。
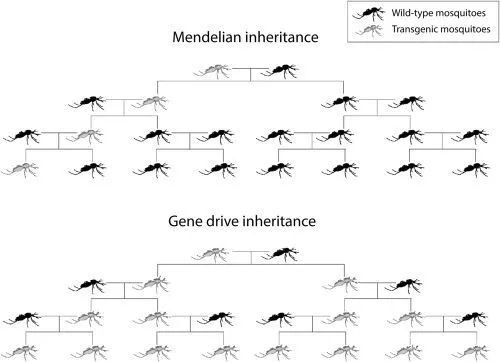
如果你還記得高中生物的遺傳圖,這個可能會更有助於理解這個過程:黑色是野生蚊子,灰色是敲除基因蚊子;上圖是我們熟知的孟德爾遺傳方式,而下圖是雄性不受影響的遺傳方式(圖源:James S, et al.)
隨後,OX5034在2018年於巴西聖保羅州進行了實地實驗,實現野生埃及伊蚊數量下降96%左右的不錯效果。
儘管此前的實驗都取得了比較理想的結果,但轉基因的做法始終會讓人們擔憂。於是乎,當這項實驗計劃來到美國,獲得美國環境局的批准,並取得佛羅里達羣島的蚊蟲管控區的許可後,討論的聲音也開始熱鬧起來。
其實早在2016年,Oxitec就曾打算在佛羅里達進行實地實驗,但因為種種原因該計劃被取消。不難想象,這其中也包括來自各方的質疑。而這一次相關部門能夠通過該計劃,也從側面説明是其在反覆權衡利弊之後的決定,當然也包括Oxitec方面更加完善的風險説明。
生命充滿太多的不確定性和未知,人們想要徹底弄清楚基因和自然之間的關係,可能要花費很久很久,甚至可能永遠也沒法理解透徹。
因此,在什麼情況或什麼樣的標準下,人類可以在自然環境中使用基因編輯等生命科學技術,是必須要慎重考慮的難題。

另一個著名的例子,2018年的賀建奎轉基因嬰兒事件,就再次給人們敲了一次警鐘:到底何時,並且又應如何正確使用轉基因編輯技術?(圖源:紐約時報)
以前文提到的轉基因蚊為例:一面是埃及伊蚊等蚊蟲攜帶的大量病原體,對人類造成嚴重的傷害,幾乎影響全球半數以上人羣;而另一面因為轉基因的特殊性質,人們會擔心轉基因蚊對人體的傷害、對其他動物的影響、以及對整個生態系統可能帶來的變化。
儘管在發展科學技術的同時,人們基於已有的知識儘可能地規避風險:
1. 轉基因處理的均為不會叮咬人羣的雄蚊,而後代中的雌蚊會因為攜帶致死基因死亡。即便是極小概率倖存的雌蚊,也不會因為叮咬將自己的基因輸入;
2. 因為生殖隔離的存在,轉基因埃及伊蚊只能和同類交配產生可繁殖的後代,所以對其他蚊類幾乎不會造成影響;
3. 毒性測試和理化測試顯示,轉基因蚊對於其捕食者無毒無害。且大多數捕食者也並非只以埃及伊蚊為食,故對其上游的食物鏈影響並不大;
4. 已有的多次實驗室實驗以及實地實驗,均未顯示明顯的基因漂移或出現抗殺蟲劑類型的野生蚊子;
5. 在大多數地區,埃及伊蚊本身就屬於外來物種,其數量的下降對原有的生態系統並不會造成太大的打擊;
……
基於已有的知識體系和邊際,人們為了應用新技術做出了很多努力;但還是那句話,生命科學充滿了太多不確定性。以上提到的每一點考慮都可能會出現一些極端小概率的反面例子、或因為未知出現的 bug。
就像一個熟悉、但有些不同的哲學問題:有一輛高速運行的火車,前方軌道上有人,而變軌的方向有霧,很難知道那邊是沒有人、還是有更多人。
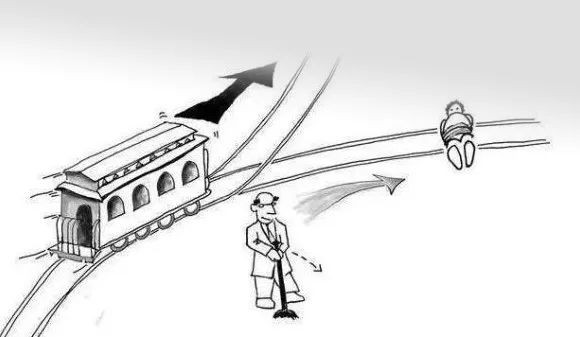
新電車難題:我們應該如何面對未知的前方(修改自網絡圖片)
這輛火車沒辦法停下,而且會越來越快。
人們現在能做的,是努力探索未知,儘可能的撥開那邊的迷霧。
參考資料:
LaMotte, Sandee (June 18, 2020). “Genetically engineered mosquitoes get EPA approval for Florida release”. CNN. Retrieved 2020-06-21.Carvalho, Danilo; et al. (2 July 2015).
“Suppression of a Field Population of Aedes aegypti in Brazil by Sustained Release of Transgenic Male Mosquitoes”. PLOS Neglected Tropical Diseases. 9 (7): e0003864.
Evans, Benjamin R.; Kotsakiozi, Panayiota; Costa-da-Silva, Andre Luis; Ioshino, Rafaella Sayuri; Garziera, Luiza; Pedrosa, Michele C.; Malavasi, Aldo; Virginio, Jair F.; Capurro, Margareth L.; Powell, Jeffrey R. (10 September 2019).
“Transgenic Aedes aegypti Mosquitoes Transfer Genes into a Natural Population”. Scientific Reports. 9 (1): 13047.
James S, Collins F H,Welkhoff P A, et al. Pathway to deployment of gene drive mosquitoes as apotential biocontrol tool for elimination of malaria in sub-Saharan Africa:recommendations of a scientific working group[J]. The American journal oftropical medicine and hygiene, 2018, 98(6_Suppl): 1-49.Subbaraman, Nidhi (10 January 2011).
“Science snipes at Oxitec transgenic-mosquito trial”. Nature Biotechnology. 29 (1): 9–10.
“Genetically Engineered Animals - Oxitec Mosquito”. US Food and Drug Administration; Animal and Veterinary. 2017-02-05. Retrieved 2017-09-01.