新冠病毒正在變異——這重要嗎?【譯】(10月25日更新)_風聞
GHTT-观三教九流人等,骂五湖四海畜生。2020-10-23 17:48
譯者:上個月看到這篇文章前後正好去聽了一個北大的外籍學者講他們如何篩選針對新冠病毒的中和性抗體,領導們給了他們的工作很高的評價;然而,作為一個進化生物學者,我的知識讓我覺得抗體療法並不是什麼真正值得大書特書的工作方向,再加上我之前一直對新冠的變異會引發什麼後果有興趣,所以就把這篇文章加到了我的翻譯日程裏。不過正如我之前所述,我個人現在內外交困,除非被什麼東西刺激到了,否則這種義務翻譯也會比較慢。【】內為譯者注。
原文發表於2020年9月8日
不同的新冠病毒菌株尚未對此次世界性大流行得進程造成顯著影響,但今後未必【一直】如此。
作者:Ewen Callaway
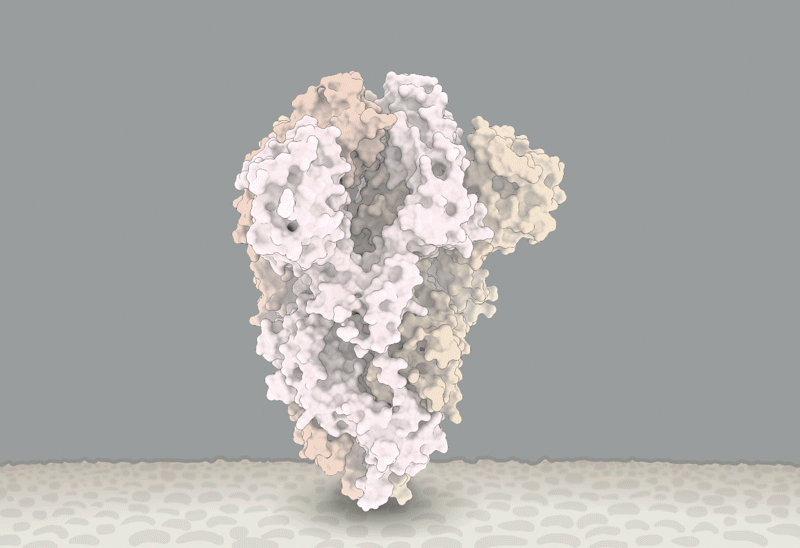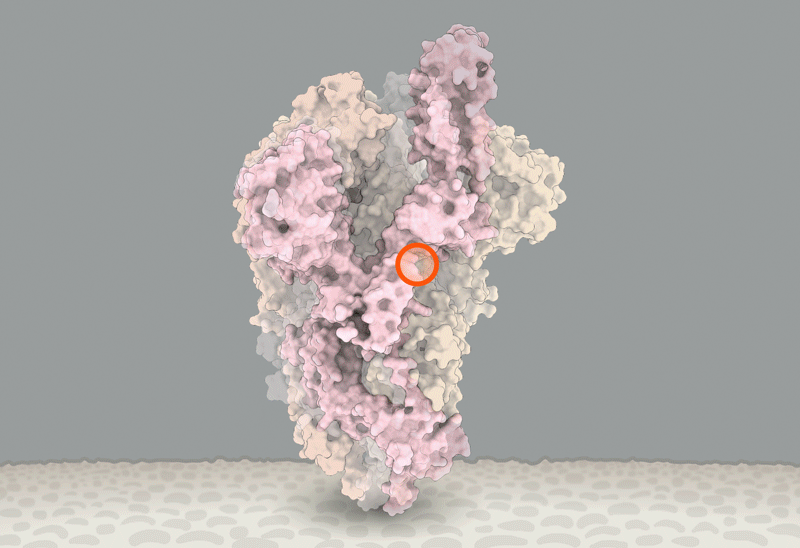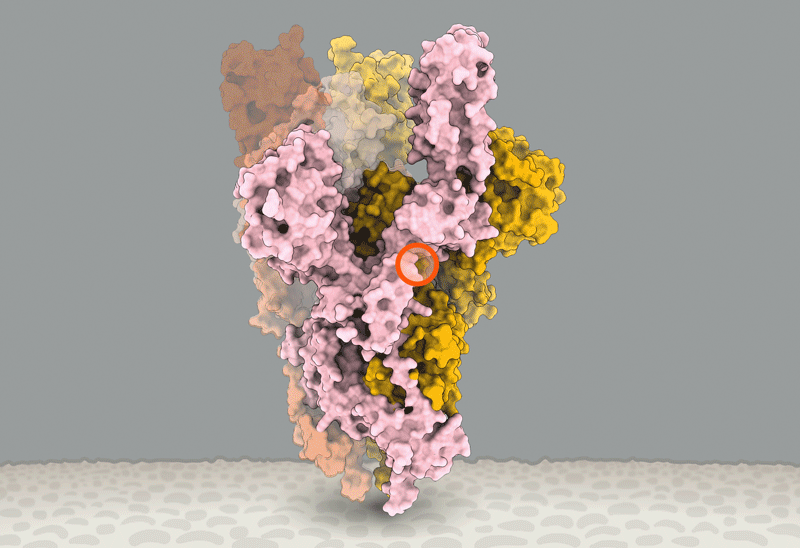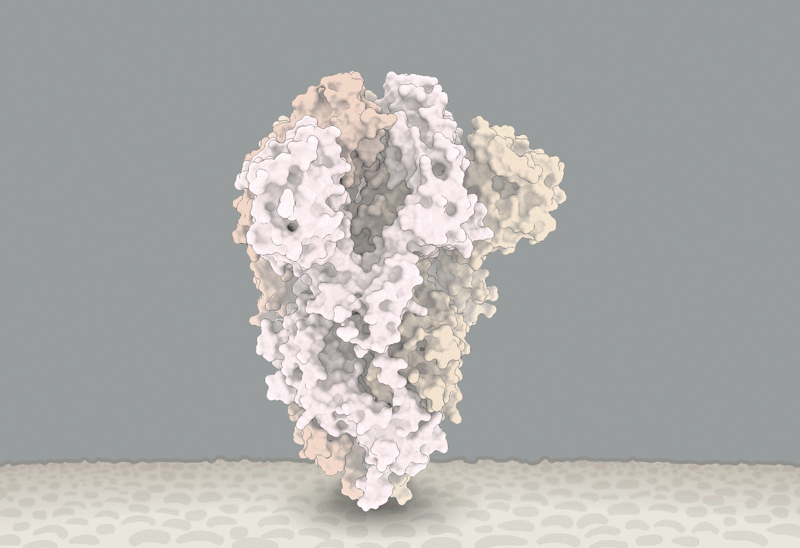
新冠刺突蛋白的構象變化,紅圈內為D614G突變引起變化的位置。據信,這個突變能讓刺突蛋白更易進入與RBD結合的構象。圖源:Structural data from K. Shen & J. Luban
當COVID-19在今年席捲全球之際,David Montefiori便對這個全球大流行背後的致命【推手】病毒會在人際傳播的過程中如何變化感到好奇。作為一個病毒學家,Montefiori在他大半的職業生涯中都在研究HIV【注:即人類免疫缺陷病毒,艾滋病的病原體】的小概率突變如何幫助其逃脱免疫系統【的攻擊】。【因為】他認為同樣的事情可能會發生在SARS-CoV-2【譯註:即新冠病毒】上。
三月份時,Montefiori這個在杜克大學(Durham, North Carolina)指導着一個艾滋病疫苗研發實驗室的人聯繫了另一位【研究】艾滋病病毒進化的專家、也是他的長期合作者Bette Korber。Korber是一位在新墨西哥州Sante Fe的Los Alamos國立實驗室(LANL)工作的計算生物學家。他【此時】已經開始了對數千個冠狀病毒的基因序列進行探查,以【發現】那些可能在此病毒的傳播過程中改變其特性的突變。
與HIV相比,SARS-CoV-2在其傳播中的變異速度要慢得多。但【其中】一個突變引起了Korber的注意。它位於編碼【病毒】刺突蛋白的基因中,而病毒顆粒正是在此蛋白的協助下得以穿透細胞【膜】。Korber發現這個突變在COVID-19患者的【生物】樣本中屢次出現。在刺突蛋白的第614個氨基酸位點上,天冬氨酸(D)經常會因為在這個病毒的長達29903個字母【譯者:即核算序列】的RNA編碼中的一個單核苷酸的複製錯誤而被甘氨酸替代。病毒學家們稱之為D614G突變。
四月時,Korber、Montefiori和其它科學家在bioRxiv【譯者:一個生物類的線上預出版網站】的一篇論文中警示“D614G【在病例中的】頻率正在以一個引人警惕的速度增加”[1]。這個變種【在那之後】迅速成為了歐洲SARS-CoV-2【病例】的主要毒株,並且隨後佔據了美國、加拿大和澳大利亞。他們在文章中宣稱,作為自然選擇的產物,D614G【可能】代表着一種“傳染力更強的SARS-CoV-2類型”。
這些論斷讓很多科學家感到不快。這些科學家説,現在【的證據】並不能弄清楚D614G病毒株是否感染性更強,也不能清楚它的擴散是否意味着任何不同尋常之事。但是媒體已經迅速拉響了警報。儘管許多新聞報道也納入了這些研究者們的提醒,但有些卻在標題中宣佈這個病毒正通過變異變得更加危險。當回顧【這件事】時,Montefiori説,他和他的同事們都後悔將這個【病毒】變種的擴散描述為“引人警惕”的。【而】這個詞在這篇論文7月出版於《細胞》期刊的同行評議版本中被去除了。
這個著作激起了一陣對D614G的狂熱興趣。因為它的快速擴散和普遍性,就連那些對這個變異改變了新冠病毒特性持懷疑態度的人都同意這【個情況】引人遐想。在數月時間裏,這支病毒株已經被發現於幾乎所有的SARS-CoV-2樣本中了 (參見‘Global spread’)。“目前,這個變種就是大流行本身。因此,【瞭解】它的特性事關重大。” 來自耶魯大學(New Haven)公共健康學院的病毒傳染病學家Nathan Grubaugh和他的兩個同事在一篇《細胞》上發表的關於Korber和Montefiori的發現的評論文章中這樣寫到[3]。
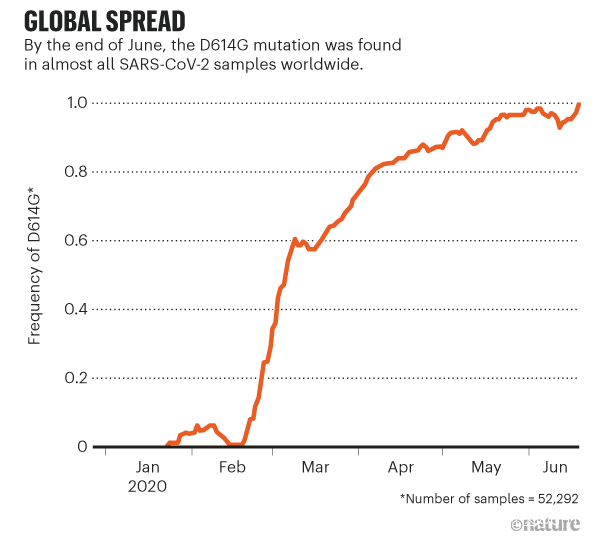
圖源:Ref. 8
至今,這項研究的最終結果並未像Korber和Montefiori的預出版論文中所示的那般清楚。一些實驗表明,帶有這種突變的病毒會更容易感染細胞。另一些研究則帶來了一些好消息:這個變種可能意味着可以【讓】針對SARS-CoV-2的疫苗更容易【被開發】。但是仍有許多科學家認為支持D614G能夠顯著影響病毒的傳播或其【在病例中的比例】上升,是源於自然選擇的證據並不充分。北卡羅萊納大學(Chapel Hill)的Timothy Sheahan説到:“此時尚無定論。這個變異可能意味着什麼,也可毫無意義。”
Sheahan、Grubaugh和其他人認為,對於新冠病毒的突變,研究者們【未解】的問題要遠多於【能給出的】答案,並且迄今為止還沒有發現任何足以引起公眾健康問題的SARS-CoV-2變異。但細緻研究這些突變可能對控制這場大流行起到重要作用。這也可能有助於提前排除那些最令人擔憂的突變,即那些能夠幫助病毒逃避免疫系統、疫苗和抗體療法【的突變】。
緩慢的變異
當SARS-CoV-2在中國被發現後不久,研究者們就開始分析病毒樣本並在線公佈了其基因序列。突變——其中大多數都是來自不同病人的病毒【所攜帶】的點突變——讓研究者們能通過聯繫近緣的病毒株來追蹤SARS-CoV-2的傳播,並推測其開始感染人類的時間。
以RNA編碼其基因組的病毒,諸如SARS-CoV-2,HIV和流感病毒,因為控制其複製的酶容易出錯,所以它們在宿主體內增殖時常常快速變異。例如,當嚴重急性呼吸綜合徵(SARS)【譯者:即“非典”】病毒開始在人類中傳播後,它產生了一種被稱為“缺失”的、可能減慢了其傳播的突變【譯者:作者原文如此。但這裏實際上可能意為:一個缺失突變可能減慢了其傳播速度。】[4]。
不過測序數據顯示,冠狀病毒要比其它的RNA病毒變異得更慢,這可能是由於其擁有一個修復潛在得致死性複製錯誤的“校對”酶。瑞士Basel大學的分子流行病學家Emma Hodcroft説,一個典型的SARS-CoV-2病毒【平均】每月只能在其基因組中累積兩個點突變。這個速率是流感病毒的一半,是HIV的四分之一。
其它的基因組學數據也也加強了【對】這種穩定性【的支持】——超過90000個【病毒】分離株已被測序並公開(見www.gisaid.org)。Lucy Van Dorp是一位倫敦大學學院的計算遺傳學家【譯註:即生物信息學家】,她主要致力於追蹤那些能帶來進化優勢的【基因】差異。她説,世界上任何地方獲得的兩個SARS-CoV-2病毒在其【長達】29,903【個鹼基】的基因組中最多也僅僅有10個RNA單字【譯註:即單核苷酸】不同。
儘管這個病毒變異緩慢,研究者們還是從SARS-CoV-2的基因組中羅列出了超過12,000個【點】突變。然而,科學家們發現變異的速度要凌駕於他們能找出這些突變的意義的速度。許多突變對病毒的傳染性或致病性毫無影響,因為它們不會改變【所編碼的】蛋白質的形狀,而那些確實會改變蛋白質的突變比起提高更可能會損害病毒【的適應性】(見‘A catalogue of coronavirus mutations’)。作為SARS-CoV-2基因組實時分析工程Nextstrain【譯註:其實這個項目所蒐集分析的遠不止新冠病毒的信息,還包括其它多種微生物,我之前的文章也從上面扒過數據。大家有興趣可以去看看,有條件可以去參與】的參與者,Hodcroft説:“破壞一件東西總比要修復它容易得多。”
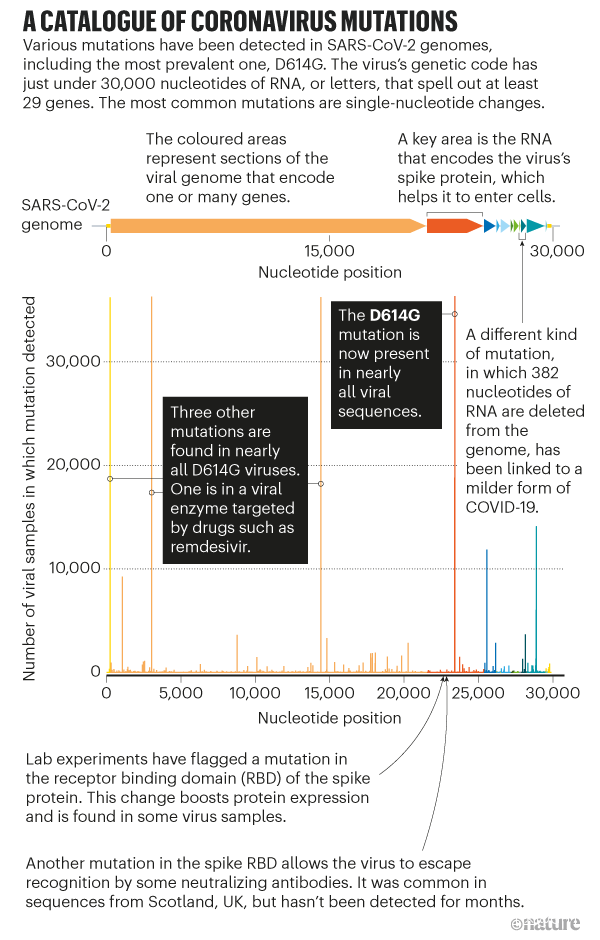
圖源: L. Van Dorp et al. (http://go.nature.com/3GSRNH6); Refs 2, 11, 12; B. E. Young et al. Lancet 396, 603–611 (2020)
許多研究者懷疑,如果增強這個病毒傳播力的突變確實發生了,那它很可能在以前——也就是這個病毒第一次感染人類或開始在人際間迅速傳播時——就已經發生了。在這個幾乎所有地球人都是易感體的時刻,已經不會有什麼選擇壓去推動病毒進化出更強的傳染性了,所以即使有有益突變【出現】,可能也不會擴散開來。哈弗T. H. Chan公共健康學院(Boston, Massachusetts)的流行病學家William Hanage説:“對這個病毒來説,人人皆為魚肉。它【在這方面】完全不需要變得更好了。“
更快的傳播速度?
當Korber發現D614G快速擴散時,她想她或許發現了一個有【適應性進化】意義的自然抉擇案例。這一突變之所以引起了她的注意是因為它位於刺突蛋白上,而後者正是中和抗體與該病毒結合以消除其感染性的位點。況且,帶有這個突變的病毒發生的頻率正在全世界不止一個地方上升。
帶有D614G的病毒最初在一月下旬被發現於中國和德國;大部分科學家懷疑這個突變起源於中國。現在,這個突變大多會被和位於SARS-CoV-2基因組其它部分的【另外】三個突變一同發現,【而這】可能是大部分D614G病毒起源於一個共同祖先的證據。
D614G在歐洲的快速上升【同樣是】引起Korber注意【的原因】。三月以前——即【歐洲】大陸大部分都在實施封鎖之時——未變異的‘D’型病毒和變異的‘G’型病毒【譯註:即新冠病毒的兩個病毒株,或品系】都存在【於歐洲】,而遺傳學家採樣發現,D型病毒為當時大部分西歐國家所流行的病毒株。根據 Korber、Montefiori及其團隊的報告[1,2],在三月,G型病毒的出現頻率在整個大陸【開始】上升;至四月為止,它們已經成為佔絕大多數的毒株了。
但是,自然選擇有利於G病毒並非對這種情況唯一的、甚或是最可能的解釋。G型變種在歐洲大陸佔統治地位【的原因】或許僅僅是出於偶然——例如,可能這個突變恰巧在傳入歐洲的病毒中更常見那麼一點。【由於】一小撮個體【譯者:大概是指人,我不能完全確定】似乎導致了大部分的病毒傳播事件,【因此】一個早期的傾向於【攜帶】G病毒的偶然性【傳播】事件【也】可以解釋該品系【為何能】在現在占主導地位。這種“建立者效應”在病毒中十分常見,尤其是在像SARS-CoV-2在三月中下旬傳入歐洲時那種未被察覺的情況下。
通過顯示D614G在加拿大、澳大利亞和米國部分地區快速成為統治毒株(【這項研究中】冰島是個例外,其G病毒在爆發早期就被D病毒所取代了),Korber及其同事在他們四月份發表的預出版物中1嘗試去排除建立者效應。通過分析來自英國謝菲爾德的住院數據,該團隊沒有發現任何關於該型病毒能夠加重人們病情的證據。但是G病毒的感染者的鼻腔和口腔內的病毒RNA含量似乎要比D病毒的感染者更高。
許多科學家並不認同D614G的增長是一件什麼大不了的事——或者乾脆覺得這跟大流行無關。Sheahan説:“我認為這個預出版物【的內容】還很不成熟。”
Montefiori説,他和Korber關於D614G的觀點受到了他們關於HIV工作的影響。而他們在那些研究中發現,就連最不起眼的變異都可能會對免疫系統的病毒識別【能力】產生深遠的影響。“我們對它【譯註:指D614G】保持警惕,將看看它會不會對疫苗產生影響。”他補充道。
快速推進的實驗室研究
為了進一步研究D614G是否讓這個病毒變得更具傳染性,Montefiori在實驗室中對它的效果進行了測試。因為【無法滿足】特定的生物安全防護要求,他無法在他的實驗室中研究天然的SARS-CoV-2病毒。所以他使用了一種能用SARS-CoV-2刺突蛋白感染細胞的轉基因艾滋病毒進行研究。【譯註:雖然HIV聽起來很可怕,但其傳染性限於體液,且傳染力不高;這就導致了在生物安全等級的分類中,其威脅遠遜於能夠通過呼吸道傳染的各種病原體。】這樣的的“假病毒”顆粒是病毒實驗室【研究活動】的中堅力量:它們讓【人類對】對諸如埃博拉病毒之類致命性病原體進行安全研究成為現實,並讓【人類】能輕易地測試突變的效果。
六月,來自Scripps Research研究所(La Jolla, California)的Hyeryun Choe和Michael Farzan首先對D614G假病毒實驗做出了報告[5]。另外的幾個團隊【也】已經將類似的研究【內容】發表到了bioRxiv上(Montefiori以及另一位合作者的實驗發表於《細胞》[2])。這些團隊運用不同的假病毒系統、對多種類別的細胞進行了測試,但實驗結果都指向一個共同的結論:帶有G突變的病毒要比D病毒更容易侵染細胞——在一些情況下,其【侵染】效率可能有高達十倍的差異。
馬薩諸塞大學醫學院(Worcester)的病毒學家Jeremy Luban説,在實驗室測試中,“我們所有人都同意G比D讓【病毒】顆粒傳染性更強”。但這些研究也伴隨着許多潛在的問題——那就是它們與人類感染之間的相關性不明。“令人氣惱的是,有些人【拿着雞毛當令箭,】把研究者們在嚴格的控制條件下得到的結果【強行】與這個大流行掛鈎。而我們離能確定這點還有很長的路要走。”Grubaugh説到。【譯者:建議各位自省一下,平時是否也常常會有同樣的毛病?】在大多數情況下,假病毒只帶有冠狀病毒刺突蛋白。因此,這些實驗也只是在檢測這些病毒顆粒進入細胞的能力,而不是它們在細胞內會產生什麼效果,更別提它們對於一個生物體的影響了。【同時,】它們也缺少其他三個D614G所具有的突變。Luban説:“一個基本點是:它們不是新冠病毒。”
現在,一些實驗室正在用具有不同單氨基酸突變的、有感染性的SARS-CoV-2病毒進行研究。它們被用在了實驗室培養的人體肺細胞和氣管細胞上,以及像紫貂和倉鼠這些實驗動物身上。Sheahan説,對於具有相關經驗和生物安全能力來操控這些病毒的實驗室而言,“這項工作就像為其量身定做的一般【容易】”。首個相關研究由德克薩斯大學醫學系(Galveston)的研究者們於9月2日發表於一份預出版物上[6]。他們發現突變了的病毒在人類的肺細胞和氣管組織中要比D病毒更具傳染性,而且變異病毒在倉鼠的上呼吸道中含量更高[6]。
【但】就算這些實驗可能也沒有【讓問題】變得完全明確。愛荷華大學( Iowa City)的冠狀病毒學家Stanley Perlman説,一些研究表明,某些中東呼吸系統綜合徵(MERS)病毒的刺突蛋白變異能夠在小鼠中引起更嚴重的病症——而其它該蛋白的突變則幾乎對人類和駱駝沒什麼影響,而後者很可能是人類MERS感染的【自然】病原庫。
關於D614G對SARS-CoV-2在人類中擴散的效力有影響的最清晰證據出自一個雄心勃勃的、叫做“英國COVID-19基因組聯合會”的英國團隊,該團隊已經分析了約25000個病毒樣本的基因組。從這些數據中,研究人員已經辨別出了超過1300例病毒進入英國境內並傳播的案例,【其中】既包括D型也包括G型病毒。
一個由英國愛丁堡大學的進化生物學家Andrew Rambaut、帝國理工學院的流行病學家Erik Volz以及卡迪夫大學的生物學家Thomas Connor所領導的團隊研究了62個由D病毒和245個由G病毒在所引發的英國聚集性感染【案例】。研究者們沒有發現感染這兩種病毒的患者有任何臨牀【表現】上的不同。不過,G病毒要比沒有攜帶變異的品系傳播得稍快一點且造成了更大的聚集性感染。Volz説,據粗略估計,它們的傳播效率大概有20%左右的不同,但實際的數值可能會略高或略低【於這個值】。Rambaut説:“對於【這個病毒的】絕對性質而言,這並沒有什麼大影響。”
他補充道,D614G可能是一個能幫助這個病毒侵染細胞或獲得與其它未攜帶此突變的病毒的競爭優勢的適應性變異,但對於SARS-CoV-2在人際間或種羣內的傳播影響甚微。Grubaugh説:“這或許的確是一個針對人體或人類細胞的適應性變異,但它並沒有改變任何現狀。一個適應性的突變並不一定要增強其傳染力。”
Grubaugh認為,部分是由於D614G【的相關研究】產出了一批有影響力的論文,這個突變已然吸引了科學家們過多的目光了。他説:“科學家們被這些突變所瘋狂吸引。”但是,他也將【對】D614G【的研究】看作是一個瞭解一種沒有多少遺傳多樣性的病毒的途徑。他説:“我作為病毒學家的一部分在看到這些東西時會説:這項研究一定會十分有趣,它孕育了許多值得深究的奇特現象。”
而他將不得不迎合這一趨勢。Luban説,對D614G的深入研究應該會有助於解釋SARS-CoV-2是如何與細胞融合的,而這一過程可能可以被藥物阻礙或被疫苗所針對【譯註:實際上應該是被藥物或抗體所阻礙】。在他們發表於bioRxiv上的假病毒實驗7月16日的更新中[8],Luban的團隊應用了冷凍電鏡來分析帶有D614G變異的刺突蛋白的結構。這個刺突蛋白由三個相同的、各自呈“開啓”或“關閉”狀態【譯者:這裏原文orientation,其實應該是comformation(構象)吧】的肽鏈組成。之前的研究顯示,病毒顆粒要想與細胞膜融合,至少三個肽鏈中的兩個 都需要呈開啓狀態。而Luban的團隊發現,具有G型突刺變異的病毒呈現這個狀態要容易得多(參見‘The mutation that loosens the spike protein’)。Montefiori和Korber研究中由Korber在LANL的同事Sandrasegaram Gnanakaran所領導的計算機建模工作,給出了相同的結論[10]。Luban説:“看上去這台分子機器【譯註:指G病毒顆粒】進行了D所沒有的優化。”
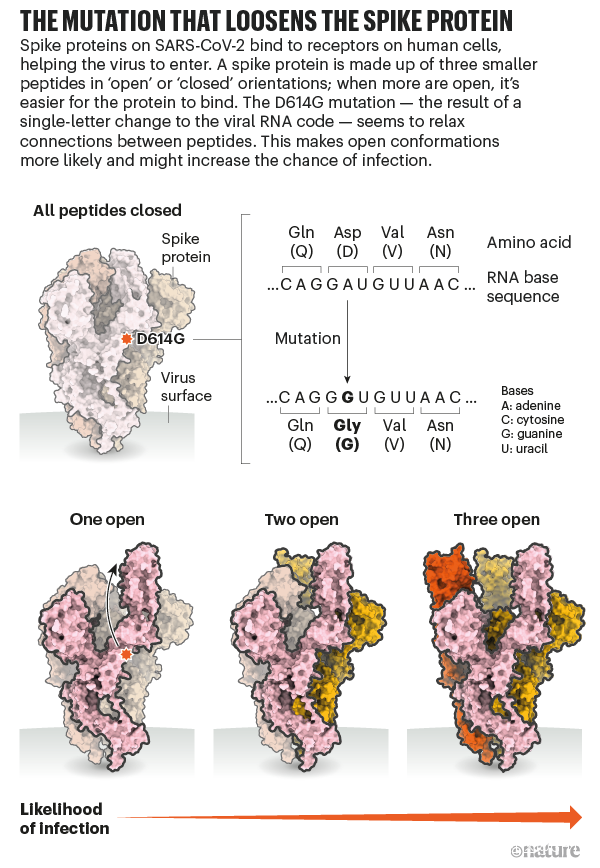
圖源:Structural data from K. Shen & J. Luban
抗體尚可一戰……吧?
大部分現有的證據表明,D614G並沒有像Montefiori擔心的那樣阻礙免疫系統產生的中和抗體識別SARS-CoV-2。這或許是因為此種突變並沒有發生在刺突蛋白的受體結合域(RBD)【譯註:有些人會翻譯為為位點,但’domain’譯作蛋白質的域其實更接近原意】——一個很多中和抗體的靶向區域:而RBD與【宿主表面】細胞受體蛋白ACE2的結合是病毒進入細胞的關鍵一步。
但是,越來越多的證據表明,其它的突變可能將協助這個病毒避開部分抗體【的攻擊】。一支由洛克菲勒大學(New York City)的病毒學家Theodora Hatziioannou和Paul Bieniasz所領導的團隊修改了一種畜病病毒——口腔小泡病毒【譯註:即vesicular stomatitis virus】的基因,使它能夠使用SARS-CoV-2的刺突蛋白感染細胞,並在中和抗體的存在下生長。他們的【研究】目的是篩選出能夠躲避抗體識別的刺突蛋白的變異。這個實驗產生了能夠抵抗從COVID-19康復患者的血液中所提取的、及正在研發中的單克隆抗體療法中的抗體的刺突蛋白突變體。根據Hatziioannou、Bieniasz及其團隊的報道,雖然這些突變中的每一個都【已經】從病人中分離的病毒序列中被發現,但是它們出現的頻率還很低,這意味着這些突變還沒有因正向選擇而擴散開來[11]。
其他的科學家正在通過預測哪些突變可能【比較】重要來試圖走在SARS-CoV-2的進化之前。西雅圖Fred Hutchinson癌症研究中心(Washington)的進化病毒學家Jesse Bloom所領導的團隊創造了接近4000種刺突蛋白的RBD突變,並且測量了這些替換會如何改變刺突蛋白及其與ACE2結合的能力。雖説大多數的突變都對【病毒的】這些性能沒有影響或有負面效果,但有少量的【突變】提升了病毒的性能[12]。其中的一些已經在COVID-19的病人身上被檢測到了,但Bloom的團隊還沒有發現任何針對這些變異的自然選擇的跡象。他説:“很可能這個病毒與ACE2之間的結合已經足夠好了。”*【譯者:那是因為還沒有足夠的選擇壓。】
研究者們沒有測試其中是否有任何突變能夠使這個病毒阻礙抗體的功能,但是他的團隊的結果顯示這種可能性是存在的。Bloom説:“這個病毒獲得能改變其對抗體其免疫的敏感性的突變【確實】是一個可能事件,但無論如何都不該被視作一個必然事件。”
基於對其它冠狀病毒所積累的經驗,這一過程或將長達數年。對橫跨多個季度的普通感冒冠狀病毒的樣本進行的研究揭示出一些【病毒】應對免疫的進化跡象。不過,病毒學與免疫學研究所(德國波恩)的RNA病毒學家Volker Thiel説,這個變化的速率是緩慢的,“這些病毒株多少還會保持穩定。”
當世界上大部分【人】仍然處於SARS-CoV-2的易感狀態時,免疫不太可能對這個病毒的進化產生什麼重大影響。然而,Sheahan説,當整個種羣開始獲得免疫力時——不論【這種免疫力】是通過感染還是接種疫苗【產生的】——能規避免疫的突變的緩慢而穩定的擴散可以幫助SARS-CoV-2【在人羣中】永久地立足,並有大概率在那些因之前的感染或接種而存有殘餘免疫力的個體中引發輕症。“如果這個病毒作為一種更普通的、引發感冒的冠狀病毒而存在,我不會感到驚訝。”但是也可能,我們針對包括SARS-CoV-2在內的冠狀病毒感染的免疫反應,並沒有強到或持續到產生能夠顯著改變這些病毒的選擇壓的程度。
如果抗體療法被濫用,也可能導致【這些】令人擔心的突變變得更常見。例如,如果罹患COVID-19的人【都】接受一種抗體【的治療】,而這種抗體能夠被一個病毒突變所抑制。研究者們表示,單克隆抗體的雞尾酒療法——即其中每一個都可以識別刺突蛋白的多個區域【譯註:原文如此。但應是作者理解有誤,雞尾酒療法的實際上應為:每個抗體能識別刺突蛋白的一個不同區域,當複合使用時可以確保有效抑制所有病毒。】——或許可以降低某一突變被自然選擇而固定的概率。疫苗則不會引發這麼多這方面的擔憂,因為它們就如人體的天然免疫反應一樣能產生一系列【不同】的抗體。
在Montefiori的團隊發表於七月的一份研究中發現,D614G突變甚至有可能讓其更容易成為疫苗【譯註:原文如此。實際應為免疫系統產生的抗體】的目標[13]。#接受了包括紐約輝瑞製藥(Pfizer)所研發的一種疫苗在內的【譯者:這段好突兀,感覺作者是不是收了輝瑞的錢?】眾多實驗性RNA疫苗中的一種的小鼠、猴子和人所產生的抗體被證明,其阻擋G病毒的能力比阻擋D病毒的能力更強。
Montefiori説,在如今G病毒隨處可見的情形下,這項發現是個好消息。但是作為一個觀察過HIV通過變異來規避多種針對它的病毒的疫苗的科學家來説,他對SARS-CoV-2躲過人體免疫反應的潛在可能保持警惕。Luban同意道:“我們需要對額外的變化保持關注。”
參考文獻
1.
Korber, B. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.04.29.069054 (2020).
2.
Korber, B. et al. Cell 182, 812–827 (2020).
3.
Grubaugh, N., Hanage, W. & Rasmussen, A. Cell 182, 794–795 (2020).
4.
Muth, D. et al. Sci. Rep. 8, 15177 (2018).
5.
Zhang, L. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.06.12.148726 (2020).
6.
Plante, K. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.09.01.278689 (2020).
7.
Volz, E. M. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.07.31.20166082 (2020).
8.
Yurkovetskiy, L. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.07.04.187757 (2020).
9.
Wrapp, D. et al. Science 367, 1260–1263 (2020).
10.
Mansbach, R. A. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.07.26.219741 (2020).
11.
Weisblum, Y. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.07.21.214759 (2020).
12.
Starr, T. N. et al. Cell 182, 1295–1310 (2020).
13.
Weissmann, D. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.07.22.20159905 (2020).
原文信息:
Nature 585, 174-177 (2020)
doi: 10.1038/d41586-020-02544-6
https://www.nature.com/articles/d41586-020-02544-6