類似藥倒逼原研藥企降價,阿達木百億市場再增實力玩家_風聞
健识局-健识局官方账号-医事药闻,一图解局。2020-12-08 22:00

生物類似藥迎來爆發式增長
作者:雷公
來源:健識局
全文2872字,閲讀需10分****鍾
在生物藥的開發道路上奔跑近十年後,復宏漢霖終於迎來了收穫季。
12月7日,復宏漢霖宣佈“漢達遠”獲得國家藥品監督管理局批准上市,可用於類風濕關節炎、強直性脊柱炎、銀屑病等自身免疫疾病的治療。
據悉,“漢達遠”是復宏漢霖在一年多的時間裏收穫的第三個產品,在此之前,復宏漢霖的利妥昔單抗注射液“漢利康”和注射用曲妥珠單抗“漢曲優”已經由國家藥監局批准上市,均為國內同類品種裏首個上市的生物類似藥。
“漢達遠”的原研藥阿達木單抗(修美樂)來自艾伯維,自2002年在美國獲批上市來曾連續8年摘得全球藥品銷售冠軍,市場空間巨大。
然而,阿達木單抗的治療費用仍超出許多中國患者的承受範圍,國內大部分患者因可及性問題未能得到規範化治療,阿達木單抗在中國仍存在巨大的未滿足的用藥需求。
據弗若斯特沙利文報告預計,中國阿達木單抗生物類似藥市場將於2023年增至47億元,2030年達到115億元規模。
當然,在復宏漢霖領跑的這條賽道上也不乏一些競爭者。就阿達木單抗而言,目前國內已有三款阿達木單抗的生物類似藥上市。
作為國內第四款批准上市的阿達木單抗生物類似藥,漢達遠自身優勢也頗為突出,為中國首箇中歐“雙GMP認證生產基地”的阿達木單抗生物類似藥,也是唯一一個具有中國銀屑病患者III期研究數據的阿達木單抗生物類似藥。
獲批上市後,“漢達遠”有望為中國數目龐大的自身免疫病患者帶來福音,實力角逐阿達木單抗百億級市場。
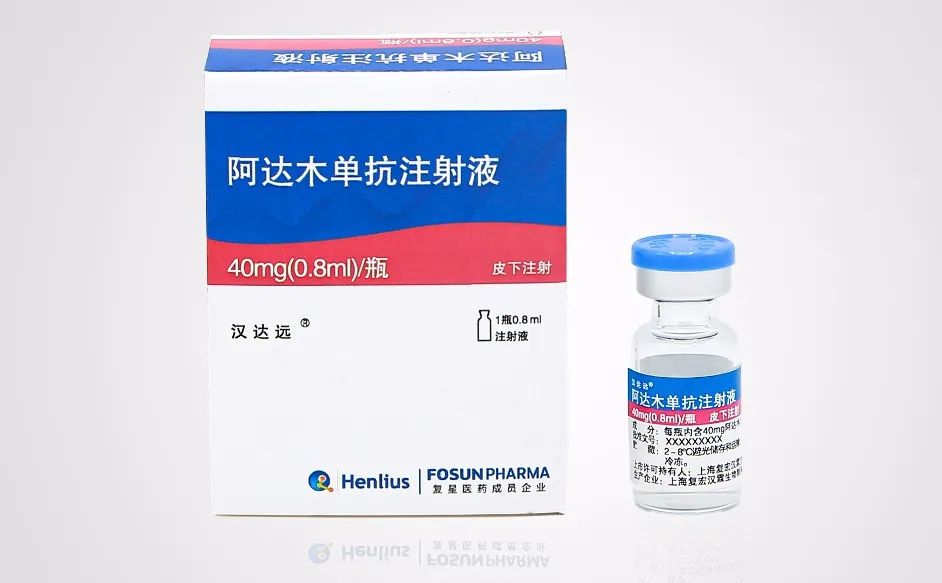
產品示意圖
對標國際標準
多款產品獲全球知名期刊認可
眾所周知,生物類似藥在生產工藝和質量控制上有很高的技術壁壘,既然是“生物類似藥”,就要求在臨牀療效與安全性上與原研藥無臨牀意義差別。
在復宏漢霖成立之初的2010年,中國關於生物類似藥研發與評價的指導原則尚未出台。作為中國首批自主開發生物藥的企業,復宏漢霖在成立之初就參照歐盟GMP(生產質量管理規範)標準,逐步建立研發—生產—商業化一體化的全產業鏈平台。
因此從某種意義上説,復宏漢霖實質上引領了國內生物類似藥研發生產的質量體系建設。
“對標國際標準”,看似簡單的六個字,卻意味着復宏漢霖在研發、生產領域要有更嚴苛的標準和更多時間、精力的投入。業內認為,這種“對標國際標準”的模式費力不討好,不僅要斥巨資購買原研藥去做頭對頭的臨牀試驗,還極有可能造成試驗結果無法達到預期。
而且在當時,國內生物藥開發準則尚未敲定、監管途徑尚未走通的情況下,復宏漢霖“自我加碼”,是面臨巨大挑戰的。幸運的是,2015年中國審評審批制度改革啓動。**國家藥監局出台“生物類似藥指導原則”,要求生物類似藥的開發標準和原則與歐盟大體統一。**對於一直堅持國際最高標準的復宏漢霖來説,這正是一大機會。阿達木單抗是這一體系之下,復宏漢霖研發管線裏的眾多產品之一。
圖源視覺中國
今年11月,復宏漢霖第二個上市的生物類似藥產品“漢曲優”(注射用曲妥珠單抗)在腫瘤治療領域知名雜誌《Cancer Chemotherapyand Pharmacology》上發表了國際多中心Ⅰ期臨牀試驗結果,不僅表明了國際同行審評對試驗數據的認可,也是對高品質國產生物類似藥開發水平的肯定。
此外,該產品的III期研究在中國、歐盟的波蘭、烏克蘭、菲律賓等國家開展,成為國內首個開展國際多中心III期臨牀試驗的國產生物類似藥。
開發、生產與國際接軌,無疑讓“漢曲優”在產品營銷上佔盡優勢。自今年7-8月獲得中歐雙批之後,“漢曲優”已在中國、英國、德國、葡萄牙、西班牙等多個國家陸續上市。
就在最近,“漢曲優”贏得了英國最大的公立醫療機構採購區——倫敦及周邊地區的採購競標,並進入了皇家馬斯頓醫院、英國國王學院醫院(已完成使用曲妥珠單抗患者的用藥轉換)、英國倫敦大學醫院、英國聖喬治醫院等多個享譽國際知名醫院和癌症研究中心。
得益於復宏漢霖從一開始就遵循全球領先的標準體系,其產品在國際化的過程中順利推進,多了一條可走的路。
迎政策紅利
生物類似藥倒逼原研藥企降價
隨着我國藥物審批提速,生物類似藥行業發展潛力巨大,包括復宏漢霖在內的生物藥企業都將享受到政策的紅利。截止目前,國內外藥企都在加速展開行動,瓜分市場份額。

圖源視覺中國
健識局獲悉,中國約有391個生物類似藥申報審評,主要靶點包括CD20、EFGR、VEGF、TNF、RANKL、HER2等,涉及利妥昔單抗、曲妥珠單抗、貝伐珠單抗、阿達木單抗等。中金研報指出,中國生物類似藥市場規模有望呈現爆發式增長:預計到2030年市場規模將達到589億元,2018年-2030年均複合增長率為35.1%。
面對虎視眈眈的潛在競爭者,原研藥紛紛開啓降價模式,以應對市場變局。以羅氏的安維汀(貝伐珠單抗)為例,安維汀在其生物類似藥研發接近完成之時,2017年以近60%的價格降幅進入國家乙類醫保目錄,價格為1998元,2018年進一步降至1934元。
不僅僅是安維汀,全球年銷量超過200億美元的“藥王”修美樂也在生物類似藥即將衝擊市場前進行了降價。2019年,艾伯維將單價從7600元調整至3160元,降幅近60%。隨後,“修美樂”成功進入2019年醫保談判目錄,艾伯維將“修美樂”醫保支付標準調整為1290元。
對於復宏漢霖而言,其“對標國際標準”的模式已初見生效。根據公司2020上半年財報顯示,漢利康的銷售額為9580萬元,同比增長549%。
質高價優成競爭關鍵
組建500人銷售團隊覆蓋全國260城
就在政策利好的同時,復宏漢霖也通過不斷採用先進的生產技術在保證產品國際質量的同時,降級生產成本。生物類似藥要搶佔原研藥的地位,衝擊原有的市場格局,非常關鍵的因素是質高價優。如果整個開發生產的成本過高,不但無法對原研藥造成影響,市場也不會為之買單。
在中國,進口生物藥的價格在降價進入醫保前普遍較高,年治療費用很多都達到20—30萬元,這對於國內普通家庭來説,肯定是巨大的經濟負擔。而復宏漢霖創立的初衷正是為了能讓中國老百姓用得上、用得起中國自主品牌的好藥。

圖源視覺中國
2019年,該公司上市的治療淋巴瘤的漢利康(利妥昔單抗注射液)執行零售價為1398元/支(100mg/10ml),比同品規的原研藥價格低了約40%。據《2017中國淋巴瘤患者生存調查》的數據,國內88%的淋巴瘤患者家庭年收入在20萬元以下。這次降價將直接惠及更多淋巴瘤患者,同時也能為國家節省更多醫保支出和醫療資源。
健識局獲悉,除了國內已上市的“漢利康”、“漢曲優”和“漢達遠”三款產品外,復宏漢霖目前還有1個產品已獲得上市註冊申請受理,10個產品、8個聯合治療方案正在全球範圍內開展20多項臨牀試驗。
隨着更多產品的上市,復宏漢霖加緊商業化佈局。目前已建立了一支近500人的商業化團隊,全面覆蓋全國六大銷售區域內260餘個城市。
復宏漢霖與復星醫藥旗下萬邦醫藥達成了商業化協議,授權在風濕免疫領域深耕多年的萬邦醫藥對“漢達遠”進行商業化運營。
萬邦醫藥將充分汲取其在風濕治療領域的成功經驗,圍繞未被滿足的醫療需求,為基層醫生提供更多培訓資源,為患者提供更便捷的病程管理服務。利用互聯網醫院如“優醫邦”,幫助患者得到專業及時的諮詢及服務。
同時,萬邦醫藥將結合復星醫藥集團資源優勢,通過公益基金和保險服務,從經濟和心理層面減輕患者負擔,讓患者感受“價值醫療”。