阿斯利康腺病毒載體新冠疫苗獲英國緊急使用授權_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2020-12-31 15:45
12月30日,阿斯利康(AstraZeneca)公司宣佈,該公司與牛津大學聯合開發的新冠疫苗AZD1222已經獲得批准在英國緊急使用,用於18歲以上成人的主動免疫。值得一提的是,為英國醫務工作者提供的疫苗信息文件中指出,探索性分析顯示,延長這一疫苗兩次接種之間的間隔時間,有可能提高疫苗的免疫原性。
同時英國藥品與健康產品管理局(MHRA)的授權建議該疫苗接種兩次,間隔時間為4-12周,而不是臨牀試驗方案中的4周。在英國政府發佈的新聞稿中,疫苗和免疫聯合委員會(The Joint Committee on Vaccination and Immunisation, JVI)建議的接種策略是儘量給更多人接種第一劑疫苗,而不是儘快完成兩劑疫苗的接種。

AZD1222是一款基於複製缺陷型黑猩猩腺病毒載體的新冠疫苗。它使用腺病毒載體表達新冠病毒的刺突蛋白。這一疫苗的3期試驗臨牀結果日前已經在《柳葉刀》雜誌上發表。試驗數據顯示,在防護出現症狀的COVID-19疾病方面,AZD1222達到70.4%的保護能力。這一新冠疫苗的一個重要特點是它可以在2-8℃的冷藏環境下保存長達6個月,為疫苗的儲存、運輸和使用提供了很大便利。
不同接種方案的疫苗保護效力和免疫原性不同
而對試驗數據的進一步分析顯示,調整AZD1222的接種方案,有可能進一步提高疫苗的保護能力。在《柳葉刀》發表的研究指出,先以半劑量接種,在一個月後以全劑量接種的分組中,疫苗的保護效力達到90.0%,而兩次接種均為全劑量的分組,有效率僅為62.1%。

這一差別在預防無症狀感染的探索性分析中也得到體現。在半劑量/全計量接種組中,對無症狀感染的防護效力達到58.9%,而全劑量/全劑量組這一數值只有3.8%。
為英國醫務工作者提供的疫苗信息文件中顯示,接種這一疫苗能夠在超過99%的參與者中達到血清型轉化(定義為與刺突蛋白相結合的抗體水平與基線相比提高4倍以上)。而兩劑疫苗接種之間相隔的時間越長,與刺突蛋白結合的抗體水平越高!
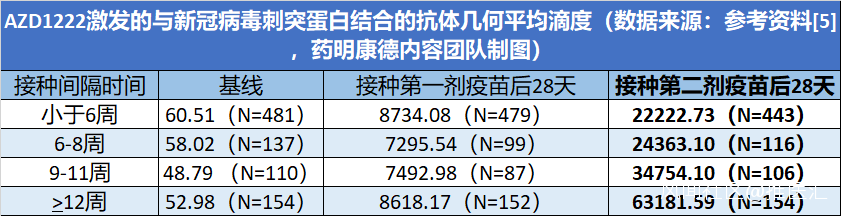 接種兩劑AZD1222疫苗之間的間隔時間越長,接種第二劑疫苗後的刺突蛋白結合抗體水平越高
接種兩劑AZD1222疫苗之間的間隔時間越長,接種第二劑疫苗後的刺突蛋白結合抗體水平越高
雖然目前還沒有確認與刺突蛋白相結合的抗體水平和疫苗保護效力之間的直接關係,而且這些數據的樣本數相對較少。但是這些證據顯示調整AZD1222的接種方案,有可能進一步提高它的保護能力。阿斯利康首席執行官Pascal Soriot先生也在近日的訪談中表示,研究人員可能已經找到了進一步提高這一疫苗保護能力的接種方案。
腺病毒中和抗體對新冠疫苗的影響
腺病毒載體平台是疫苗開發的一個常用平台,目前處於臨牀開發階段的在研新冠疫苗中,有多款疫苗使用這一技術,其中包括康希諾生物公司和楊森(Janssen)公司開發的新冠疫苗。然而,由於表達新冠病毒抗原的腺病毒載體本身也是一種病毒,它們也會激起免疫系統的應答。已有研究表明,人們體內針對腺病毒載體的中和抗體可能削弱基於腺病毒載體的疫苗的效果。有些科學家認為,這可能是導致AZD1222的不同接種方案之間效力差別的原因之一。
為了減少針對腺病毒載體的中和抗體的影響,俄羅斯開發的新冠疫苗Sputnik V使用了兩種不同的腺病毒載體表達新冠病毒刺突蛋白。這一設計可以降低首次接種疫苗時產生的針對腺病毒載體的中和抗體對第二次疫苗接種的影響。日前公佈的3期臨牀試驗結果顯示它的保護效力達到91.4%。阿斯利康也與Sputnik V的開發機構達成合作協議,將啓動臨牀試驗,檢驗將AZD1222與Sputnik V中的不同腺病毒載體聯合使用的防護效果。
其它可能影響疫苗效力的因素包括不同接種程序對T細胞免疫應答,以及免疫記憶生成的影響。
我們期待進一步研究不但能夠找到提高基於腺病毒載體的新冠疫苗保護效力的方法,而且幫助優化腺病毒載體疫苗的設計和開發。
注:本文旨在介紹醫藥健康研究,不是治療方案推薦。如需獲得治療方案指導,請前往正規醫院就診。
參考資料:
[1] Oxford University/AstraZeneca vaccine authorised by UK medicines regulator. Retrieved December 30, 2020, from https://www.gov.uk/government/news/oxford-universityastrazeneca-vaccine-authorised-by-uk-medicines-regulator
[2] AZD1222 Oxford Phase III trials interim analysis results published in The Lancet. Retrieved December 30, 2020, from https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2020/azd1222-oxford-phase-iii-trials-interim-analysis-results-published-in-the-lancet.html
[3] AstraZeneca’s COVID-19 vaccine authorised for emergency supply in the UK. Retrieved December 30, 2020, from https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2020/astrazenecas-covid-19-vaccine-authorised-in-uk.html
[4] Voysey et al, (2020). Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet, DOI:https://doi.org/10.1016/S0140-6736(20)32661-1.
[5] Information_for_UK_healthcare_professionals_on_COVID-19_Vaccine_AstraZeneca. Retrieved December 30, 2020, from https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/948334/Information_for_UK_healthcare_professionals_on_COVID-19_Vaccine_AstraZeneca.pdf
[6] Pascal Soriot interview: ‘Astra Zeneca has winning formula to beat Covid-19. Retrieved December 30, 2020, from https://www.thetimes.co.uk/article/pascal-soriot-interview-astra-zeneca-has-winning-formula-to-beat-covid-19-httk3wzkm