華大基因新冠試劑盒獲美食藥監局“緊急使用”預授權,將臨牀銷售
吕栋宁静致远。
(文/觀察者網 呂棟)國外疫情蔓延之勢仍未得到遏制,A股相關上市公司紛紛籌劃防疫用品出海。
3月18日晚間,華大基因(300676.SZ)發佈公告:其就新型冠狀病毒核酸檢測試劑盒已啓動美國食品藥品監督管理局(下稱:FDA)的EUA申報,目前Pre-EUA已被正式受理。根據美國近期發佈的新冠肺炎相關檢測政策指南,將正式啓動該產品在美國臨牀市場的商業銷售。
不過公告中提到,上述產品未來拓展進度、銷售規模具有不確定性,目前尚無法預測對未來業績影響。
觀察者網注意到,當晚除華大基因外,包括安科生物、科華生物、藍帆醫療、延安必康、科瑞技術、國恩股份、銀寶山新等多家上市公司均透露了產品出口信息,涉及病毒檢測、防護用品、口罩機等。

華大基因公告截圖

公告截圖
華大基因在公告中介紹,根據美國《聯邦食品、藥物和化妝品法案》第564條,在緊急情況下,當現有市場的產品無法滿足需求時,FDA官員可以允許,將未經其審批的醫療產品或現有醫療產品中未審批的新應用,用於診斷、治療、預防威脅到生命的疾病或情況。
通常情況下,緊急使用授權(Emergency Use Authorization,簡稱“EUA”)的申報分為兩個階段,緊急使用預授權(Pre-EUA)和緊急使用授權(EUA),目前華大基因已向FDA遞交Pre-EUA,該申報已於近日獲得受理,尚在審核過程中,後續還需要FDA的進一步反饋與認同,才能獲批EUA。
華大基因表示,根據FDA發佈的《新型冠狀病毒肺炎在公共危機下的診斷檢測政策指南》,其已向FDA報備產品用途等相關信息,並提交銷售意願。FDA已允許其在EUA獲批前,即自2020年3月17日起,在美國臨牀市場銷售其新型冠狀病毒SARS-nCoV-2核酸檢測試劑盒(熒光PRC法)產品。
公告中指出,在緊急情況有效期內,華大基因上述檢測產品符合上述文件所述的商業銷售條件。如果在緊急情況終止後,其仍希望在美國臨牀市場銷售該產品,則需要另行向FDA提交產品註冊申請。
華大基因提到,截至本公告披露日,根據美國FDA官網信息顯示,已有8家國外企業或機構的新型冠狀病毒檢測產品獲得美國FDA的緊急使用授權。
對於上述事項對該公司的影響,華大基因表示,上述產品實際銷售情況會受到海外市場政策環境變化、新冠肺炎疫情防控涉及的檢測需求等因素的影響,未來產品拓展進度、銷售規模具有不確定性,目前尚無法預測對其未來業績的影響,敬請投資者注意投資風險。
3月17日,華大基因曾在深交所互動易平台透露:其新冠病毒核酸檢測試劑盒的累計產能已超100萬人份。
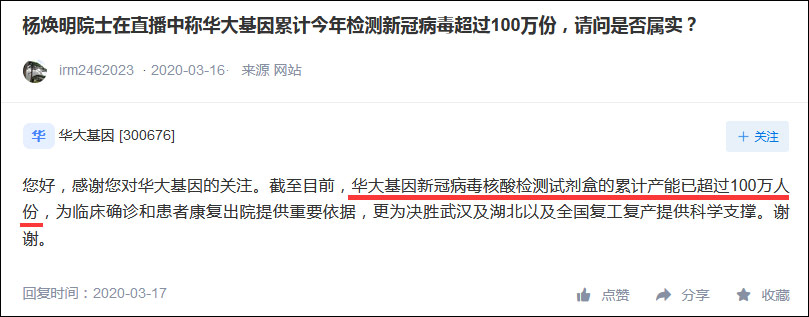
深交所互動易截圖
(編輯:尹哲)
本文系觀察者網獨家稿件,未經授權,不得轉載。