理解COVID-19疫苗的有效性 【譯】_風聞
GHTT-观三教九流人等,骂五湖四海畜生。2021-01-23 18:06
譯者的話:這篇文章是《科學》上的一篇觀點文章,兩位作者都是研究者而非編輯,通篇也沒有任何採訪性質的段落,因此與我之前在此發的科普類翻譯作品不同,其專業性更強,沒有足夠生物學或醫學背景的人請先花足夠的時間去補些基礎知識(包括統計學),以免對其中的內容感到費解甚至產生誤解。這篇文章發表時,輝瑞(Pfizer*)剛剛公佈其三期試驗第一階段的結果,在此之前,沒有人能料到COVID-19疫苗的保護率能如此之高。因此,兩位作者主要時解釋了疫苗和疫苗研究中的一些基本概念和方法,並針對如何根據疫苗的不同特性來規劃疫苗的使用。我全年11月剛讀到這篇文章時,就覺得很好,立刻把它加入了我的翻譯計劃中。雖然因為種種原因拖延至今才成稿,但這並不影響它在當下對我們制定疫苗的分發策略的指導意義。【】內為譯者注。*
作者
Marc Lipsitch1, Natalie E. Dean2
出版信息
Science 13 Nov 2020:
Vol. 370, Issue 6518, pp. 763-765
DOI: 10.1126/science.abe5938
【在所有人羣中,】老年人和有基礎病的人被新冠病毒(COVID-19)感染的風險最高。而一個安全又有效的疫苗將有助於從兩個截然不同的方面保護這些人:直接保護,即接種【疫苗】高風險羣體來【直接】防止他們患病;間接保護,即是通過接種跟高危人羣有接觸的人來減少【疾病的】傳播。“流感疫苗運動”一開始是以老年人為目標【受眾】,為了達成直接保護而【發起的】;但是,在最近已經將重點轉移到了普通人羣身上,部分原因就是為了增加其間接保護。流感疫苗在老年人中所引發的免疫反應要比在年輕的成人中更弱、持續時間更短,所以增加間接保護可能是一種更有效的策略。【現在】還不知道對於COVID-19疫苗來説是否也是如此。
由於意識到COVID-19疫苗可能在【上市】初期數量有限,【人們使用了】基於現實中接觸者分佈規律的“年齡結構”數學模型來探索疫苗分配的最佳方案(1, 2)。但當【疫苗的】供應量大到可以考慮間接保護策略時,該使用哪個模型則將取決於這些疫苗的作用原理和它們在不同人羣中的效果。【那麼,】能夠影響關於COVID-19疫苗的決策的證據能都有哪些呢?
疫苗的三期臨牀試驗,是為了評判【疫苗】對於個體的效果和安全性而設計的。這些試驗普遍將關注點放在了以疾病的病毒學和病理學確認為主的基本試驗結果上【譯者:即primary endpoint,這個術語是我自己翻的,如果有從事相關研究的朋友指導標準的翻譯方法,請告訴我】,以此來掌握疫苗的直接利好,進而幫助決策。臨牀試驗的次要結果【譯者:secondary endpoint】則能提供例如感染數量或病毒的釋放量一類的支持性數據,還能幫助評測疫苗在各分組的效果。儘管如此,一些關於COVID-19疫苗特性的問題很可能會在臨牀試驗完成後依舊有待解答。首先,臨牀試驗一般無法獲得疫苗在各分人羣中的特異有效性,雖然其在高危羣體中的表現將決定直接保護策略的成效。其次,疫苗能否防止感染或降低【病毒的】傳染性?這個問題的答案關係到間接保護能否達成。或許只有擴大現有的研究或開展新的研究,才能提供回答這些問題所需的數據。
隨機對照試驗【譯者:即隨機將參與試驗的個體分為試驗與對照組】可以為估算【疫苗在】各分組的效力提供一些初步的估值,不過這些估值的置信區間將會很大【譯者:可以理解為誤差範圍大】,與其在高危組別中的實際效力【可能】大有出入。【對個分組而言,】基於整個試驗人羣發病數的期中分析的結果,其不準確性可能更高。【舉例來説,】如果參與試驗的高風險人羣【行事】更加小心、受感染的機會更少,那麼他們在【疫苗】效力的估算中的權重【譯者:或貢獻】也會減少,進而可能使這種【估算的】不準確性增加。
有一些策略可以被應用於【疫苗】分組效力的估算問題,【而且】其中一些已經在使用中了。【在臨牀試驗中,】通過設立針對老年人和/或有基礎病的成人的最低參與人數,可以確保高危人羣體【的特性】也能充分體現在試驗的參與者當中。另一項考量則與試驗中為進行期中【或中期】分析而設立的【試驗】終止原則有關。疫苗臨牀試驗早期的期中分析,受分組的不確定性影響很大,因為隨機分組和給參與者接種安慰劑都預計會在【疫苗的】有效性被公佈後終止。在高危人羣中,為了提升【對疫苗的】有效性估計的準確性,【臨牀試驗的】組織者可以堅持,除了研究中的總病例數以外,只有當這些分組中的確診人數也達到了一個目標值後,【試驗】才能開始期中分析。
那些為了評估【疫苗的】長期效力及安全性而在後續研究中保持隨機性的試驗,可能也會產生有關特定年齡組的有效性的更可靠數據。例如,世界衞生組織疫苗合作項目的臨牀試驗將會在跟進試驗中保留安慰劑對照組直到【試驗的】第12個月,或者直到某個有效的疫苗在當地得到普及(3)。然而,依據臨牀試驗的地點、以及疫苗是否能在被緊急授權使用後於試驗人羣中得到充足的供應,讓某些組別的受試人員放棄現成的疫苗,可能是既不道德又不實際的。對於同時在多處開展臨牀試驗的在研疫苗來説,【它們的】宏觀分析可以綜合多地的結果以提升對於特定分組效力估算的準確性。比如説Oxford-AstraZeneca【譯者:即牛津-阿斯利康】的疫苗就在英國、南非、巴西和米國同時開展臨牀試驗。
理想情況下,進行中的三期【臨牀】試驗將會選出不只一個安全、有效的疫苗待批准和使用。【疫苗】獲批後的研究對於繼續評估其有效性將起到十分重要的作用。這些可能包括在個體或社區層面上進行無對照組的隨機試驗,用以對不同的現行疫苗做比較。就像美國國防部的個體隨機試驗“流感疫苗實用評估”(DoD (PAIVED))做的那樣,對三種已獲批的流感疫苗的相對短長做出評價。
另一種能夠大量收集關於特定羣體的【疫苗】有效性證據的手段是獲批後的觀察性研究。這包括對高危人羣——比如説來自療養院一類的設施的人——進行積極的監控,就像【人們】曾在流感【研究】中所做的那樣。這也包括被常規用來衡量疫苗有效性的“檢測-陰性”試驗的設計【譯者:即test-negative,簡單地説就是在檢測後再決定病例是試驗組還是對照組,詳情請看下文及參考文獻】(4)。新冠病毒(SARS-CoV-2)檢測結果為陰性的有症狀個體,作為那些檢測結果為陽性的病例的對照組,然後比較他們的免疫狀態並調整所選取的干擾因子【譯者:統計學術語,請勿按字面意思理解】。“檢測-陰性”設計可以被融入社區門診的檢測之中(5),或者用來估計急診病例中那些針對重大疾病的疫苗的有效性(6)。研究人員可以借鑑正在進行中的流感監控【系統】來快速建立起這些系統。便利的是,這些程序能夠同時監控不只一種疫苗,使得評估它們的相對效力成為可能。
觀察性試驗的最大短板是干擾因子的存在。【除了免疫狀態外,】接種和非接種的人羣可能還有許多其它的不同之處,這些都會造成接種狀態與其結果之間的非因果性相關。雖然這些偏差會影響任何關於疫苗效力的觀察性試驗,但是【我們可以採取】一些手段來發現這些偏差並降低它們的幅度(7, 8)。
關於間接保護的最顯著證據來自那些能完全防止感染的疫苗,因為【它們】能降低【病原的】傳播。而以【參與者】被感染為次要結果的【疫苗】有效性試驗將生成這些數據。這是通過一種能區分由感染誘發的和由疫苗誘發的抗體反應的特殊的檢測【方法】來實現的【譯者:這種方法可能可以給中國在下一階段的入境控制提供借鑑,不過作者在此處沒有給引文】。即使一個疫苗不能完全防止感染,它也能提供間接保護(如圖)。那些能夠降低疾病嚴重程度的疫苗,也能通過降低病毒的釋放量以及/或減少那些能增加病毒傳播的症狀(如咳嗽和打噴嚏)來降低其感染性。一個預想中的最糟情況是有一種可以降低疾病【烈度】、但卻允許病毒釋放的疫苗;它或許不但無法降低【病毒的】傳播,還會因為它對症狀的壓制而增加【其】傳播。
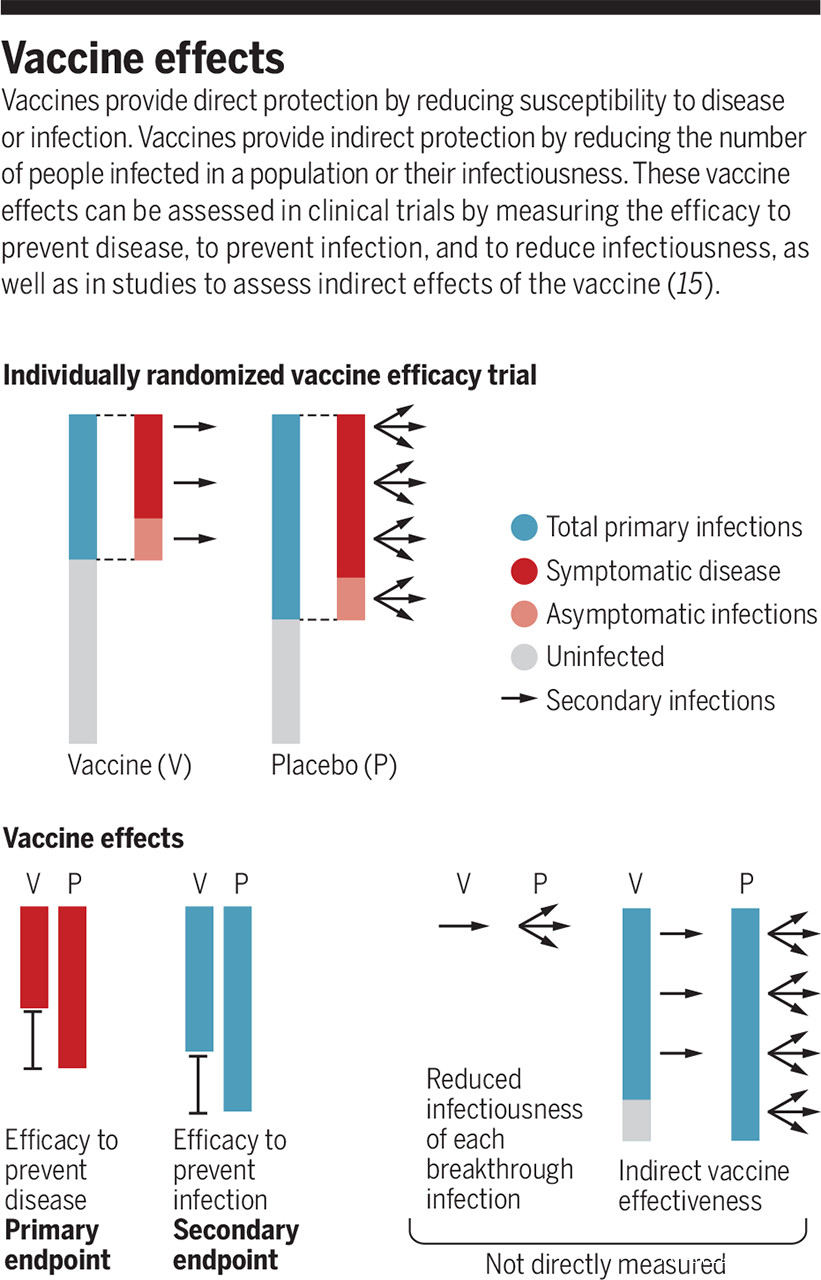
疫苗的效果
藍色:初級感染者總數;正紅:有症狀感染者;淺紅:無症狀感染者;灰色:未感染者;箭頭:次級感染數量
要評估疫苗對於感染性的影響,一些三期試驗通過在試驗室確診的有症狀感染者的家中收集他們的唾液並頻繁進行聚合酶鏈式反應(PCR)檢測,來測算病毒的釋放量和釋放時期的長短。不過,這對掌握無症狀感染者的病毒釋放變化並無任何幫助。況且,血清檢測只能探測到之前【是否】感染而不能協助重建急性感染期的【病毒】釋放【情況】。要想能同時測量有症狀和無症狀患者的病毒含量,就需要無視外在症狀,對參與者們在急性感染期內進行頻繁的(如每週)病毒檢測。牛津-阿斯利康的疫苗試驗在英國會無視【參與者的】症狀,每週都對參與者進行檢測,但是根據其公佈的【試驗】流程來看,在其他地方並非如此。【而且,】就算是每週都檢測也不會【為研究人員】提供關於疫苗對病毒釋放的作用的詳細信息,因為病毒的釋放量和感染性之間的關係仍是未知的;儘管如此,如果病毒的平均釋放量在接種人羣中較小,這種方法很可能仍可以為此提供一些支持。疫苗的人體挑戰研究可以產生關於疫苗對病毒釋放狀況影響的高質量數據(9)。在這種研究中,隨機對照組中的受試者會被刻意地安排接觸病毒。
也存在另一些不通過病毒量來直接估計傳染性的手段。【例如,】附加的家庭研究可以作為【疫苗】有效性試驗的補充。研究者們通過追蹤感染者的家庭成員或其他的密切接觸者來評估某種疫苗對於感染性的影響,就像已被用於呼吸系統疾病百日咳(普魯士熱)的【研究方法】那樣(10)。病毒的【核酸】序列可以在試驗中被用來確定“感染者-被感染者”的對應關係,以及更好地估算【疫苗的】間接【保護】效力(11)。另外一種以獲取【疫苗】間接效力為主的策略是設計一些分組隨機試驗【譯者:注意與“隨機分組試驗”區分】。在流感疫苗的試驗中,在護理中心工作的醫護工作者們被按組別隨機性的給予疫苗,而試驗的測量加過則是其照料的患者的死亡人數、疑似流感症狀的人數或確診感染的人數(12)。
雖然觀察性研究也可能會有用,但總體來看,衡量疫苗的間接【保護】效果要比衡量它們的直接效果更難。所以,當疫苗的稀缺性可能影響其隨機分配時,在各個備選疫苗被批准之前及之後,獲取有關它們對感染性的影響的數據都顯得至關重要。
其它關於快速開發中的COVID-19疫苗的尚未解答的問題還包括:長期的安全性(這説明開始相應的醫藥監管十分迫切),疫苗保護的有效期,不完全接種或低劑量接種時的【疫苗】效力(13),疫苗對重症和因病致死的防護能力,以基礎血清狀態來衡量的保護效力,以及這個病毒通過進化而規避由疫苗所引發的免疫力的潛在可能性。這些問題的答案將有助於我們找到疫苗的最佳使用方法。
因為COVID-19疫苗在初期的供應將會十分有限,所以一些專家組正在探尋【疫苗分配】的優先策略。醫護人員通常都被認為是應優先被接種的人羣,因為只有保住了他們才能維持醫療系統的運轉(14)。緊隨其後的,是為那些最易因病致死或因病入院的人羣提供直接防護:具體來説,就是那些65歲以上或有某些基礎病的人。即使疫苗可能在這些羣體中的有效性較低,這或許依然是降低死亡率的最佳策略(2)。然而,如果某種疫苗不能為高危人羣提供有效防護,卻能降低較年青人羣中的感染人數或感染性,那麼當疫苗供應量足夠大時,間接保護策略或許是個更好的選擇(1, 2)。最糟糕的情形是:有一個可以降低年輕羣體病情、卻無法為高危人羣提供任何直接或間接保護的有效疫苗,這樣就讓那些最脆弱的人時刻承擔着風險。弄清楚疫苗的這些特性對評估各個產品的相對優劣十分重要。幸運的是,我們有很多使用既有和新興技術的備選疫苗正在研發當中。雖然各種疫苗的特性可能不同,但關於它們直接和間接保護【效力】的可靠證據,能夠幫助我們計劃怎樣才能有效地使用這些疫苗。
參考文獻
↵L. Matrajt, J. Eaton, T. Leung, E. R. Brown, medRxiv 10.1101/2020.08.14.20175257 (2020).
↵K. M. Bubar et al., medRxiv 10.1101/2020.09.08.20190629 (2020).
↵P. Krause et al., Lancet 10.1016/s0140-6736(20)31821-3 (2020).
↵H. Chua et al., Epidemiology 31, 43 (2020).
↵Centers for Disease Control and Prevention (CDC), US Flu VE Network (2020); www.cdc.gov/flu/vaccines-work/us-flu-ve-network.htm.
↵Q. Chen et al., J. Infect. Dis. 211, 1045 (2015).
↵M. Lipsitch, A. Jha, L. Simonsen, Int. J. Epidemiol. 45, 2060 (2016).
↵N. E. Dean, M. E. Halloran, I. M. Longini Jr., Am. J. Epidemiol. 10.1093/aje/kwaa084 (2020).
↵S. K. Shah et al., Science 368, 832 (2020).
↵M. E. Halloran et al., J. Am. Stat. Assoc. 98, 38 (2003).
↵R. Kahn et al., medRxiv 10.1101/2020.09.14.20193789 (2020).
↵W. F. Carman et al., Lancet 355, 93 (2000).
↵S. Riley, J. T. Wu, G. M. Leung, PLOS Med. 4, e218 (2007).
↵National Academies of Sciences, Engineering, Medicine, “Framework for equitable allocation of COVID-19 vaccine” (Consensus Study Report, The National Academies Press, Washington, DC, 2020).
↵M. E. Halloran, I. M. Longini Jr., C. J. Struchiner, Design and Analysis of Vaccine Studies (Springer, 2010).
鳴謝: M .L. receives funding from cooperative agreement 1U01CA261277 from the U.S. National Institutes of Health. N.E.D. receives funding from NIH/NIAID R01-AI139761. We thank R. Venkayya and N. Grassly for helpful comments. M.L. receives honoraria and consulting fees from Merck, Affinivax, Sanofi Pasteur, and Antigen Discovery; receives research funding (institutional) from Pfizer; and provides unpaid scientific advice to Janssen, Astra-Zeneca, and Covaxx (United Biomedical).
原文鏈接:
https://science.sciencemag.org/content/370/6518/763.full