康弘藥業明星藥海外試驗緣何“一夜夢碎”?_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2021-04-16 08:26
是疫情影響,是決斷滯後,還是……
撰文 | 燕小六 韋曉寧
在中國上市近8年、承載了國產原研藥榮光的康柏西普眼用注射液,“出海”之路一夜夢碎。
今年2月,康弘藥業發佈公告稱,海外臨牀試驗進展一切正常。4月9日晚,康弘藥業發佈《關於停止康柏西普眼用注射液全球多中心臨牀試驗的公告》,稱公司經過慎重研究,決定停止康柏西普眼用注射液全球PANDA臨牀試驗。
受此影響,康弘藥業4月12-14日連續3個交易日出現一字跌停,市值蒸發超70億。15日繼續下跌8%,成交量顯著放大。
突然叫停背後
作為康弘藥業唯一一個生物製品,康柏西普眼用注射液(商品名:朗沐,以下簡稱康柏西普)的履歷耀眼。
這是一種重組人血管內皮生長因子(VEGF)受體和人免疫球蛋白Fc段基因重組的融合蛋白注射液。康弘藥業稱之為“自主研發的原創1類生物新藥”。
2012年,其英文通用名“Conbercept”,成為首個獲得世界衞生組織(WHO)非專利藥物名(INN)的國產藥物。《財新》2019年報道稱此為“全球承認”。
截至2020年12月4日,康弘藥業為康柏西普“出海”已累計投入13.11億元;被停止的全球PANDA試驗中期評議顯示,由國內外頂級眼底病專家組成的PANDA試驗科學指導委員會認為康柏西普表現出良好的安全性——既然如此,緣何突然停止試驗?
對此,上述《公告》稱,PANDA試驗科學指導委員會認為,PANDA試驗未能達到預期目標,建議停止。原因可歸納為以下幾點:
第一,已經揭盲的階段性分析表明,全球公共衞生事件對研究的影響大大超過公司預期,包括各國不斷出台的各種管控措施等因素使得大量受試者脱落、失訪、超窗,完全符合PANDA試驗給藥方案的病例已逐步降低到不足入組病例的40%。
第二,國際航運和出行限制的阻礙,使得需要全程冷鏈配送的試驗藥品的質量控制以及需要去醫院現場臨牀監查和稽查,都變得格外艱難。
第三,在高達68個試驗中心,有一半以上的受試者視力在注射後較基線變化等於甚至低於零,這與試驗藥物既往的臨牀研究以及真實世界大量的使用經驗有很大差異。(簡言之,注射康柏西普後,有一半以上患者的症狀沒有改善,甚至加重。)
相較於康弘藥業此前表態,《公告》留下一些待解的疑惑。比如,康弘藥業於2020年9月30日發佈《成都康弘藥業集團股份有限公司關於子公司康柏西普眼用注射液臨牀試驗項目進展的公告》稱:“本次臨牀試驗項目進展順利。研究主要目標是明確0.5mg或1.0mg康柏西普是否非劣效於2.0mg阿柏西普,主要終點是受試眼第36周ETDRS BCVA字符數得分較基線的平均變化。截至2020年9月25日,已完成全部受試者的第36周主要終點訪視。”
這意味着,在當時,PANDA研究主要臨牀終點數據基本完備。時隔6個多月,《公告》卻給出相反的結論。
“這可能有幾方面原因。比如,申辦人是否及時瞭解到臨牀試驗真相,對突發事故是否有恢復計劃,如BCP(商業可持續發展計劃),以應對最壞情況。”北京經緯傳奇醫藥科技有限公司創始人蔡緒柳告訴“醫學界”。該司專門從事臨牀試驗第三方稽查、審計。
蔡緒柳稱,國內藥企開展海外臨牀試驗,一般都會外包給全球性或當地的新藥研發合同外包服務機構(Contract Research Organization,CRO)。這類公司更熟悉當地的政策法規和風土人情,掌握大量資源和專業人才。它們通過合同形式,向“申辦人”製藥企業提供新藥臨牀研究服務。
蔡緒柳認為,臨牀研究有其特殊性,有時因倫理、數據管理、隱私保護、盲態等,存在信息不透明或溝通不及時等情況。若申辦人缺少項目質量管理和供應商管理經驗,就會出現信息滯後等。
“從網上披露信息看,康柏西普研究停止,受疫情影響較多。疫情對於受試者的用藥、檢查、觀察都會產生影響。用藥跟不上會導致水腫復發,甚至喪失視力,這樣的結果一定是申辦人不願意看到的。CRO公司應該能及時真實地瞭解這些‘方案違背’情況,並如實彙報給申辦人。從資本市場看,申辦人需要及時公開哪些臨牀試驗信息,行業關於這一塊的約束是缺失的。”蔡緒柳表示,這或導致針對整個投資市場的信息發佈延遲。
同濟大學附屬東方醫院眼科主任崔紅平對“醫學界”表示,藥物臨牀研究停止,也可能是分組或時間問題。“有的時候,對照組未達到入組人數,研究就沒有做下去的意義了。同時,每一個臨牀試驗都有時間限制。新冠疫情不解除,研究無法按期完成,也可能要終止。”
對於康柏西普此次出海受阻,神州細胞海內外商務合作負責人來延鯤告訴《證券日報》:“在海外各國疫情複雜的大環境下,各種醫院臨牀條件惡劣,入組病人是否為新冠感染者,是否影響試驗結果,不得而知。另外,此次PANDA試驗由國外CRO公司運營,若海外CRO配合並不好,其中的操作細節如冷鏈運輸温度監控等也完全可能導致最終結果的失敗。”
出海:勢在必行
2013年11月,康柏西普獲得國家食品藥品監督管理總局批准的新藥證書與藥品註冊批件,適應症為濕性年齡相關性黃斑變性(wAMD)。康弘藥業形容這是填補國產眼底黃斑變性治療藥物的市場空白。
2017年,它首次被納入國家醫保目錄,定價為5550元(10mg/ml,0.2ml/支)。同年5月,獲批新增適應症“繼發於病理性近視(PM)的脈絡膜新生血管(pmCNV)引起的視力下降”。
2019年,它通過談判續約國家醫保,醫保支付標準降至4160元(0.2ml/支)。同年獲批“糖尿病性黃斑水腫(DME)引起的視力損害”“脈絡膜新生血管(CNV)導致的視力損害”兩項新適應症。在2020年的國家醫保談判中,康柏西普繼續以4160元(0.2ml/支)的價格,續約至2021年底。
此外,康柏西普在全球範圍內擁有38項授權發明專利(在歐美日韓等地區均擁有多項專利)。2020年,該藥還收到蒙古國衞生部簽發的《藥品註冊證書》。
4月11日,康弘藥業董事長柯尊洪等多位公司高管在電話會議披露,康柏西普上市至今,臨牀使用經驗超過150萬次。
多年來,康弘藥業一直在謀劃康柏西普“出海”。
黃斑是眼底視網膜的重要區域,衰老、糖尿病等會致其損傷。世界衞生組織(WHO)發佈《世界視覺報告(2020)》指出,全球估計有1.96億人患有老年性黃斑變性。在中早期老年性黃斑變性者中,有15%-20%會發展成為wAMD,並致視力喪失。隨着老齡化加劇,這部分人羣數量會進一步擴大。
同時,糖尿病致黃斑水腫、造成視力下降,已成為急需解決的公共衞生問題。
無論是人口老齡化還是糖尿病發病率增加,都造成治療需求增多。立鼎產業研究網數據顯示,抗VEGF藥物是眼科存量市場規模最大的眼科用藥。目前,國內抗VEGF藥物除康柏西普,還有拜耳的阿柏西普和諾華的雷珠單抗。
崔紅平告訴“醫學界”,上述藥物都用過,康柏西普的臨牀效果並不比其他藥物差。一般會根據病人病情,選擇藥物。“患者對不同藥物的敏感性存在差異。中國醫生就康柏西普發過很多文章,大家對它的療效還都是肯定的。”
2019年,阿柏西普全球銷售金額約79.79億美元,雷珠單抗全球銷售金額約39.24億美元。康柏西普同年的銷售金額為11.55億元,佔康弘藥業主營業務收入35.46%。2020年前三季度,康柏西普銷售額7.65億元,同比下滑13.16%。
與此同時,萬得(Wind)數據表明,2018年、2019年及2020年上半年,康弘藥業非中國地區的銷售金額分別為39.75萬元、124.48萬元和195.21萬元,與其整體營收規模不在一個量級。
一邊是國內市場有所縮小,一邊是海外市場大有可為。康弘藥業副總裁殷勁羣曾公開表示,希望在國際市場複製康柏西普在中國市場的勝利,“或許也能為國外患者帶來降價的福音。”
根據康弘藥業公告,其全資子公司成都康弘生物科技有限公司於2016年9月30日,取得美國食品和藥物管理局(FDA)關於准許康柏西普眼用注射液在美國開展wAMDⅢ期臨牀試驗的通知。有媒體報道,截至當時,這是國內首個自主研發,並在美國直接獲批開展Ⅲ期臨牀試驗的生物新藥。
2018年5月,一項“全球多中心、雙盲、隨機、劑量範圍試驗,評估康柏西普眼用注射液治療新生血管性年齡相關性黃斑變性患者的療效和安全性”Ⅲ期臨牀試驗項目(以下簡稱PANDA試驗)啓動。PANDA研究包括兩個獨立、相似的試驗。每個試驗計劃入組1140名受試者,以1:1:1的比例分組接受0.5mg康柏西普、1.0mg康柏西普和2.0mg阿柏西普。
由於康柏西普和阿柏西普的靶點均為VEGF-A、VEGF-B以及PLGF,兩組獨立試驗都使用阿柏西普作為陽性對照藥。這稱為“頭對頭”研究,即以臨牀上已經使用的治療藥物或治療方法作為對照的臨牀試驗。《財新》此前採訪、引用康弘藥業方解讀稱:“我們進行頭對頭,就是要直面對跨國巨頭的競爭。”
《證券日報》報道,截至2019年底,PANDA試驗獲得批准超過30餘個國家/地區的臨牀註冊申請,超過300餘家臨牀試驗中心的啓動工作相繼完成,1.63萬支樣品按時運輸至全球中心庫房供全球患者治療使用,100%的受試者完成入組。
按研究設計,康柏西普原預計於2020年11月底,完成所有受試者的96周訪視。這是現有臨牀方案規定的受試者參與試驗的終點。核心治療期數據預計在2021年3月獲得。
來自海外的挑戰
在“出海”路上,康弘藥業下了血本。“健識局”報道,早年,康弘藥業投入15億元,在北京建立康柏西普歐美標準生產基地。2019年康弘藥業研發投入增至7.88億元,增幅達126%,主要就是為推進康柏西普的全球臨牀試驗。
2020年上半年,研發投入還在增加。同年12月,康弘藥業發佈定增方案,擬募集資金34.72億元,其中近26億元都將用於康柏西普相關適應症的Ⅲ期臨牀試驗及註冊上市。
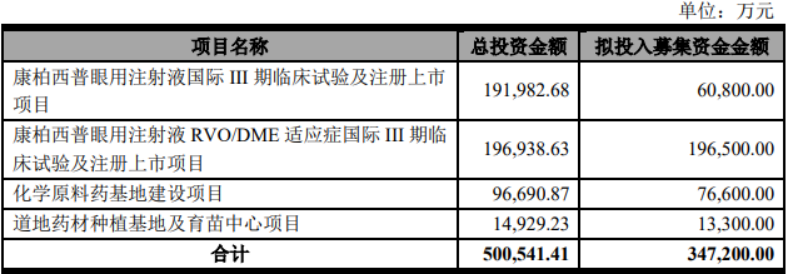
康弘藥業擬定增募投項目
就在2021年2月,康弘藥業對外宣稱:海外臨牀試驗進展正常。
然而,3月28日晚間,康弘藥業發佈公告,稱法國ANSM(法國國家藥品與健康產品安全局)暫停康柏西普在該國的臨牀試驗項目。原定於3月底披露的PANDA研究中期數據揭盲和評估將延至4月中旬。康弘藥業於3月30日在投資者互動平台回覆,法國臨牀試驗項目僅涉及40多個受試者,在總體受試者人數中佔比較小。
幾天後,《關於停止康柏西普眼用注射液全球多中心臨牀試驗的公告》發佈,形勢發生顛覆性變化。
但上述《公告》稱,康柏西普在試驗中表現出良好的安全性,在亞裔人羣的亞組分析中,1mg康柏西普每3個月注射1次的劑量組療效表現,可能優於整體。這和近年來,康柏西普在國內外核心期刊發文結果基本一致。2014年Ophthalmology雜誌發佈AURORA試驗,和2019年《美國眼科學雜誌》發表PHOENIX Ⅲ期臨牀試驗,證實康柏西普治療濕性AMD安全性和有效性。
蔡緒柳認為,不同人種、生活習慣及合併使用其他藥物等,都可能影響藥物療效和安全性評價。這在其他新藥臨牀研究中確實出現過。
過往研究也發現抗VEGF療法“挑人”。2019年,重慶第三軍醫大學第一附屬醫院全軍眼科中心主任陰正勤接受《財新》採訪指出,約有2/3左右的病人對抗VEGF療法不應答,即藥物無法起效。多國都在研發包括幹細胞治療在內的其他治療方法,如英國、日本、中國等,都在進行對於抗VEGF不應答的濕性黃斑變性的幹細胞治療研究。
崔紅平提醒,康柏西普做海外臨牀研究,是因為要打開國際市場。海外研究停止,這涉及到各國不一的新藥臨牀研究標準。“要進美國,就要按照美國要求做一次;進歐盟,就要按照歐盟要求重新做試驗。國外藥物進入中國,也是這個流程。”
“康柏西普對國內藥物開展海外臨牀試驗,是一個很重要的提醒。它告訴我們,申辦人的質量管理和供應商管理能力是影響臨牀研究項目進程的一大挑戰。”蔡緒柳説。
資料來源:
1.解藥|糖尿病致盲特效藥競爭白熱化 中國生物藥佈局國際市場. 財新
2.康弘藥業明星藥試驗叫停風波:實控人宣佈增持仍跌停. 財新
3.The Phase 3 Clinical Trial of Conbercept for Exudative AMD. Retinal Physician
4.俞德超走了,房健民走了,康柏西普卻走不動了. 健識局
5.成都康弘藥業集團股份有限公司關於子公司康柏西普眼用注射液臨牀試驗項目進展的公告. 成都康弘藥業集團股份有限公司董事會. 公告編號:2020-083. 2020年9月30日
6.糖尿病黃斑水腫患病率調查及相關因素分析. 上海交通大學學報(醫學版). 2012, 32(2):160-.
7.世界視覺報告. 世界衞生組織. 2020年. 許可協議:CC BY-NC-SA 3.0 IGO
8.康弘藥業核心品種康柏西普全球試驗被停止,有這三大疑問待解. 界面新聞
9.International Nonproprietary Names for Pharmaceutical Substances (INN). WHO Drug Information. Vol. 26, No. 1, 2012
10.重慶啤酒乙肝疫苗夢碎四週年. 財新
11.AURORA study group. Safety and efficacy of conbercept in neovascular age-relatedmacular degeneration: results from a 12-month randomized phase 2 study: AURORA study. Ophthalmology. 2014;121(9):1740-1747
12.PHOENIX study group. Conbercept for treatment of neovascular age-relatedmacular degeneration: Results of the Randomized phase 3 PHOENIX study. Am J Ophthalmol. 2019;197:156-167
13.康柏西普“出海”之路受阻 康弘藥業董事長柯尊洪堅信終會重回正軌. 證券日報
14.成都康弘藥業集團股份有限公司關於停止康柏西普眼用注射液全球多中心臨牀試驗的公告. 成都康弘藥業集團股份有限公司董事會. 公告編號:2021-023. 2021年4月9日