Cell子刊:利用高度多重的ddPCR方法更好地檢測患者體內的HIV病毒庫_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2021-04-27 15:47
定量確定具有複製能力的HIV病毒庫對於評估治療策略至關重要。病毒生長試驗(viral outgrowth assay, VOA)低估了HIV病毒庫,因為它未能誘導所有具有複製能力的HIV前病毒(provirus,即病毒基因組整合進宿主細胞DNA的HIV)。針對HIV單個區域或兩個區域的HIV DNA測試(分別稱為單重測試和雙重測試)高估了HIV病毒庫,因為這些測試方法未能排除許多有缺陷的HIV前病毒。
基於PCR的測試方法是高度靈敏的,相比於VOA而言需要更少的血液。但是,在PCR測試方法中,人們通常針對單個保守性的靶點進行檢測,這會極大地過高估計具有複製能力的HIV 病毒庫的大小,這是因為大多數整合到宿主細胞DNA中的HIV前病毒都是缺陷性的,而且針對單靶點的PCR測試並不區分完整的HIV前病毒和具有DNA缺失和/或功能失活突變的HIV前病毒。可靠地估計遺傳上完整的HIV前病毒需要驗證HIV基因組上的多個區域的存在,以及所檢測每個區域上的靶序列是否來自相同的HIV前病毒。
微滴式數字PCR(ddPCR)提供了一種替代性選擇。在ddPCR中,PCR反應液(包括模板DNA)被分割成數千個單獨的液滴,每個液滴的PCR檢測結果分別報告。2019年報道的一種ddPCR測定方案利用了此類多重方法,在每個液滴內探測HIV-1基因組的兩個區域。
在一項新的研究中,美國研究人員使用兩種針對HIV基因組的3個區域(三重)的ddPCR測定方法(下稱測定方法1和測定方法2)來開發一種5區域測試方法(這兩種三重ddPCR測定各自針對兩個獨特的HIV基因組區域,但共同針對1個重疊區域,從而允許批間質量控制)。通過結合這兩種平行的三重ddPCR測定方法,這些作者有信心對真正完整的HIV-1病毒基因組進行定量確定。作為進一步的改進,他們優化了其中的一種特異性定量確定T細胞的多重ddPCR測定方法,以便準確地將定量確定的數量與待研究的HIV靶細胞的數量進行正常化。這個額外的步驟對於組織活檢特別有用,因為與血液相比,組織中的細胞羣體難以分離和純化。相關研究結果發表在2021年4月20日的Cell Reports Medicine期刊上,論文標題為“A highly multiplexed droplet digital PCR assay to measure the intact HIV-1 proviral reservoir”。

具體而言,測定方法1的三個HIV靶點位於HIV pol基因的3’端、tat基因和env基因,而測定方法2的三個HIV靶點位於長末端重複序列(LTR)/gag區域、pol基因的5’端和env。每種測定方法中,針對每個HIV靶點設計特異性的引物和探針。在每種測定方法的三個HIV靶點中,有兩個使用相同的染料進行探針檢測,但濃度不同,以便能夠在熒光振幅的X/Y圖上區分不同的HIV靶點。這使得這些作者能夠對含有不同靶點組合的液滴進行定量確定。針對env的引物和探針在測定方法1和測定方法2中是相同的,在201個臨牀樣本中,這兩種測定方法的env性能幾乎相同。此外,在這些臨牀樣本中,五對引物/探針檢測靶點的失敗率極低:gag 0.5%;3’ pol 1%;env 3.1%(兩種測定方法均如此);tat 3.6%;5’ pol 6.3%。
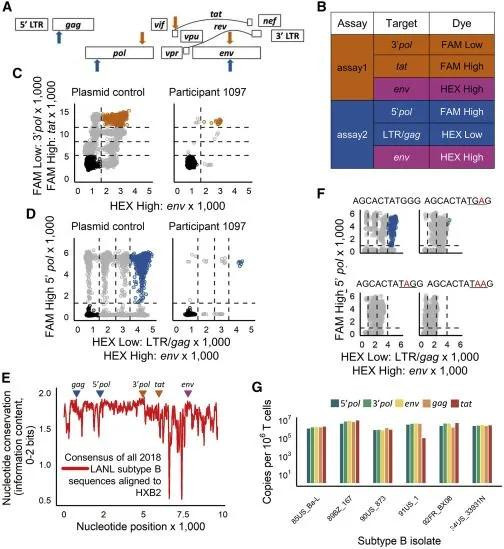
兩種HIV-1三重ddPCR測定方法的設計,圖片來自Cell Reports Medicine, 2021, doi:10.1016/j.xcrm.2021.100243。
這些作者利用這種5區域測試方法評估了含有這5個區域的HIV前病毒的數量。他們評估的HIV前病毒數量平均比配對的定量VOA方法高12.1倍並且與後者相關(Spearman’s ρ = 0.48),但是他們以此估計的HIV病毒庫要比之前的DNA測定方法顯著減少。
這些作者將他們的測試方法使用於來自接受抗逆轉錄病毒藥物(ART)治療的HIV感染者的縱向血液樣本和粘膜樣本。在這些患者中,完整的HIV前病毒在血液CD4+T細胞中的衰減速度快於有缺陷的HIV前病毒,而且完整的HIV前病毒在粘膜T細胞和循環T細胞中的頻率相似。
參考資料:
Claire N. Levy et al. A highly multiplexed droplet digital PCR assay to measure the intact HIV-1 proviral reservoir. Cell Reports Medicine, 2021, doi:10.1016/j.xcrm.2021.100243.