從脂肪肝到肝硬化、肝癌有多遠?還要警惕哪些健康問題?_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2021-04-29 11:57
過去40年來,非酒精性脂肪肝病(NAFLD,俗稱“脂肪肝”)已經成為全球最常見的慢性肝病,中國人羣中NAFLD患病率也高於25%。儘管NAFLD起病隱匿,但最終可能發展為肝硬化甚至肝細胞癌。在NAFLD患者中識別出風險最高的人羣是一項關鍵挑戰,而認識到疾病進展的多樣性及其影響因素,也有助於更好指導患者的診療。
近日,《柳葉刀》發表NAFLD綜述文章,詳述了NAFLD的流行病學、疾病自然史、以及現有診療手段和管理理念的最新發展。在今天的內容中,我們結合這篇綜述,重點介紹NAFLD在各階段的發展和疾病進展的危險因素,以及部分診療要點。

截圖來源:The Lancet
NAFLD的發病
綜述指出,NAFLD的主要病因是營養過剩,這會導致異常脂肪積累。在這種情況下會形成促胰島素抵抗的促炎狀態,進而導致異常脂解作用,新脂質生成不斷增加,而脂肪酸向肝臟的傳遞並未減慢,久而久之,肝臟代謝能力將不堪重負。脂質代謝失衡會導致細胞應激、炎症小體激活和凋亡細胞死亡,以及隨後的炎症刺激、組織再生和纖維生成。
NAFLD的致病機制受到多種代謝,遺傳和微生物組相關因素的影響。比如遺傳差異可影響約20%-70%的疾病風險,PNPLA3基因是與NAFLD易感性相關的最明確遺傳變異。這些遺傳變異也可能還會影響NAFLD的疾病,如冠狀動脈疾病、肥胖。還有研究表明,NAFLD患者的腸道菌羣組成發生變化。
病情惡化普遍多快、風險多高?
需要明確的是,NAFLD包括一系列疾病過程:從非酒精性單純性肝脂肪變(NAFL),可發展為非酒精性脂肪性肝炎(NASH),逐漸引起肝纖維化,最終可能發展為肝硬化、肝功能衰竭甚至肝癌。
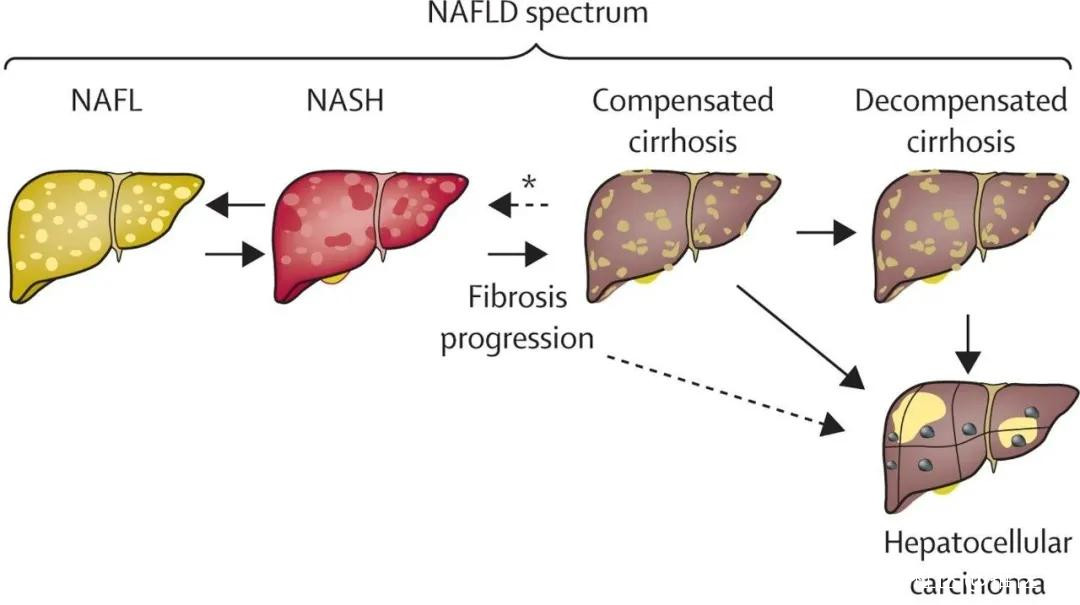
▲NAFLD的疾病譜:NAFL – NASH - 代償期肝硬化 - 失代償期肝硬化。NASH和肝硬化可進展為肝細胞癌。*纖維化消退。(圖片來源:參考資料[1])
配對肝活檢樣本的研究為疾病進展率提供了重要數據。儘管在NAFL或NASH階段都可能發生纖維化,但在NASH患者中纖維化進展的速度更快,這很可能是由壞死性炎症(necroinflammation)驅動的。對配對肝活檢樣本研究的Meta分析表明,對於NASH患者,平均7.1年纖維化分期會加重一個等級(從0期[無纖維化]逐漸發展到4期[肝硬化]);而對於NAFL患者,纖維化分期每加重一步平均需要14.3年。
NAFLD的自然發展過程是可逆的,從NAFL到NASH到代償期肝硬化的這三個疾病階段,以及纖維化進展程度,都可以發生雙向變化。
儘管如此,纖維化,尤其是晚期纖維化(3-4期),將是肝臟相關結局惡化和總死亡率升高的關鍵預後指標。一項包含4428例NAFLD患者的薈萃分析顯示,4期纖維化(肝硬化)患者的全因死亡率是無纖維化患者的3.42倍,肝臟相關死亡率是前者11.13倍。
從代償期肝硬化發展為失代償期疾病(例如出現腹水、肝性腦病或胃食管靜脈曲張破裂出血),並伴有門脈高壓或肝功能衰竭,這一進展過程的年發生率約為3%-4%。
肝硬化也是肝細胞癌發展的最強危險因素。NASH肝硬化患者每年肝細胞癌發病率為10.6例/1000人-年。而在沒有肝硬化的情況下,肝細胞癌的總體風險非常低,發生率為0.08例/1000人-年。
圖片來源:123RF
需要注意的是,NAFLD患者在幾十年後、甚至肝硬化發展之後才得到診斷並不少見。除非患者有門脈高壓的證據(例如脾腫大和血小板減少症)或出現肝相關併發症,否則通常難以識別出NAFLD。此外,NASH和纖維化通常有着共同的發展趨勢,但在肝硬化階段,脂肪變性或HASH特有的特徵將不再明顯。因此,大多數隱源性肝硬化(指原因不明的肝硬化)患者,如果合併有代謝疾病、又無其他已知肝病的,可能實際也患有NASH,只是臨牀特徵不再明顯。
由於患病率高,NAFLD已經成為終末期肝病的第二大主要原因。在美國等待肝移植的成年人中,NAFLD也是第二大最常見的原發性肝癌病因。在歐洲,NAFLD現在佔每年移植病因的8.4%。疾病自然史和模型研究同樣表明,由於NAFLD而患有晚期肝病和肝細胞癌等不良結局,不僅患者總數在增加,NAFLD這一病因在所有這些疾病中的佔比也在增加。
加快病情發展的危險因素
在大多數患者中,肝臟疾病是穩定或緩慢進展的,不會很快導致肝硬化或肝臟相關死亡。然而,一小部分患者會發展為晚期肝纖維化,並有可能發展為晚期肝病和肝細胞癌。不同患者的疾病進展速度和臨牀結局各不相同,這可能是由於驅動疾病發展的因素不同。
比如,合併疾病會加速病情進展。文章特別指出,2型糖尿病與晚期纖維化、肝硬化相關併發症和肝病死亡風險增加兩倍以上有關。肥胖(BMI > 30 kg/m2),血脂異常(HDL-C偏低、甘油三酯偏高)和高血壓,也與嚴重肝病的風險增加相關,儘管影響程度小於2型糖尿病。此外,胰島素抵抗、垂體機能減退也是危險因素。60歲以上NAFLD患者也比年輕患者患晚期纖維化的風險更高。
從生活習慣來看,攝入果糖、膽固醇、酒精也會促進疾病進展,鍛鍊和咖啡則有保護作用。此外,一些基因也會影響疾病發展,PNPLA3基因與NAFLD嚴重程度、肝細胞癌的發展以及死亡率有關。
但NAFLD患者的主要死因還不是肝病
儘管NAFLD患者面臨着進行性肝病的風險,但值得注意的另一點是,NAFLD患者的主要死亡原因是心血管疾病,其次是肝外惡性腫瘤(如結直腸癌或乳腺癌)。
儘管目前尚不清楚NAFLD在多大程度上直接影響心血管疾病的發展,但NAFLD和心血管疾病共有一些心臟代謝危險因素,這些因素可能會導致死亡。比如,NAFLD與某些代謝疾病(尤其是2型糖尿病和高血壓)之間存在雙向關聯。
與普通人羣相比,NAFLD患者發生癌症的風險高1.9倍,特別是肝癌、胃腸道腫瘤和子宮癌。其背後的生物學機制,可能NAFLD與內臟肥胖和慢性低度炎症存在關聯。
圖片來源:123RF
病情評估和診療
合適的評估有助於更好管理患者風險。
目前,臨牀最常用腹部超聲檢查來診斷NAFLD,但腹部超聲對輕度脂肪變性敏感性較低,晚期纖維化也會影響觀察所見。通常,肝活檢是組織學檢查脂肪變性、炎症、肝纖維化程度並診斷NASH的“金標準”,但因其有創,並不適合廣泛應用。
現有非侵入性檢測包括:
纖維化評分模型:NAFLD纖維化評分(NFS),Fibrosis-4(FIB-4)指數等。血液生物標誌物:增強型肝纖維化(ELF)評分已在多項橫截面研究和臨牀試驗中進行了測試,Pro-C3也已用於早期臨牀試驗。基於超聲的彈性成像來評估肝硬度:瞬時彈性成像已得到廣泛評估和應用。綜合評分:FAST評分和NIS4模型。
在診療方面,目前尚無獲批的NASH治療方法,文章強調,NASH的管理應採用整體方法,力求將心血管疾病風險降至最低,並減少脂肪變性和全身性炎症的危險因素。在基礎代謝疾病控制的同時,健康生活方式和減輕體重對於預防和治療NAFLD至關重要。
體重減輕超過5%–7%,可以減少肝臟脂肪含量、減輕脂肪性肝炎;體重減輕超過10%時,大部分人甚至都可以減少纖維化,無論採用何種減肥方法。而且,體重減輕還可改善NAFLD及其所有相關的心臟代謝合併疾病,從而有助於預防心血管和惡性腫瘤的風險。
而對於未患病人羣,改善飲食、堅持鍛鍊同樣能夠降低NAFLD的患病風險,即便在高遺傳風險的人羣中也是如此。
參考資料
[1] Elizabeth E Powell, et al., (2021). Non-alcoholic fatty liver disease. The Lancet, DOI: https://doi.org/10.1016/S0140-6736(20)32511-3
[2] 非酒精性脂肪性肝病防治指南(2018 更新版)