前有魏則西、後有張煜醫生舉報,細胞免疫療法五年遭遇三重羅生門_風聞
果壳硬科技-果壳旗下硬科技内容品牌2021-04-30 12:25
在癌症患者遭遇人財兩空的悲劇中,“治療方法”往往是眾矢之的。
5年前,魏則西接受細胞免疫治療(DC-DIK療法,樹突狀細胞和細胞因子活化殺傷細胞聯合回輸),救治無果去世;今年4月,“北醫三院腫瘤內科醫生反映腫瘤治療黑幕”事件中,患者馬進倉接受的NK療法也遭到質疑。
引發公共輿論事件的這兩起醫療糾紛,有着耐人尋味的相似之處——惹禍的DC-DIK和NK,都屬於“細胞免疫療法”。某種程度上,正是它們讓魏則西和馬進倉踏入了同一條河流。
細胞免疫療法,全稱“被動性細胞免疫治療”。方法是:從血液或腫瘤中分離出免疫細胞,體外培養(或通過基因工程改造,使免疫細胞表達腫瘤特異性受體),再輸回患者體內,以期實現緩解乃至治癒的目的[1]。目前,有多種免疫細胞可供使用,如自然殺傷細胞(NK細胞)、淋巴因子活化殺傷細胞(LAK細胞)、細胞毒性T細胞(CTL細胞)、樹突狀細胞(DC細胞)等。
但並非所有細胞免疫療法都不靠譜。以CAR-T為例,就已有產品獲FDA批准上市,且這類療法大概率會在今年內落地中國。
如果沒有魏則西事件,CAR-T進入中國的步伐也許會更快一些……
艾馬殊 | 作者
一萌、普通醬 | 編輯
放大燈團隊 |策劃

生命的奇蹟,都已明碼標價
2010年5月,年僅5歲的小女孩艾米莉·懷特黑德(Emily Whitehead)被診斷出患有急性淋巴細胞白血病。2012年4月,艾米莉前往美國費城兒童醫院(CHO),成為了首個接受CAR-T療法的兒童患者。
經過治療,艾米莉恢復了健康,並生活至今[2]。需要指出的是,CAR-T療法並非一勞永逸,艾米莉也在接受CHO長期的隨訪和監測。
CAR-T,即嵌合抗原受體T細胞免疫療法(Chimeric Antigen Receptor T-Cell Immunotherapy)——通過採集患者外周血並提取T細胞,將T細胞在體外進行改造,令其識別腫瘤細胞表面的抗原。然後把這些細胞回輸給病人,進而識別並殺死腫瘤細胞。
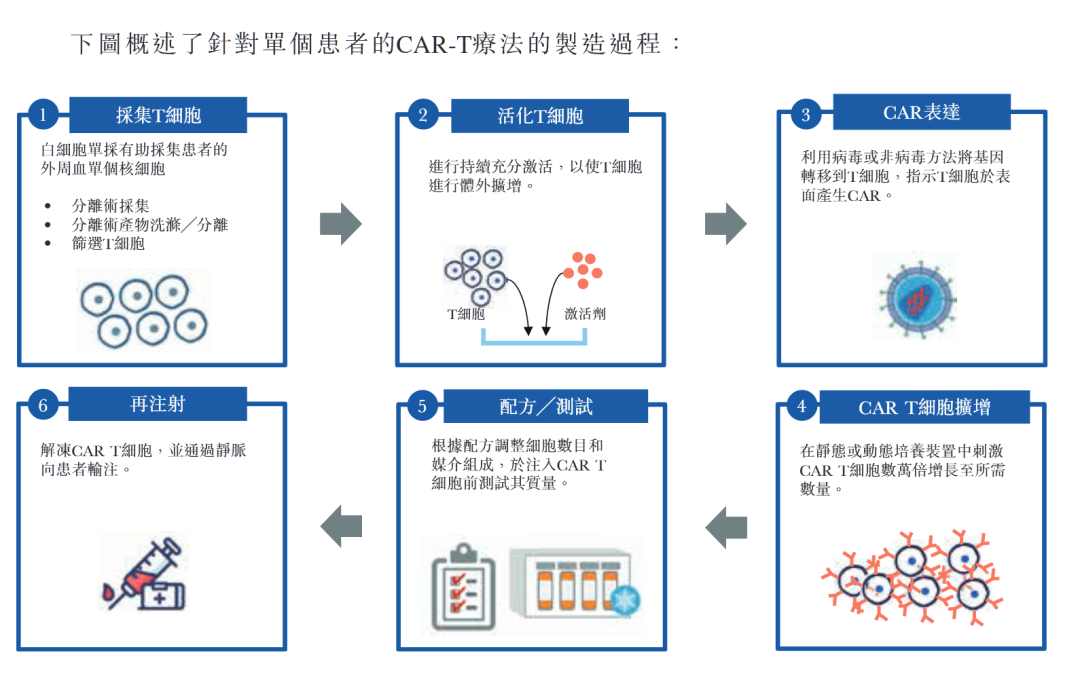
CAR-T治療過程示意圖 來源 | 藥明巨諾招股書
圍繞CAR-T,全球範圍內的科研機構和創新藥企展開了大量研究和合作。在國外,諾華(Novartis)、凱特製藥(Kite Pharma)、朱諾醫療(Juno Therapeutics)等企業的研發進度比較領先。
在研發競賽中奪得頭籌的是諾華—2017年8月,諾華的CAR-T療法Kymriah獲批上市,用於治療25歲以下患者的B細胞急性淋巴細胞白血病(ALL)。
Kymriah的治療效果幾何?
經獨立中心審查評估的數據顯示,在63例可評價療效的患者中,Kymriah的療法總體緩解率為82.5%,包括63%的完全緩解患者和19%的完全緩解但血液系統不完全恢復患者[3]。
奇蹟不會平白髮生。生存的希望,也被標上了昂貴的價格。
Kymriah需要量身定做,且治療流程複雜,定價高達47.5萬美元;比它晚一個半月上市的另一款CAR-T療法——凱特製藥的Yescarta,定價也高達37.3萬美元。
在CAR-T研發競賽中,中國企業跑得並不慢。
為了將CAR-T引進中國,早在2016年2月,藥明康德和朱諾就成立了合資公司藥明巨諾;2017年4月,復星醫藥也與凱特製藥合資成立公司復星凱特。
但對中國的企業們來説,CAR-T落地還需漫長的等待。這與魏則西事件,又有密不可分的關係。

一放就亂
DC-CIK療法在國外早已淘汰,但它能堂而皇之地用在魏則西身上,一部分原因,要歸咎於當時混亂無序的行業。

中國醫藥教育協會製藥技術專業委員會常務委員劉雙生就曾表示,三類醫療技術的應用需要備案,但當時根本沒有有效的監管。“就是報一個備案,幾個人過來看一下。達不達到標準,他也沒有水平(判斷)。到後期實施時,也沒有飛行檢查的約束。”當時,建幾個小實驗室,就可以開始開展三類醫療技術的應用[4]。
在2009年到2015年這個時期,很多小型醫院不經過行政部門准入審批,就在開展細胞免疫治療。細胞免疫治療成了當時一些民營醫療企業的“搖錢樹”和虛假醫療廣告的重災區。
澎湃新聞的調查發現,細胞免疫治療多采取“前店後廠”模式——免疫細胞治療企業與醫院合作,企業負責細胞培養工作,前期診斷、抽血,後期回輸等工作則由醫院完成。魏則西就診的北京武警二院腫瘤生物中心,就是由莆田系實際控制的康新公司以承包入股方式,與院方展開合作[5]。
細胞免疫療法是不是應按藥品進行監管?衞生部門內部意見不一。但在實際操作中,細胞免疫療法一直按照“第三類醫療技術”進行管理。
這意味着,與“藥品”(轉由食藥監局進行管理)相比,細胞免疫治療規範流程如何進行、細胞如何製備、治療風險如何控制等行業標準一直未能建立。

一管就死
魏則西去世後,監管部門迅速對細胞免疫治療行業開展整頓。
2016年5月4日,當時的國家衞生計生委召開會議,提出了一系列監管要求。這些要求包括禁止醫療機構出租科室、發佈虛假醫療廣告等。同時明確,自體細胞免疫治療技術僅限於臨牀研究。

2016年5月4日,國家衞生計生委召開規範醫療機構科室管理和醫療技術管理工作電視電話會議
野蠻生長了多年的細胞免疫治療行業,被緊急按下暫停鍵。
以深圳為例,衞計委緊急規範一年後,深圳80%的細胞免疫相關企業關門。剩下的20%進行了至少一半的裁員,技術人員約九成流失到其它行業[5]。
一方面,細胞免疫行業受到重創;另一方面,公眾也因此對免疫療法持負面態度。對於細胞免疫療法,人們多少有了些“謀財害命”的印象。而在一些專家看來,就此否定所有細胞免疫療法,並不可取。
2017年,時任清華大學醫學院院長、免疫學研究所所長董晨就在一場採訪中表示,把DC-CIK療法等同於免疫療法並不準確,否定所有免疫療法是一葉障目[6]。在這場採訪裏,董晨也提到了CAR-T:“現在這個技術方興未艾,在白血病治療中有顯著療效。”

他們治癒了癌症,我們呢?
在中國,由於魏則西事件的影響,國內細胞免疫治療行業遭遇“政策冷凍”。
直到2017年10月23日,“解凍”開始。原食品藥品監管總局就《藥品註冊管理辦法》修訂稿徵求意見,擬將細胞治療產品列入藥品進行審批[7]。接下來的兩個月裏,《治療用生物製品註冊受理審查指南(試行)》和《細胞治療產品研究與評價技術指導原則》陸續發佈。細胞免疫治療管理基本實現了由“醫療技術”向“藥品”的過渡。
政策步入正軌,影響立竿見影。
這一年的12月11日,傳奇生物提交的 CAR-T(CXSL1700201)臨牀申請獲得 CDE承辦受理,成為首個獲受理的國產CAR-T。自此,國內公司開始了CAR-T療法臨牀試驗的競賽。
2017年以後,細胞免疫治療領域的管理、審查政策及技術標準逐漸出台。

到了2021年1月12日,復星凱特的CAR-T療法益基利侖賽注射液在中國的上市申請變更為“在審批”。雖然2月18日這一狀態又變更為“排隊待審評”,需補充臨牀及藥學資料,但業內普遍認為,中國首款CAR-T療法上市已近在眼前。
而此時(2021年2月),全球已經有四款CAR-T療法獲FDA批准上市了。

注:2021年了3月26日,FDA又批准了CAR-T療法Abecma上市。目前,全球共五款CAR-T上市。

千億中國市場
CAR-T一旦在中國落地,對於患者來説,最關心的莫過於價格。
就國外幾款療法而言,患者負擔在37.5萬~47.5萬美元。高昂的價格並沒有阻止這些孤兒藥的市場增長。根據諾華和吉利德的財報,短短几年間,CAR-T產品的年銷售額已超10億美元。
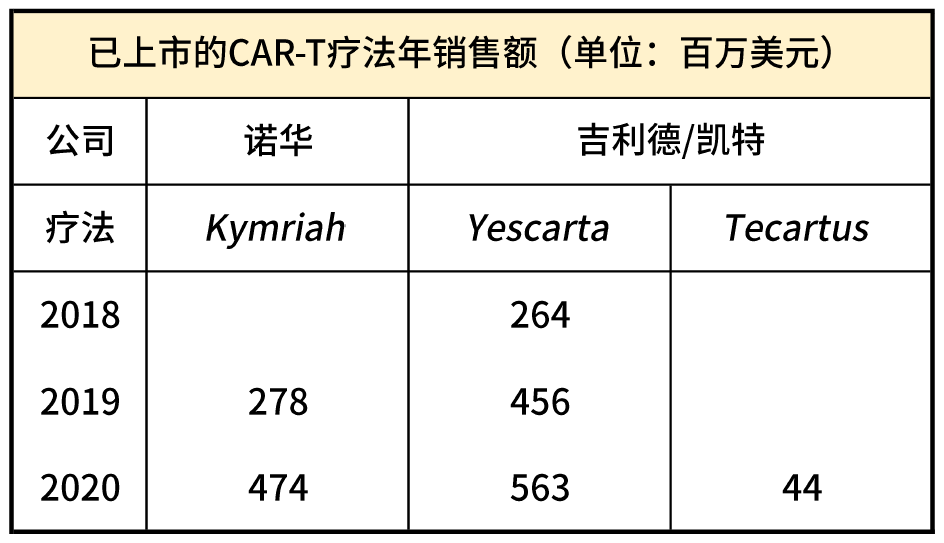
三款CAR-T療法年銷售額。放大燈團隊丨整理
有觀點認為,CAR-T進入中國,定價會低於美國市場,但治療費用仍將高達百萬人民幣左右[8]。高昂的治療費會熄滅大家對於CAR-T療法的熱情嗎?
也不一定。
諮詢機構Frost Sullivan測算,隨着CAR-T在中國審批上市,到2026年,中國CAR-T市場的規模就可達到107億。從2021~2030這十年間,整個市場累計規模可達千億之巨。
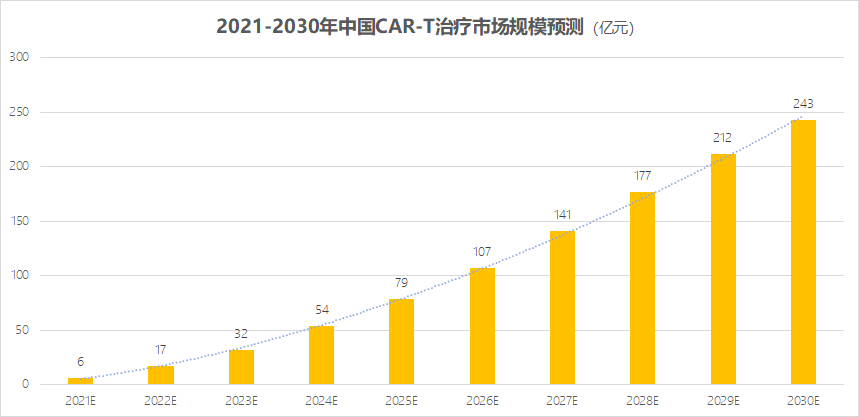
數據來源:Frost Sullivan 放大燈團隊製圖
廣闊的市場自然也吸引到眾多企業入局。丁香園Insight的數據顯示,國內申請及進入臨牀試驗階段的CAR-T療法,已有40餘個。
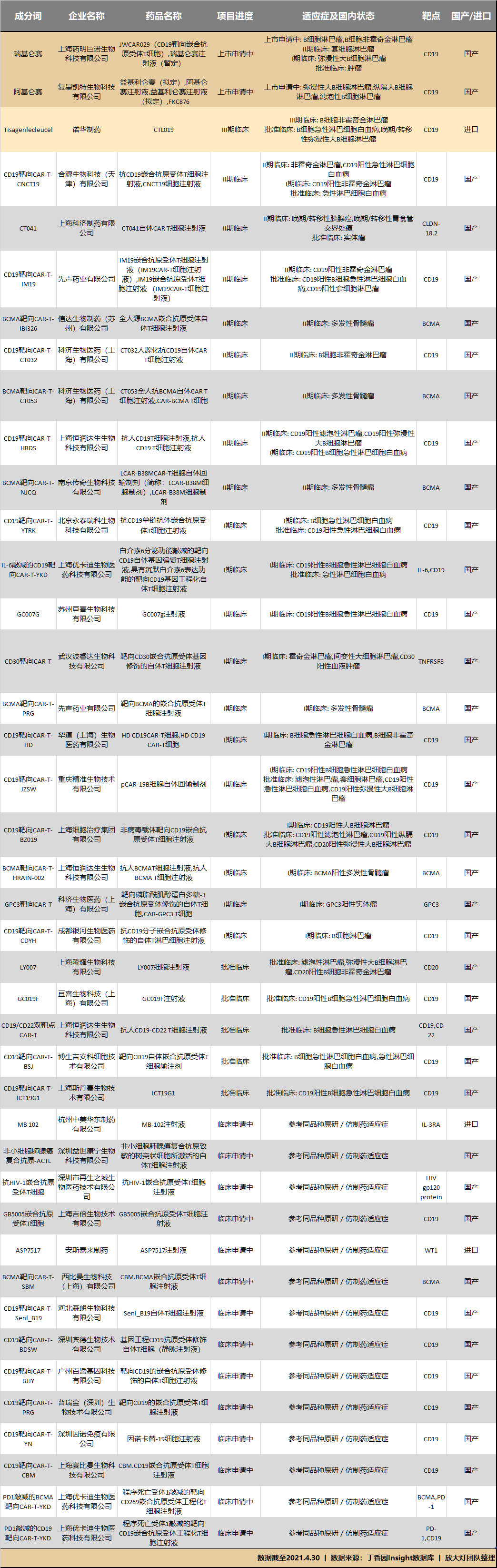
(上下滑動查看,數據截至2021年4月30日)
這是每個創新藥物都要走的路:海外過審、面對熱門療法的跟風研發、在中國市場的艱難審批……CAR-T從FDA審批到中國有望上市,用時近四年。這也許是創新藥行業可以接受的速度,但對很多患者來説,卻成了永遠的遺憾。
用得好,免疫療法是救命天使;但醫生用得不對症、監管混亂反而會讓它成為魔鬼。這是細胞免疫療法五年來遭遇的三重羅生門。

References:
[1] 默沙東診療手冊(專業版)
https://www.msdmanuals.cn/professional/hematology-and-oncology/tumor-immunology/immunotherapy-of-cancer?query=%E7%99%8C%E7%97%87%E7%9A%84%E5%85%8D%E7%96%AB%E7%96%97%E6%B3%95
[2] 艾米莉·懷特黑德基金會官網
https://emilywhiteheadfoundation.org/our-journey/
[3] FDA批准KYMRIAH療法上市的公告
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-tisagenlecleucel-b-cell-all-and-tocilizumab-cytokine-release-syndrome
[4] 劉雙生:“細胞治療產品監管政策趨勢與合規性探討”.千聊APP.2021.3.3
https://m.qlchat.com/wechat/page/topic-simple-video?topicId=2000013390565239
[5] 王文秋:業界談癌症免疫治療“被剎車”:冷一冷是好事,行業需自律.澎湃新聞.2017.4.12
https://www.thepaper.cn/newsDetail_forward_1656302
[6] 免疫療法治療腫瘤到底靠不靠譜?權威專家解讀.人民網-人民日報.2017.02.25
http://health.people.com.cn/n1/2017/0225/c14739-29106956.html
[7] 食品藥品監管總局公開徵求《藥品註冊管理辦法(修訂稿)》意見
http://www.gov.cn/xinwen/2017-10/24/content_5233992.htm
[8] 梁振:「治癒」癌症需百萬,中國首個 CAR-T 藥物或將上市.微信公眾號“偶爾治癒”.2021.02.26
https://mp.weixin.qq.com/s/os_NRZKCnFBl3dY3gpCYfg