腫瘤免疫療法首次成功已有9年,現在進展到哪裏了?丨摸象記_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-05-12 13:40

免疫療法到底能不能治癒癌症?曾經,一次成功的CAR-T療法被載入史冊,輝煌耀目,給人類來帶無限希望。科研人員、臨牀醫生、商業資本、媒體和病人紛紛捲入開發癌症免疫療法的洪流,投入癌症治療的巨大市場,到現在也沒有止歇。
但截至目前,CAR-T療法的應用還侷限於部分血液瘤的應用,要將“前景”實現半分,都是千難萬險。這一過程需要科學界的自淨,而自淨,需要時間。
撰文 | 菜菜
這兩天,人們在為一位曾經患過癌症的小姑娘慶祝她無癌生存九年的紀念日(圖1)。

這位小姑娘叫做Emily Whitehead,她的名字和她的抗癌故事,在腫瘤學史冊和癌症研究教科書裏,是應該要有一頁之地的。

這是一種在兒童中最常見的白血病,治癒率高達85-90%,但是那另外10-15%的難治、易復發患者的病情就比較棘手,存活率很低。
而Emily小姑娘患上的B-ALL白血病,就是難治的這一種。她在經過化療、骨髓移植以後仍然白血病復發,到了無藥可救的階段。
當時,費城醫院剛剛啓動了一種叫做“CAR-T”的腫瘤療法的臨牀試驗,而Emily,則幸運地成為了世界上第一個接受這種試驗療法的患者。

這種療法,需要把病人自身免疫系統的T細胞提取出來,經過體外培養和改造,給T細胞裝備上能特異性識別並攻擊癌細胞的特殊分子,再把改造過後的T細胞注射回病人身體,由這些T細胞針對癌細胞的免疫反應來消滅癌細胞。
因為T細胞是具有攻擊性的免疫細胞,當它們識別、判斷某個細胞是“敵人”,就會向對方發動攻擊。
這大概是怎麼樣的一副情景呢?
圖2是一個小鼠實驗的例子[1],其中,白色的癌細胞是“敵人”,而紅色的和綠色的細胞,則是兩羣不同的T細胞:紅色的那一羣T細胞,能夠識別癌細胞“敵人”,而綠色的那一羣,不能識別,看不出誰是“敵人”。
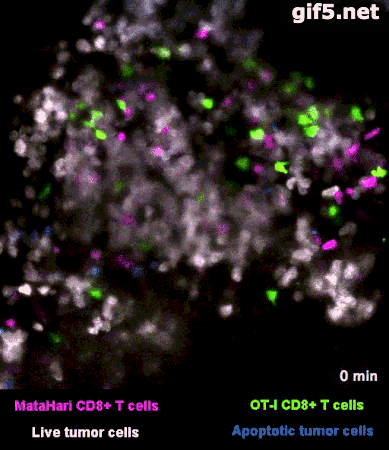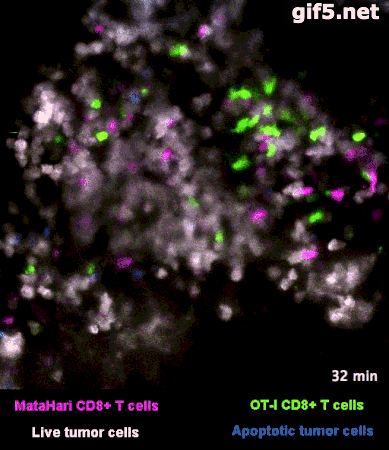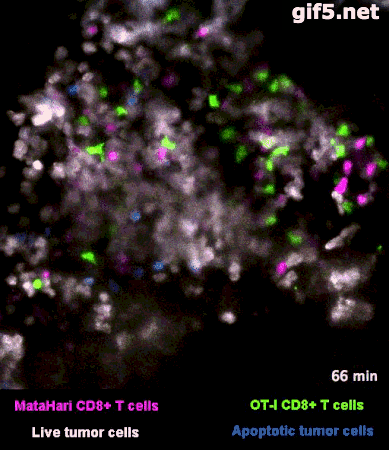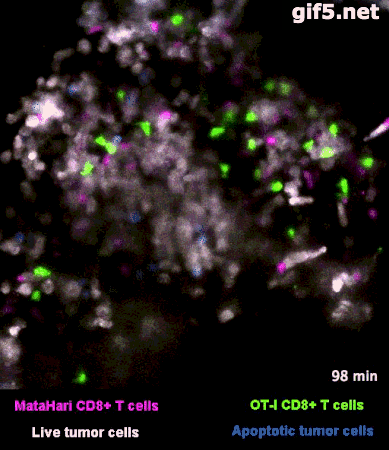
所以你看那些紅的綠的T細胞們在成團的癌細胞中來去穿梭,只有紅色的T細胞能夠起到殺傷作用——當紅色的T細胞在白色的癌細胞表面停留、一番撕扯之後,白色的癌細胞“壞人”就被幹掉了,釋放出淺藍色的死亡信號。
圖2裏能看到星星點點的藍色,就是癌細胞正在死亡的標誌,在圖3的圈圈裏,還能看得更仔細一些。
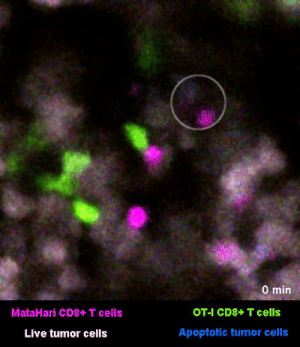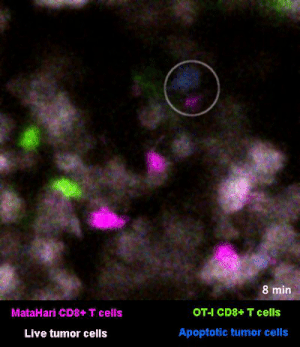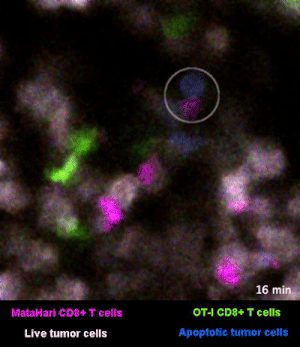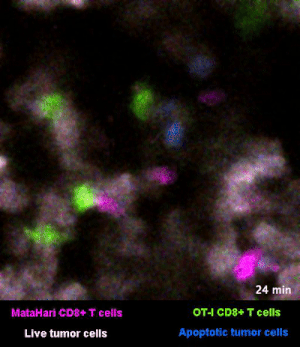
而綠色的T細胞呢,因為認不出“敵人”呀,就只是徒勞地跑來跑去。
CAR-T療法的關鍵之一,就是要給患者本人的T細胞裝備上能夠特異識別癌細胞的分子,就像是特殊的“敵人”探測器。被改造以後的T細胞,在人體內四處遊走,一旦探測器接收到來自“敵人”癌細胞表面的特異信號,就會激活T細胞,發動攻擊,把帶信號的細胞“敵人”消滅掉。
圖4是一次CAR-T細胞在小鼠體內殺滅癌細胞的戰況實錄[2]。
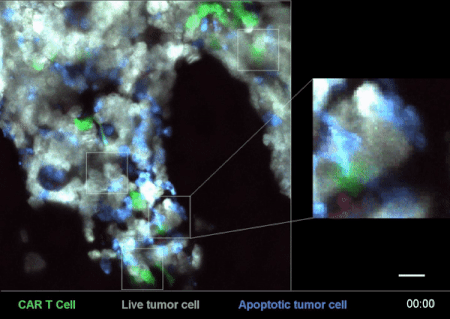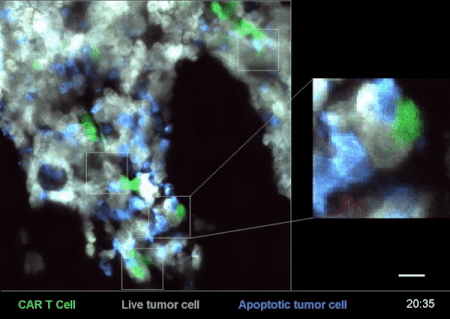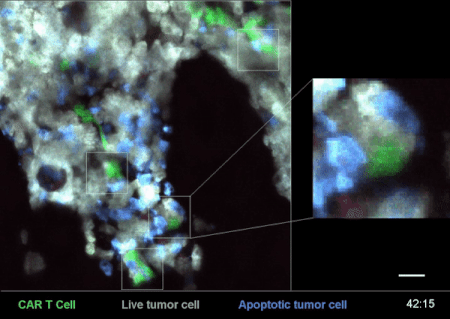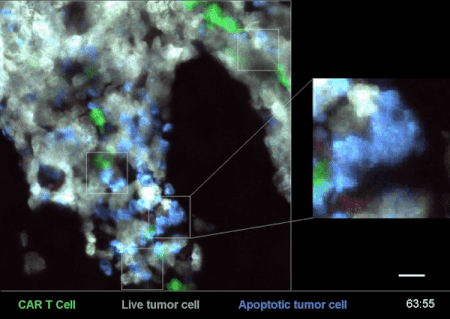
其中,白色的是急性B淋巴細胞白血病(B-ALL)癌細胞“敵人”,綠色的就是經過改造、具備識別這些“敵人”能力的CAR-T細胞了——這些細胞,就是用來治療腫瘤、殺滅癌細胞的“藥”。
從圖4右邊的放大部分,可以清楚地看到一個綠色的CAR-T細胞在白色的癌細胞上逗留、撕扯了一會,白色的癌細胞就迅速地釋放了藍色的死亡信號,可謂“藥到病除”。
而腫瘤小殺手CAR-T細胞,在得手以後,又迅速離開這個被殲滅的“敵人”,奔着下一個“敵人”去了。(詳見《顯微鏡下看免疫細胞和癌細胞鬥智鬥勇 | 摸象記》)
CAR-T細胞的殺傷力很強吧?
正是因為這些小衞兵們的殺傷力真的很強,在給它們裝備“敵人”識別器的時候,必須要非常非常小心,因為癌細胞畢竟是由好細胞變來的,如果識別器不是特別特別精準,T細胞小衞兵們也對着好細胞亂殺一氣,殺敵八百自傷三千,那可就麻煩了……
目前,CAR-T療法在部分血液瘤中取得了成功,已經獲得FDA批准用於治療兒童急性淋巴細胞白血病和成人的淋巴瘤。

由於她的複發性B-ALL符合CAR-T療法臨牀實驗的入組條件,Emily成為了第一個接受這種療法的兒童,她的T細胞被醫療團隊提取出來,經過改造之後,輸回到她的體內。
剛開始還一切正常,但是,四天以後,Emily就開始發低燒,又過了一天,她開始發高燒,被送入ICU密切觀察,又迅速地出現血壓驟降和肺積水的症狀,不得不上呼吸機採取機械通氣[3]。
Emily的身體狀況急轉直下,負責CAR-T療法的醫療團隊措手不及,通過緊急驗血,發現在Emily血液中,有一個叫做白細胞介素6(interleukin 6, IL-6)的炎症因子,表達水平變得超級高,高達正常水平的1000倍,是一場相當驚人且致命的炎症因子風暴了[4]。
由於T細胞並不產生白細胞介素6,醫療團隊當初完全沒有預料到這場天外飛仙的危局,可以説是毫無準備,Emily也一度命懸一線。
幸好,有一個主治醫生Carl June,他的女兒患有類風濕關節炎,需要定期注射一種叫做tocilizumab(託珠單抗)的藥——託珠單抗,是一個人源化單克隆抗體,通過靶向白細胞介素6在細胞表面的受體蛋白(IL-6R)來抑制這個炎症因子在細胞裏引起的一系列活性,從而抑制相關的免疫反應,被FDA批准用於治療活動性類風濕關節炎,後來又被批准用於多關節青少年特發性關節炎、系統性青少年特發性關節炎等免疫疾病——所以Carl June醫生剛好知道有這麼一種藥能夠抑制白細胞介素6的活性!
另一件幸運的事是當時他們醫院裏正好有託珠單抗,能立刻找來給Emily用上(否則就需要多等兩天)。
據説Emily的症狀幾乎是立刻得到了緩解,血壓和呼吸也逐漸恢復了正常——託珠單抗救了Emily的命,也救了CAR-T療法——Emily從這場中活了下來,她的白血病被治好了,而CAR-T療法旗開得勝、取得了成功!
隨着Emily小姑娘的故事被媒體廣泛報道,CAR-T療法也走到聚光燈下。當年幾家製藥公司為了搶頭籌,戰得如火如荼,吃瓜羣眾看得好不熱鬧!後來是諾華的Kymriah搶先一步,於2017年8月成為首個獲得FDA批准上市的CAR-T療法。而Kite公司的Yescarta則緊隨其後,於2017年10月獲批。
到2021年五月,Emily小姑娘已經16歲了,無癌生活九年,有一個以自己名字命名的基金會,專門為腫瘤研究治療募款[5]。

通過小鼠研究,科學家發現,可能是因為CAR-T細胞能夠直接或間接地激活體內的巨噬細胞(另一類免疫細胞),巨噬細胞又導致了炎症因子的大量釋放[6-8]。
倘若不是Carl June他們及時找到託珠單抗、從炎症因子風暴中救回了Emily,CAR-T這個試驗療法,可能會要經歷很多波折呢。
託珠單抗也在2017年8月,被FDA批准用於治療CAR-T療法引起的炎症因子風暴。

哈佛醫學院Dana-Farber癌症中心的CAR-T療法,大概是這樣的流程,僅供參考[9]:
1、評估:患者要接受一系列測試和篩查,以確定CAR-T細胞療法是否合適該患者。
2、採集T細胞:通過單採血液分離術採集患者自己的T細胞(從體內抽血,收集血液中的T細胞,剩餘的血液重新輸回患者體內)。
3、改造T細胞:把患者的T細胞送到實驗室進行基因工程處理,給T細胞們裝備上能特異性識別癌細胞的嵌合抗原受體(也就是簡稱CAR 的Chimeric Antigen Receptor)。
4、讓改造後的T細胞進行擴增:在實驗室中培養這些被改造好的CAR-T細胞,讓它們擴增到數百萬個。這個過程可能需要幾個星期,然後,擴增出來的CAR-T細胞會被冷凍,並送往正在治療患者的醫院或中心。
5、調理療法:患者可能會在接受CAR-T細胞之前接受化療,來幫助免疫系統留出空間給即將輸入的CAR-T細胞們。
6、CAR-T細胞輸回患者體內:這是一個類似於輸血的過程,是一次性的輸液。之後患者可能會住院幾周來監測療效、身體狀況和副作用。
7、恢復:恢復期大約是2-3個月,以評估療效和副作用——在此期間需要重新住院治療併發症的情況並不少見,因此醫院要求患者在輸入CAR-T細胞以後的30天內住在離醫院不超過兩小時車程的區域內,並且要有護理人員陪伴,以隨時監測是否出現發燒、感染、神經系統疾病的徵兆。

對那些無藥可救的病人來説,確實有了通過CAR-T得以生存的機會。
曾經有人總結了多個CAR-T臨牀試驗的結果,在369例治療中,僅有79例復發,對於難治的復發白血病來説,這是很高的成功率了[10]。
而那些經過CAR-T治療後復發的病例,有很多都是因為癌細胞做出了自我調整,不再表達能被T細胞識別的特殊“敵人”信號,從而逃脱被消滅的命運,導致白血病捲土重來。
——癌細胞通過這種方式來產生對CAR-T的抗藥性,與其他癌細胞對某些靶向藥物產生抗藥性的方式,就還蠻像的。
還有少數的例子,是在患者的T細胞通過抽血被提取出去、在體外培養和改造的同時,有零星的白血病胚細胞也混在其中(哪怕只有一個)[10],和T細胞一起接受了改造,掩蓋了表面的“敵人”信號,不會被CAR-T細胞識別,從而逃脱了攻擊,再經過不斷自我複製,從星星之火變成燎原。
所以,現在已經很嚴格了的CAR-T製造技術,還是需要不斷改進,在體外培養改造的T細胞中要避免癌細胞的污染,以及避免隨後可能會產生的抗藥性。

被改造的T細胞其實無法分析對手究竟是不是癌細胞,只能分得清有沒有信號:有信號就幹掉它,沒信號就放開它。
設想一下,如果正常細胞也攜帶着這個信號分子,T細胞就會不分青紅皂白地發動攻擊,直至全軍覆沒、不死不休,從而帶來很大的毒副作用。
因此,這個信號分子的特異性就非常關鍵。
但是由於癌細胞都是從正常細胞經過複雜的癌變過程才產生的,對於人體來説,癌細胞屬於“自己”的一部分,而不是“敵人”,所以,實際上,想要找到僅僅存在於癌細胞表面、而不存在於正常細胞表面的“敵人”信號分子,其實是很難的。
目前,CAR-T療法在臨牀上取得的成功,大都是在由B細胞發展成的腫瘤中,比如B-ALL、B-cell non-Hodgkin lymphoma (NHL)、Diffuse large B-cell lymphoma(DLBL),以及B-ALL。這是因為,被現有技術改造過的T細胞,能特異地識別B細胞表面抗原CD19,從而把病人體內所有的B細胞,不管是癌還是正常,都判斷成為“敵人”,一股腦兒全都消滅掉。
一個人,即使沒有了正常的B細胞,還是可以活下去的,問題不大。
要是沒有了正常的神經細胞、血管細胞、皮膚細胞……就比較痛苦了,這也是CAR-T在部分血液瘤裏取得成功、但在實體瘤裏尚未獲得關鍵突破的原因之一。
能否把CAR-T療法的應用拓寬、用來對付實體瘤呢?這就還需要很多很多的研究工作了。

CAR-T療法的成功,讓越來越多人看到了免疫療法的前景。而人體的免疫系統,又實在是博大精深,除了T細胞以外,還有其它種類的免疫細胞們,具有潛在的攻擊能力,比如NK細胞、巨噬細胞等等。
這些領域,現在也都有很多人在研究利用它們來對付癌症,能好怎——能用嗎?好用嗎?怎麼用?前景是光明的,道路是崎嶇的,讓我們拭目以待吧。
只是,大潮之下,難免泥沙俱起。
比如Nature曾經在2018年9月發表過的這篇文章[11],做的是熱度正高的CAR-T/實體瘤問題,蹭熱度蹭得確實好,不但發表在Nature上,還得到了Nature和NEJM的評論、推薦,一時風光不已。
結果很快就被發現大量重複使用數據,被撤稿了,變成一樁醜聞。

不過,科學界的自淨作用,常常也需要一定的時間才能發揮出來。在那之前,讀文獻需謹慎,看新聞要辨別。
參考文獻
[1] Milo, I., Bedora-Faure, M., Garcia, Z., Thibaut, R., Périé, L., Shakhar, G., … & Bousso, P. (2018). The immune system profoundly restricts intratumor genetic heterogeneity. Science immunology, 3(29).
[2] Cazaux, M., Grandjean, C. L., Lemaître, F., Garcia, Z., Beck, R. J., Milo, I., … & Bousso, P. (2019). Single-cell imaging of CAR T cell activity in vivo reveals extensive functional and anatomical heterogeneity. Journal of Experimental Medicine, 216(5), 1038-1049.
[6] Rooney, C., & Sauer, T. (2018). Modeling cytokine release syndrome. Nature medicine, 24(6), 705-706.
[7] Giavridis, T., van der Stegen, S. J., Eyquem, J., Hamieh, M., Piersigilli, A., & Sadelain, M. (2018). CAR T cell–induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade. Nature medicine, 24(6), 731-738.
[8] Norelli, M., Camisa, B., Barbiera, G., Falcone, L., Purevdorj, A., Genua, M., … & Bondanza, A. (2018). Monocyte-derived IL-1 and IL-6 are differentially required for cytokine-release syndrome and neurotoxicity due to CAR T cells. Nature medicine, 24(6), 739-748.
[10] Ruella, M., Xu, J., Barrett, D. M., Fraietta, J. A., Reich, T. J., Ambrose, D. E., … & Melenhorst, J. J. (2018). Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell. Nature medicine, 24(10), 1499-1503.
[11] Samaha, H., Pignata, A., Fousek, K., Ren, J., Lam, F. W., Stossi, F., … & Ahmed, N. (2018). A homing system targets therapeutic T cells to brain cancer. Nature, 561(7723), 331-337.
資料來源
[1] Milo, I., Bedora-Faure, M., Garcia, Z., Thibaut, R., Périé, L., Shakhar, G., … & Bousso, P. (2018). The immune system profoundly restricts intratumor genetic heterogeneity. Science immunology, 3(29).
[3] https://www.ascopost.com/issues/january-25-2018/against-all-odds/
[4] https://www.thedailybeast.com/todays-aggressive-anti-cancer-therapies-wouldnt-exist-without-jesse-gelsinger
[5] https://emilywhiteheadfoundation.org/
[9] https://www.dana-farber.org/cellular-therapies-program/car-t-cell-therapy/faq-about-car-t-cell-therapy/
