新冠疫苗“一針就靈”?腺病毒疫苗來了!_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2021-05-28 20:30
根據當前的臨牀研究數據估算,克威莎在接種後6個月時防護有症狀感染的能力略有下降,但依然符合世衞組織標準。
撰文 | 方婧玉
近日,一種只需接種一針即可提供保護的新疫苗——重組腺病毒新冠疫苗克威莎獲得監管部門正式批准,並開始進入多個省份的新冠病毒接種計劃。
中國的第一支新冠疫苗,可以追溯到2020年的最後一天。那一天,藥監部門批准了來自國藥集團的一款新冠滅活疫苗,自那之後,大範圍的新冠疫苗接種行動在中華大地上開始了。幾個月間,陸續有新的滅活新冠疫苗、重組蛋白新冠疫苗獲得正式批准及緊急使用許可。要達到起效的抗原水平,前者需要接種兩針,後者需要接種三針。
克威莎上市後,其“單次劑量即可實現有效防護”的特性對廣大羣眾,尤其是醫護人員有着不小的吸引力。然而,在我國稍顯“年輕”的重組腺病毒疫苗克威莎,能否挑起抗疫的“大梁”;相比於國外的數種同類的重組腺病毒疫苗,性能和安全性又存在怎樣的差異?
“起了個大早,趕了個晚集”
的腺病毒疫苗
眾所周知,新冠病毒表面的刺突蛋白(Spike Protein,也就是俗稱的S蛋白)在給了它獨特的“王冠造型”之外,還是它在人體內傳播所必需的工具。只有刺突蛋白成功和細胞表面的“接頭站”ACE2結合以後,新冠病毒才能成功進入細胞內部。針對SARS病毒和新冠病毒的實驗室研究發現,如果能讓免疫系統提前記住刺突蛋白的樣貌,在病毒攻擊下呼吸道之前,機體就能產生足夠的抗體來干擾刺突蛋白和細胞“接頭”,抵禦病毒感染。
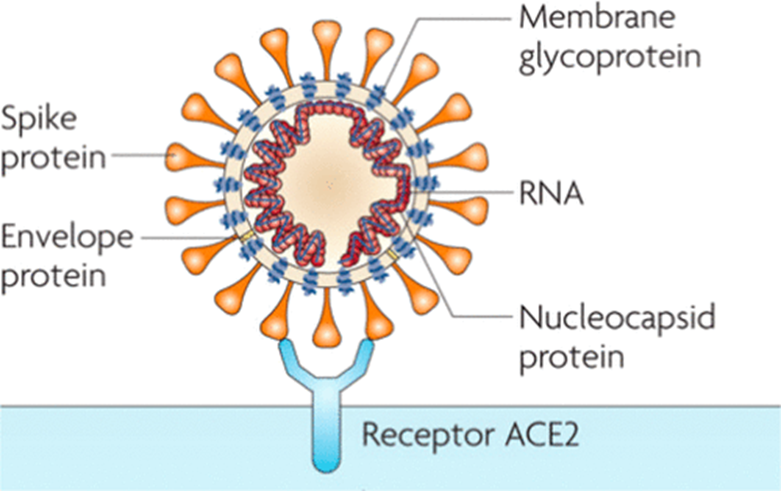
圖説:新冠病毒依賴刺突蛋白(橘黃色)和ACE2(淡藍色)結合,才能進入細胞
有了明確目標之後,科學界很快啓動了新冠疫苗的研發工作,為了儘可能研製出效果最佳的疫苗,不同國家的科學家“兵分四路”,研發出瞭如今我們所熟知的四類新冠疫苗——滅活病毒疫苗、重組蛋白疫苗、mRNA疫苗和重組腺病毒疫苗。
和前三種分別由病毒的屍體或是身體殘部做成的疫苗不同的是,**重組腺病毒疫苗是由大量不具有複製能力的活病毒構成。**這些病毒通過基因改造,被套上了新冠病毒刺突蛋白這一“馬甲”,當這些“套了馬甲”的腺病毒進入人體後,免疫系統會迅速啓動對病毒的免疫反應,並記住這些病毒……的“馬甲”,產生針對新冠病毒刺突蛋白的免疫應答。由於活病毒引起的免疫應答通常比病毒的“屍體”更強烈,所以在理論上,重組腺病毒疫苗的防護效力比傳統工藝的滅活疫苗更優秀。
當然,對於我國來説,重組腺病毒疫苗技術還存在一個潛在的優勢。在2013-2016年西非的埃博拉病毒病大流行後,為了避免這一可怕的大流行重演,多個國家開展了研製埃博拉病毒病疫苗的工作。2017年,由陳薇院士團隊所研發的埃博拉病毒病疫苗獲得批准,該疫苗正是採用了重組腺病毒技術。埃博拉病毒病疫苗的研發,使我國研究人員充分接觸了重組腺病毒疫苗技術,因此在新冠大流行期間,陳薇院士的團隊得以迅速啓動重組腺病毒新冠疫苗的研發和生產工作,克威莎甚至成了世界上第一個於同行評審期刊發表I期臨牀研究(2020年5月於《柳葉刀》)和II期臨牀研究(2020年7月發表於《柳葉刀》)的重組腺病毒新冠疫苗。
去年,很多人曾推測克威莎可能會是中國第一個獲批的新冠疫苗,然而,2020年12月31日,國藥疫苗獲批,2021年2月6日,科興疫苗獲批,兩支疫苗均是滅活疫苗。一直到2月25日,康希諾的腺病毒疫苗與武生的滅活疫苗同時獲批,頗有些“起了個大早,趕了個晚集”的味道。
重組腺病毒新冠疫苗5兄弟
截至今天,全球範圍內共有5種廣泛使用的重組腺病毒新冠疫苗,分別是:
阿斯利康公司和牛津大學聯合研發的AZD1222;
強生公司旗下楊森製藥研發的Ad26.COV2.S;
俄羅斯加馬列亞流行病與微生物學國家研究中心研發的衞星V**(Sputnik V)和衞星Light(Sputnik Light)****;**
解放軍軍事科學院和康希諾公司聯合研發的克威莎**(Convidecia)****。**
而在國外研發的四種重組腺病毒疫苗中,儘管俄羅斯的衞星V早於2020年8月就獲得了俄羅斯的批准,但由於種種原因,該疫苗在俄羅斯之外的推廣困難重重,其接種量大多來自於俄羅斯本土。
於2020年12月30日獲得英國監管機構批准的AZD1222,目前已經獲得了145個國家/地區的批准,無疑是應用範圍最廣的重組腺病毒疫苗。
至於楊森的Ad26.COV2.S疫苗,儘管其起步明顯晚於競爭對手(該疫苗2021年3月於歐盟獲批,4月於美國獲批),但憑藉可以單劑量完成接種的優勢,也在短短兩個月內贏得了46個國家/地區的批准,併成功納入了世界衞生組織的COVAX計劃。
實際上,以Ad26.COV2.S疫苗在臨牀研究中表現出的“單劑量和雙劑量接種均高度有效”的特性,加之該疫苗引發血栓性疾病的風險遠低於AZD1222,業內人士在其上市後紛紛哀嘆:若楊森公司能更快推進該疫苗的上市流程,Ad26.COV2.S疫苗是很可能超越AZD1222成為重組腺病毒疫苗領域“老大”的。
由於重組腺病毒疫苗的生產工藝相對成熟、產量較高,且保存條件不像mRNA疫苗那般嚴苛,在大多數滅活疫苗和mRNA疫苗供應受限的地區,重組腺病毒疫苗成為了當地衞生監管部門的優選。
根據當前的臨牀研究數據,各種重組腺病毒疫苗之間的防護力基本相似。所以,各支疫苗的可及性、使用的便利性和安全性,成為了大家所關注的重點。
不幸的是,此前“出盡風頭”的AZD1222,恰恰在安全性上翻了跟頭。今年的3月3日,奧地利的衞生主管部門緊急叫停了一個批次AZD1222的接種(後於3月9日恢復),原因是該國接種了該批次疫苗的居民中有2人出現了血栓性疾病,其中一人因此而喪命;隨後不久,德國保羅-埃裏希研究所(德國聯邦疫苗監管機構)因記錄到了7例疫苗接種後的罕見血栓性疾病[其中6例為顱靜脈系統血栓形成(CVST),1例為彌散性血管內凝血(DIC)],宣佈暫停AZD1222接種。雖然在歐洲藥品管理局和世界衞生組織的建議下,德國於3月19日重啓AZD1222的接種,但保羅-埃裏希研究所在同一時間與醫學科研機構組成聯合調查團,以徹查AZD1222和血栓性疾病的關係。
而隨着3月28日聯合調查團在預印本期刊網站Research Square發表其調查結果(該論文後於4月9日發表於《新英格蘭醫學雜誌》),證實AZD1222與CVST和DIC有關,多個開展了AZD1222接種的地區(包括德國、法國、芬蘭、瑞典、意大利和加拿大)採取了預防性措施,限制或暫停了疫苗於高危人羣(55-65歲以下人士)的接種,這款曾被阿斯利康抱有巨大希望的疫苗,不得不接受其在歐洲的市場被其他疫苗蠶食的命運。
糟糕的是,由於有部分學者認為AZD1222的血栓性疾病風險“可能是重組腺病毒疫苗的類效應”,其他三款重組腺病毒疫苗(衞星Light當時尚未獲批)也面臨了巨大的壓力。其中楊森的Ad26.COV2.S疫苗甚至因為在美國出現了接種者罹患CVST和血栓性血小板形成性紫癜(二者均為十分危險的血栓性疾病)的事件,一度被美國FDA宣佈暫停使用,直到調查顯示該疫苗的血栓性疾病風險並不顯著時,才得以重新上市。而遠在大洋彼岸的俄羅斯加馬利亞所和中國康希諾公司也紛紛拋出聲明,表示二者生產的疫苗未發現和血栓性疾病有關,輿論才得以平息。
血栓的爭議結束了,圍繞腺病毒疫苗的爭議卻遠沒有結束。尤其考慮到,重組腺病毒和其他活病毒一樣可以感染細胞的特性,會導致其適用人羣和不良反應均和其他技術路線的疫苗(尤其是滅活疫苗或重組蛋白疫苗)存在一定差異。
楊森:
接種28天,防護有症狀66.1% ,防護重症/致死性新冠85.4%。
副作用:需要治療的流感樣症狀發生率26.4%,安慰劑6%。
阿斯利康:
防護有症狀感染67.1%,防護重症100%。
副作用:流感樣症狀、頭痛52.6%、疲勞53.1%、肌痛44%、寒戰31.9%、關節痛26.4%、噁心21.9%、發熱41.5%。
衞星V:
防護有症狀91.6%,防護重症100%。
安全性數據未披露,但最常見的依然是流感樣症狀、注射部位反應和頭痛。
近日,著名醫學期刊《柳葉刀》上收到了部分學者對重組腺病毒疫苗領域最早“入場”的衞星V臨牀試驗數據透明度的質疑。來自俄羅斯高等經濟學院的質疑者認為衞星V的III期臨牀試驗中,目標志願者人數幾經更改,導致亞組分析可能陷入樣本過少的情況;而來自美國天普大學的質疑者則直接要求試驗方公開全部源數據及試驗各流程細節,並以論文附表中的多處數學錯誤作為依據,認為試驗數據可能存在造假。隨後,衞星V的研究主導人員在《柳葉刀》上刊登回信表示有關數據錯誤的來源為“筆誤”,並認為試驗招募志願者和進行隨機化分析的流程符合有關規範。
當然,近段時間對於重組腺病毒疫苗而言,也並不全是壞消息。自3月4日接受歐洲藥品管理局滾動審評的衞星V,有望在月內獲得批准;而克威莎在於3月22日獲得匈牙利有關部門的緊急使用許可後,也於近期通過了歐盟的GMP認證,這至少意味着康希諾具備了將疫苗進口至歐盟國家的基本條件之一。
單劑量新冠疫苗來臨,
如何考慮接種計劃?
最近一個月以來,克威莎陸續進入了全國各地的新冠疫苗採購計劃,並開始向部分地區的新冠疫苗接種點配送。作為國家藥監局當前唯一批准的單劑量新冠疫苗,從康希諾發佈的臨牀研究的數據看,單劑量克威莎在接種後28日,防護有症狀感染(防護率65.28%)和重症新冠肺炎(90.07%)的能力完全符合世界衞生組織的有關標準(有症狀感染防護率≥50%)。而在很多人關心的“單劑量疫苗的防護效力會不會下降更快”這一方面,根據當前的臨牀研究數據估算,克威莎在接種後6個月時防護有症狀感染的能力略有下降,但依然符合世衞組織標準。
最後,值得注意的是,作為一種重組腺病毒疫苗,克威莎能實現單劑量免疫,但其適用人羣和不良反應卻較我國當前使用的其他疫苗狹窄得多。相比滅活疫苗,接種克威莎後發生流感樣症狀(低熱、肌肉痛、頭痛、乏力等)的概率遠高於前者,通常,此類不良反應持續時間通常很短(1-2天),並可通過服用解熱鎮痛藥緩解。而且正如其他減毒活疫苗一樣,為防止疫苗病毒形成侵襲性感染,克威莎不能用於患有免疫缺陷性疾病,或正在服用免疫調節劑/免疫抑制劑的患者。
PS:接種策略選擇參考
推薦接種克威莎——不願或沒有條件接受多劑量新冠疫苗,或在短時間內有出國/境需求。
三種疫苗均可選擇——健康成年人,不在意具體的接種方案,對克威莎的流感樣症狀副作用有心理準備。
推薦接種滅活/重組蛋白疫苗——對克威莎的流感樣症狀副作用接受程度不佳,或存在控制良好的、不禁忌接種活疫苗的慢性疾病(例如高血壓、高血脂、偏頭痛等)。
僅可考慮接種滅活/重組蛋白疫苗——存在控制良好的、但禁忌接種活疫苗的慢性疾病(如風濕病),或服用免疫調節劑/免疫抑制劑(如環孢素、甲氨蝶呤、依那西普等)。
(本文作者系傳染病臨牀科研人員。)
參考文獻:
[1].Voysey M, Clemens SAC, Madhi SA, et al; Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK[J]. Lancet. 2021 Jan 9;397(10269):99-111. doi: 10.1016/S0140-6736(20)32661-1.
[2].Du, L., He, Y., Zhou, Y. et al. The spike protein of SARS-CoV-a target for vaccine and therapeutic development[J]. Nat Rev Microbiol 7, 226–236 (2009). doi:10.1038/nrmicro2090
[3].Pharmacovigilance Risk Assessment Committee of European Medicine Agency. COVID-19 Vaccine AstraZeneca-Up date onongoing evaluation of blood clot cases[EB/OL]. [2021-03-25]. https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-update-ongoing-evaluation-blood-clot-cases
[4].Paul-Ehrlich-Institut. Occurrence of Cerebral Venous Thrombosis after Vaccination with COVID-19 Vaccine AstraZeneca[EB/OL].[2021-03-22]https://www.pei.de/EN/newsroom/hp-news/2021/210322-occurence-cerebral-venous-thrombosis-vaccination-covid-19-astrazeneca.html
[5].Greinacher A, Thiele T, Warkentin TE, et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination[J]. N Engl J Med. 2021 Apr 9. doi: 10.1056/NEJMoa2104840.
[6].Schultz NH, Sørvoll IH, Michelsen AE, et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination[J]. N Engl J Med. 2021 Apr 9. doi: 10.1056/NEJMoa2104882.
[7].Centers for Disease Control and Prevention (CDC). Joint CDC and FDA Statement on Johnson & Johnson COVID-19 Vaccine[EB/OL].[2021-04-13] https://www.cdc.gov/media/releases/2021/s0413-JJ-vaccine.html
[8].Sadoff J, Le Gars M, Shukarev G, et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine[J]. N Engl J Med. 2021 May 13;384(19):1824-1835. doi: 10.1056/NEJMoa2034201.
[9].U.S. NATIONAL LIBRARY OF MEDICINE (DAILYMED). LABEL: JANSSEN COVID-19 VACCINE- ad26.cov2.s injection, suspension[EB/OL].[2021-04-23] https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=14a822ff-f353-49f9-a7f2-21424b201e3b
[10].Bucci EM, Berkhof J, Gillibert A, et al. Data discrepancies and substandard reporting of interim data of Sputnik V phase 3 trial[J]. Lancet. 2021 May 22;397(10288):1881-1883. doi: 10.1016/S0140-6736(21)00899-0.
[11].Logunov DY, Dolzhikova IV, Shcheblyakov DV. Data discrepancies and substandard reporting of interim data of Sputnik V phase 3 trial-Authors’ reply[J]. Lancet. 2021 May 22;397(10288):1883-1884. doi: 10.1016/S0140-6736(21)00894-1.
[12].Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al; Gam-COVID-Vac Vaccine Trial Group. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia[J]. Lancet. 2021 Feb 20;397(10275):671-681. doi: 10.1016/S0140-6736(21)00234-8.
[13].Bucci E, Andreev K, Björkman A, et al. Safety and efficacy of the Russian COVID-19 vaccine: more information needed[J]. Lancet. 2020 Oct 3;396(10256):e53. doi:10.1016/S0140-6736(20)31960-7.
[14].Logunov DY, Dolzhikova IV, Tukhvatullin AI, Shcheblyakov DV. Safety and efficacy of the Russian COVID-19 vaccine: more information needed - Authors’ reply[J]. Lancet. 2020 Oct 3;396(10256):e54-e55. doi: 10.1016/S0140-6736(20)31970-X.
[15].CanSino Biologics Inc (From PR Newswire). CanSinoBIO Announces Approval for its Single-Dose COVID-19 Vaccine Convidecia in Hungary[EB/OL].[2021-03-22] https://www.prnewswire.com/news-releases/cansinobio-announces-approval-for-its-single-dose-covid-19-vaccine-convidecia-in-hungary-301252978.html
[16].Zhu FC, Li YH, Guan XH, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial[J]. Lancet. 2020 Jun 13;395(10240):1845-1854. doi: 10.1016/S0140-6736(20)31208-3.
[17].Zhu FC, Guan XH, Li YH, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial[J]. Lancet. 2020 Aug 15;396(10249):479-488. doi: 10.1016/S0140-6736(20)31605-6.
[18].Reuters. Spanish study finds AstraZeneca vaccine followed by Pfizer dose is safe and effective[EB/OL].[2021-05-18] https://www.reuters.com/business/healthcare-pharmaceuticals/spanish-study-finds-astrazeneca-vaccine-followed-by-pfizer-dose-is-safe-2021-05-18/
[19].Shaw RH, Stuart A, Greenland M, et al; Com-COV Study Group. Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data[J]. Lancet. 2021 May 12:S0140-6736(21)01115-6. doi: 10.1016/S0140-6736(21)01115-6.
[20]圖源:Nature Reviews Microbiology 7(3), 226–236 DOI: 10.1038/nrmicro2090