JAMA|全球首個新冠滅活疫苗臨牀三期數據,有效率達78.1%_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2021-05-28 11:50
新冠肺炎有大約12種中國候選疫苗,但有5種領跑者已經在中國和其他幾個國家獲得了緊急使用批准。
國藥控股集團目前正在進行兩種不同的疫苗接種,這兩種疫苗都是基於一種滅活的SARS-CoV-2病毒。第一種為國藥控股北京研究所開發,第二種為武漢開發。第三種名為CoronaVac的疫苗是由總部位於北京的製藥公司Sinovac開發的。它也是基於一種滅活的SARS-CoV-2病毒。這三種疫苗都需要兩劑,但第四名領跑者來自疫苗開發商CanSinoBIO,是單劑。與其他病毒不同的是,它使用人腺病毒Ad5將SARS-CoV-2蛋白送入體內。(俄羅斯的Sputnik V疫苗也使用了一種Ad5和另一種腺病毒)。CanSinoBIO之前使用相同的方法開發了埃博拉疫苗,該疫苗已被批准在中國緊急使用。第五種候選疫苗來自安徽智飛龍康製藥公司,於3月16日獲得緊急使用批准。這種疫苗需要三劑疫苗,使用基於SARS-CoV-2病毒受體結合域的蛋白質。這五種疫苗都可以在正常的冰箱温度下保存,與其他需要在極低温度下保存的疫苗相比,這是一個很大的優勢。
5月26日,JAMA在線發表了國藥中國生物集團旗下北京所、武漢所的兩款滅活新冠疫苗的三期臨牀中期詳細分析數據。研究總結分析了中國生物所屬北京生物製品研究所(BIBP)、武漢生物製品研究所(WIBP)新冠滅活疫苗的有效性、安全性等Ⅲ期臨牀試驗結果。

這是全球首個正式發表的新冠滅活疫苗Ⅲ期臨牀試驗結果,這也是中國新冠疫苗Ⅲ期臨牀試驗結果的首次發表。

本項臨牀研究的兩款疫苗WIV04和HB02分別由武漢生物製品研究所和北京生物製品研究所研製和生產,所用毒株(WIV04和HB02株)分別分離自武漢市金銀潭醫院的兩名患者。病毒株在合格的、來自WHO的Vero細胞系中進行培養增殖,隨後進行滅活和純化。所有疫苗和安慰劑均由中國食品藥品檢定研究院檢定,編盲後的每支疫苗以唯一編碼、外觀相同的單劑量小瓶進行使用。
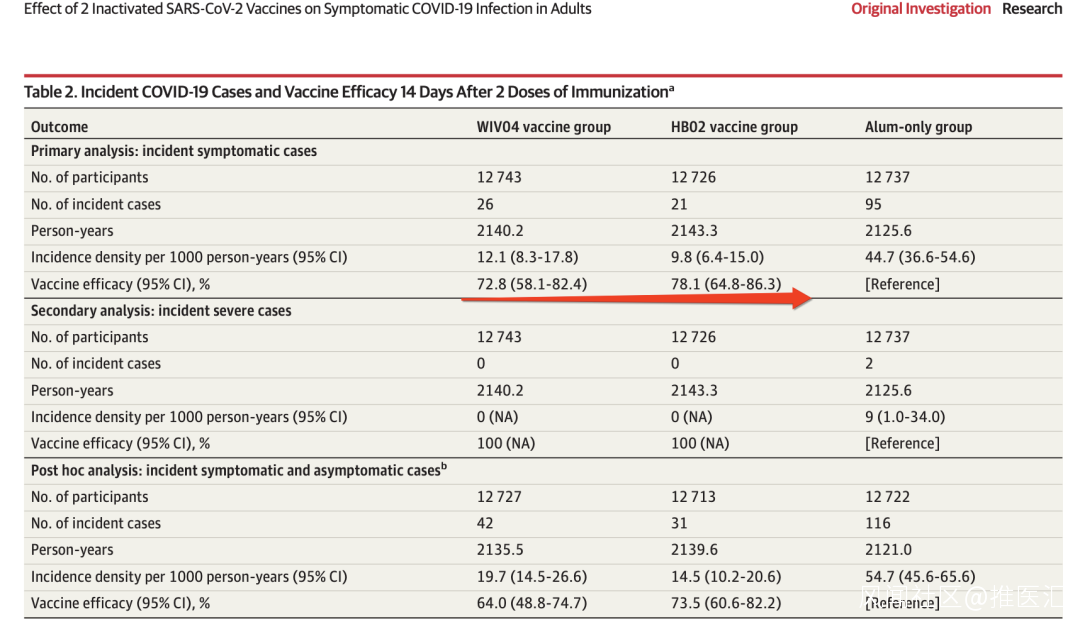
研究涵蓋了結果在40382名隨機接受至少兩種疫苗或對照單純鋁佐劑疫苗中(平均年齡36.1歲;32261 [84.4%]名男性)的參與者中,有38206名(94.6%)接受了2劑疫苗,其貢獻為第二次療效在入組後第14天后至少進行了1次隨訪,入組時PCR試驗結果為陰性。
在77(1-121)天的中位(範圍)隨訪期間,在WIV04組的26名參與者中發現了有症狀的COVID-19(每1000人年12.1 [95%CI,8.3-17.8]), HB02組為21(每1000人年9.8 [95%CI,6.4-15.0]),僅單純鋁佐劑組為95(每1000人年44.7 [95%CI,36.6-54.6])。與僅使用單純鋁佐劑相比,WIV04的疫苗效力為72.8%(95%CI,58.1%-82.4%),HB02的疫苗效力為78.1%(95%CI,64.8%-86.3%)(P(<0.001) )。
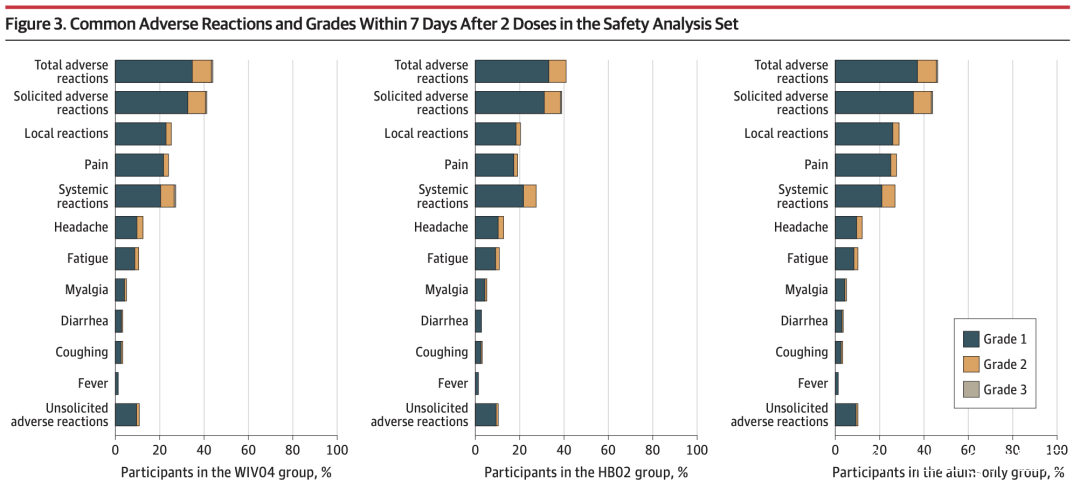
每次注射後7天內,在WIV04中報告了5957名參與者(44.2%)的總不良反應組,HB02組為5623(41.7%),而HB02組為6250(46.5%)僅限單純鋁佐劑的羣體。最常見的不良反應在WIV04組,HB02組和單純鋁佐劑組中注射部位疼痛(24.3%,19.4%和27.9%),其次頭痛(分別為12.9%,13.1%和12.6%)。單純鋁佐劑組發生了2例嚴重的COVID-19病例,而疫苗組則沒有發生。在3組中,嚴重的不良事件很少見且相似(WIV04:64 [0.5%];HB02:59 [0.4%];單純鋁佐劑:78 [0.6%])。不良反應多為注射部位疼痛,程度輕,具有一過性和自限性。
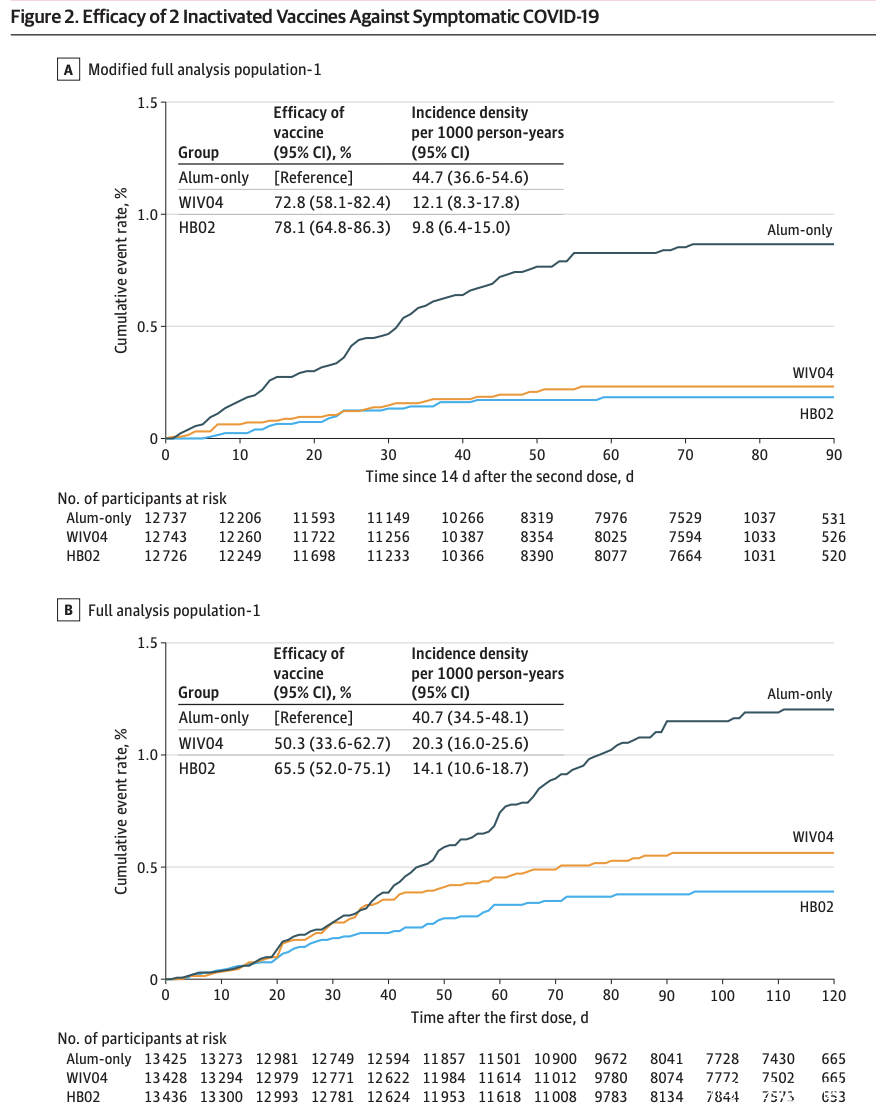
文章寫道,在這項針對隨機臨牀試驗的預先指定的中期分析中,用兩種滅活的SARS-CoV-2疫苗中的任一種治療成人均可顯着降低症狀性新冠肺炎的風險,而且嚴重的不良事件很少見, 正在進行最終分析的數據收集正在等待中。
參考文獻:
Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults
A Randomized Clinical Trial,JAMA. Published online May 26, 2021. doi:10.1001/jama.2021.8565,