40餘年來,圍繞p53靶點開發的創新療法有哪些重要進展?_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2021-06-21 14:45
我們每個人身體中都藏匿着一個了不起的基因——TP53,它的存在保證了細胞的正常生長和分裂,從而保護人體免於患上癌症。TP53也是人類癌症中最常見的突變基因,據估計,超過50%的癌症都帶有TP53編碼的p53蛋白突變。因此,這個靶點對於癌症治療的重要意義不言而喻。自TP53在1979年被首次報道以來,科學家們已經對它進行了廣泛而深入的研究。p53也被證明是腫瘤研究中最難開發的靶點之一,目前全球尚未批准一款靶向p53的有效手段。

然而,近期越來越多圍繞p53開發的創新療法傳來喜訊。在剛剛結束的2021年美國臨牀腫瘤學會(ASCO)年會上,來自亞盛醫藥的小分子MDM2抑制劑APG-115,Aprea Therapeutics公司的p53靶向新藥APR-246,勃林格殷格翰(Boehringer Ingelheim)的MDM2-p53拮抗劑BI 907828等在研產品,紛紛展示其最新研究進展。這可能表明,p53的新藥開發領域即將迎來破冰時刻。
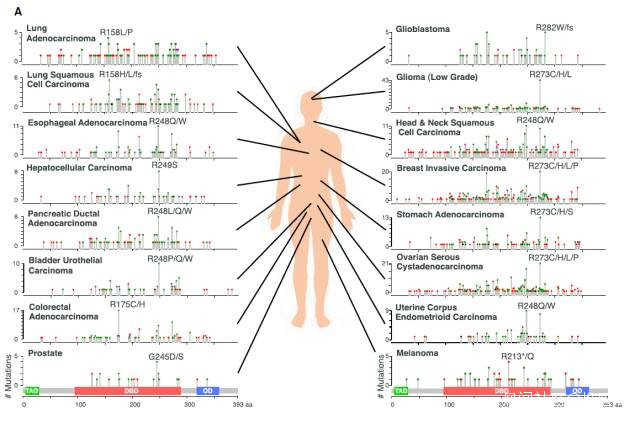 16種癌症類型中的常見TP53突變(圖片來源:參考資料[1])
16種癌症類型中的常見TP53突變(圖片來源:參考資料[1])
基因組守護者
在眾多與癌症相關的基因中,TP53無疑是被人類研究得極為透徹的一個。根據《細胞》雜誌曾發表的p53深度盤點文章,p53在人體中扮演着基因組守護者(guardian of the genome)的角色,它是一種調控轉錄的序列特異性DNA結合蛋白。
p53具體怎麼發揮抑癌作用呢?《p53:破解癌症密碼的基因》一書中提到,p53每天都會不停地檢測人體的細胞,以保證它們在生長和分裂的過程中不出現錯誤。如果細胞在複製DNA的過程中出現了錯誤,p53可以在細胞分裂前修復它們。
如果出現的錯誤無法被修補,細胞有癌變的危險,p53會限制基因突變帶來的有害後果。一方面,在DNA出現損傷後,p53能引發細胞週期停滯或者消滅細胞。另一方面,在致癌基因異常表達時,p53能夠阻止細胞增殖。這意味着,p53不僅能夠通過預防突變積累提前防止癌症發生,還可以限制致癌基因突變導致的細胞惡性增殖。
在正常細胞中,p53被一系列調節因子維持在低水平。例如,MDM2是p53的關鍵負調節因子,可以介導p53的降解。不過在DNA損傷、癌基因激活、端粒侵蝕和核糖核苷酸耗竭等多種細胞應激情況下,p53蛋白在細胞中的穩定性得到提高。
有了p53的守護,為何人體還是會出現癌症呢?研究表明,在p53本身受到損傷或者系統中其它異常導致p53“抑癌”功能削弱的情況下,癌症有可能趁機入侵。從機理上來看,一旦p53缺失,會導致存活下來的子細胞中基因突變數目增多,從而間接地促進癌症的發生。另外,如果p53缺失,表達致癌基因的細胞會繼續無限制增殖,導致癌症發生。
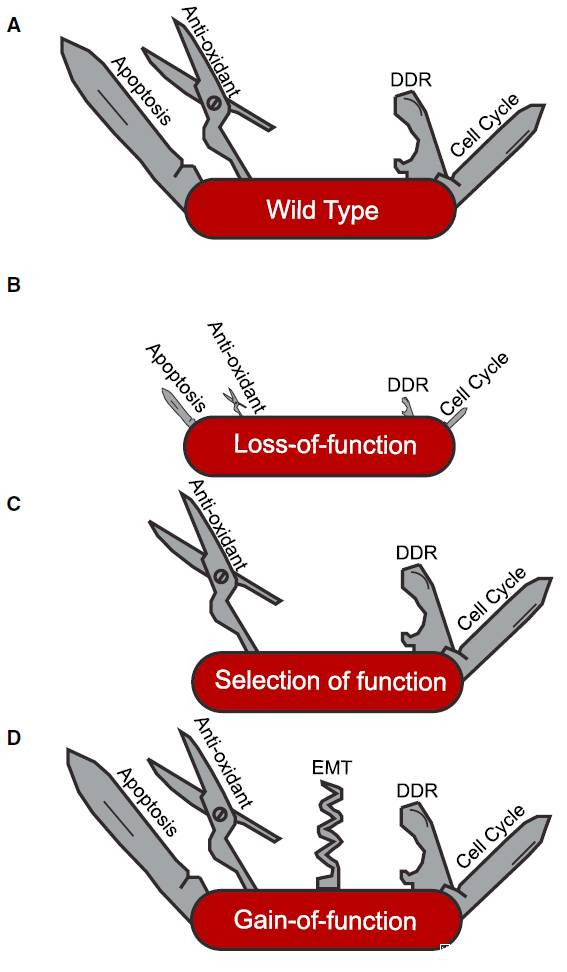 不同機制可導致p53突變的不同表型:(A)野生型,(B)功能喪失或部分喪失,(C)功能選擇,(D)新形態/功能增益
不同機制可導致p53突變的不同表型:(A)野生型,(B)功能喪失或部分喪失,(C)功能選擇,(D)新形態/功能增益
(圖片來源:參考資料[1])
因此,在很長一段時間內,p53被認為是癌症治療的關鍵。
突破重圍,從恢復蛋白功能開始
儘管對p53的研究非常詳盡,但40餘年來,圍繞這一靶點的創新療法卻一直沒有誕生。這當中,面臨一些科學挑戰。
與靶向癌蛋白的藥物開發途徑截然相反,開發p53的靶向藥物需要恢復(而不是抑制)蛋白的正常活性,以抑制腫瘤的發生、發展。根據《自然》雜誌早年特刊,臨牀上100多個靶向藥物幾乎都靶向促癌蛋白,而無一靶向抑癌蛋白。在整個行業尚無成功靶向抑癌蛋白的先例的背景下,要恢復p53的蛋白功能談何容易。更為艱難的是,p53蛋白的表面光滑,沒有合適的口袋能夠與化合物結合,因此成藥方面的挑戰也不容忽視。
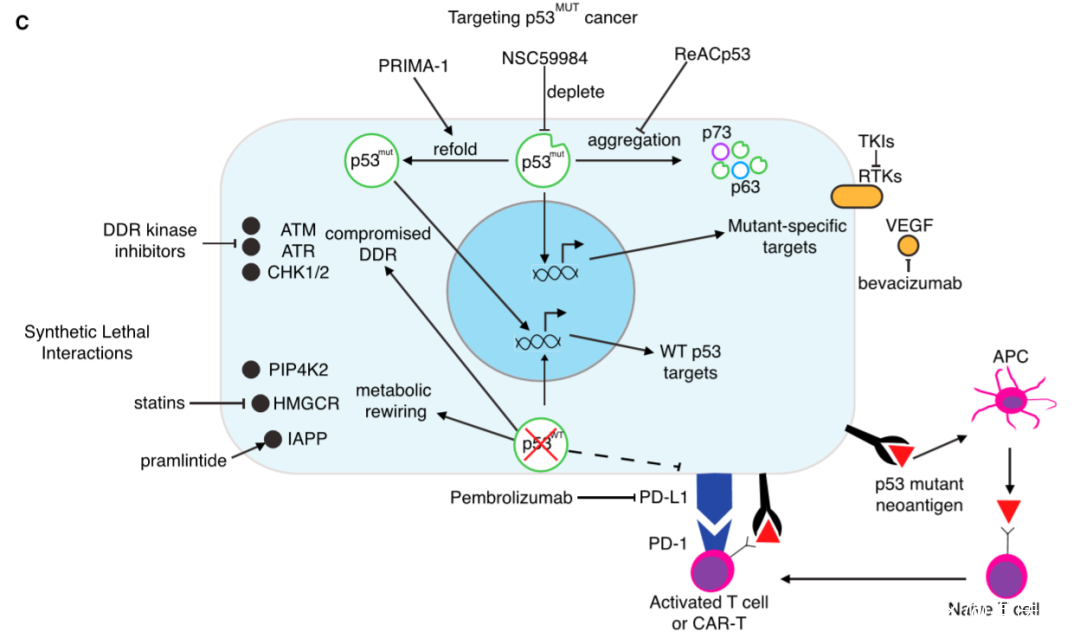 靶向p53突變的腫瘤(圖片來源:參考資料[1])
靶向p53突變的腫瘤(圖片來源:參考資料[1])
經過多年研發,研究人員開發了可以讓非結構化突變蛋白結構穩定下來的小分子和多肽,APR-246就是其中一種。它是Aprea公司開發的一款小分子藥物,可通過恢復野生型p53構象和功能,“重新激活”突變型和失活的p53蛋白,從而誘導人類癌細胞凋亡。此前,APR-246已在1/2期臨牀研究中證明了良好的安全性,以及對惡性血液腫瘤和攜帶TP53基因突變實體瘤的臨牀緩解。它還獲得FDA授予的孤兒藥資格、快速通道資格和突破性療法認定,目前已進展至3期臨牀階段。
來自PMV Pharma公司的p53激活劑PC14586也已啓動1/2期臨牀試驗,正在被開發用於治療通過下一代測序確定存在p53 Y220C突變的晚期實體瘤患者。作為一款小分子p53激活劑,它可以選擇性與p53 Y220C突變蛋白結合,從而恢復正常的p53蛋白結構和其腫瘤抑制功能。
另一種進入臨牀試驗階段的候選藥是大家比較熟悉的三氧化二砷。根據2020年12月發表在Cancer Cell雜誌上的文章,研究人員發現三氧化二砷可直接靶向結構突變型p53,促使這一類蛋白更容易摺疊並恢復其“抑癌”功能。公開資料顯示,依據於該理論發展的小分子靶向藥物已進入1/2期臨牀階段,針對適應症有急性髓系白血病(AML)/骨髓增生異常綜合徵(MDS)。
殊途同歸,更多創新療法正在開發
除了直接恢復p53蛋白的功能之外,不少研究人員也從p53信號通路中的其他方面着手。例如,MDM2抑制劑可通過抑制MDM2的功能阻斷p53的降解。目前,包括亞盛醫藥、羅氏(Roche)、安進(Amgen)/百濟神州、安科生物、Serrata Therapeutics、Kartos Therapeutics等公司的在研產品大多已經進入臨牀研究階段。
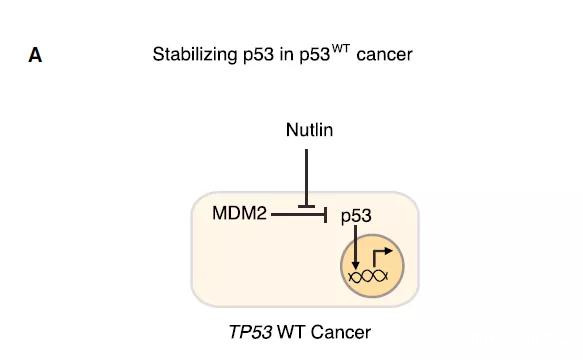 MDM2抑制劑的作用(圖片來源:參考資料[1])
MDM2抑制劑的作用(圖片來源:參考資料[1])
以Kartos Therapeutics在研產品KRT-232為例,它是一種與MDM2-p53相互作用的選擇性小分子抑制劑,已經進入治療骨髓纖維化的全球3期臨牀試驗,此前曾獲得FDA授予治療默克爾細胞癌和骨髓纖維化的孤兒藥資格。
另一款由亞盛醫藥開發的小分子MDM2抑制劑APG-115,已在針對不可切除/轉移性黑色素瘤或晚期實體瘤患者的2期臨牀試驗中獲得積極結果,並在2021 ASCO年會上以口頭報告的形式展示。APG-115對MDM2具有高度結合親和力,通過阻斷MDM2-p53相互作用從而恢復p53腫瘤抑制活性。數據顯示,APG-115聯合帕博利珠單抗治療對PD-1/PD-L1抑制劑耐藥黑色素瘤患者的疾病控制率(DCR)達60.9%,其中客觀緩解率(ORR)達到17.4%。
合成致死也是靶向攜帶p53突變蛋白腫瘤的具有吸引力的策略之一。《細胞》雜誌曾發文指出,很多p53突變蛋白造成的弱點與DNA損傷反應(DDR)和新陳代謝相關。雖然p53缺失的細胞在面對損傷DNA藥物時能夠避免細胞凋亡,但是進一步破壞DDR系統會讓攜帶p53突變的腫瘤對遺傳毒性損傷非常敏感。利用這一“合成致死”的概念,人們正在開發將造成DNA損傷的藥物與抑制DDR系統中的ATM、CHK2、ATR和CHK1等抑制劑聯合使用的策略。
其中,MDM2+Bcl-2就是一個備受關注的組合。據悉,該聯合療法能在多種癌症中激發“合成致死”機制,即同時阻斷腫瘤細胞藉以逃避細胞凋亡的MDM2-TP53及Bcl-2兩條關鍵通路,從而導致腫瘤細胞無路可逃,進而死亡。目前,來自亞盛醫藥的APG-115(MDM2抑制劑)與APG-2575(Bcl-2抑制劑)組合,以及羅氏和艾伯維(AbbVie)的idasanutlin(MDM2抑制劑)與venetoclax(Bcl-2抑制劑)組合,均已進入臨牀階段。
另一種名為Wee1的靶點也逐漸進入人們視野,它是DDR通路相關的一個重要激酶。已有研究表明,Wee1與腫瘤細胞廣泛存在的TP53突變存在一定的合成致死效應。據悉,目前一些Wee1抑制劑已在多個腫瘤,尤其在具TP53突變的腫瘤中顯示了一定的臨牀療效。其中,阿斯利康(AstraZeneca)靶向DNA損傷修復機制的在研療法AZD1775,正在幾十項臨牀研究中檢驗其單藥或聯合用藥用於卵巢癌和各種實體瘤的治療效果。在中國,英派藥業和首藥控股兩家公司的在研Wee1抑制劑已於今年獲批臨牀。
此外,研究人員還在開發基於靶向蛋白降解、mRNA等創新技術的潛在療法,以及多種不同作用機制的聯合療法等,以探索它們在治療攜帶p53突變癌症方面的潛能。
儘管尚未有療法成功獲批,但鑑於p53突變在人體癌症中如此常見,這個領域的新藥開發可謂是一片藍海,p53靶向藥物更是被科學界和工業界廣泛地稱為靶向領域的聖盃。我們期待這一天早日到來。
參考資料:
[1]Kastenhuber, Edward R , Lowe, et al. Putting p53 in Context.[J]. Cell, 2017.
[2] Prasad, V. Perspective: The precision-oncology illusion. Nature 537, S63, doi:10.1038/537S63a (2016).
[3] Chen S , Wu J L , Liang Y , et al. Arsenic Trioxide Rescues Structural p53 Mutations through a Cryptic Allosteric Site - ScienceDirect[J]. 2020.
[4] Suyong Choi et al., (2019), A nuclear phosphoinositide kinase complex regulates p53, Nature Cell Biology, DOI: https://doi.org/10.1038/s41556-019-0297-2