自身免疫性肝病的抗原呈遞、自身抗體產生和治療靶點_風聞
观察员2号-2021-06-30 10:46
概述
肝臟是控制全身耐受的重要免疫器官。肝臟擁有專業和非常規的抗原呈遞細胞,這些細胞對於耐受誘導和維持至關重要。在體內平衡中協調免疫反應取決於健康和良好的免疫肝臟微環境,這是由肝臟駐留抗原呈遞細胞與肝內和肝臟浸潤白細胞的串擾維持的。響應病原體或自身抗原,耐受性被未知機制破壞。肝內實質細胞和非實質細胞表現出獨特的抗原呈遞特性。微生物和內源性脂質的表現,通過常規和非常規機制來自腸道的代謝物和肽衍生抗原可以訓練肝內免疫細胞並引發效應反應或耐受。這種平衡的擾亂導致自身免疫性肝病,如自身免疫性肝炎、原發性膽汁性膽管炎和原發性硬化性膽管炎。雖然這些自身免疫性肝病的確切病因尚不清楚,但人們認為對自身抗原和微生物代謝物和脂質的耐受性的破壞,以及膽汁酸組成的改變,可能導致效應細胞活化和極化的變化和可能減少或損害保護性抗炎調節 T 和 B 細胞反應。此外,抗原和抗原的規範和非規範傳輸:MHC 複合物通過肝臟中不同(非)免疫細胞之間的吞噬作用或細胞外囊泡可能在誘導肝臟炎症和耐受中起作用。在這裏,我們總結了抗原呈遞、自身抗體產生以及新型治療方法在自身免疫性肝病的表徵和治療中的應用等新興方面。
介紹
自身免疫性肝病 (AILD),如自身免疫性肝炎 (AIH)、原發性膽汁性膽管炎 (PBC) 和原發性硬化性膽管炎 (PSC),是免疫介導的肝損傷,其特徵是淋巴細胞浸潤肝臟,循環免疫球蛋白增加、升高的肝酶、自身抗體的產生和遺傳風險因素,例如使個體易患 AILD 的 HLA 基因座關聯。除了 AILD 之外,肝移植後的移植物抗宿主病也是肝臟免疫穩態失調的一個例子。1 , 2
AIH 以界面性肝炎為特徵,通常與其他自身免疫性疾病(如乳糜瀉、類風濕性關節炎和潰瘍性結腸炎)有關。在 PBC 和 PSC 中,免疫介導的損傷發生在膽管中。PSC 還經常伴有炎症性腸病。在 PBC 中,小葉間膽管受累,表現為非化膿性、破壞性膽管炎。在 PSC 中,中等大小的肝內和肝外膽管受到影響,導致特徵性的多層洋葱皮纖維化和多灶性膽管閉塞。3 , 4所有三種 AILD 都有一個漸進的臨牀過程,最終會導致肝纖維化、肝硬化和肝細胞癌或膽管癌。迄今為止,最常用的治療方法是硫唑嘌呤聯合皮質類固醇治療 AIH 和熊去氧膽酸 (UDCA) 治療 PBC 和 PSC。4然而,病情不穩定或難治,以及頻繁複發,提示需要將肝移植作為最後的治療選擇。AILD 不令人滿意的治療結果要求開發新的治療方法。在肝病研究中迅速發展的研究結果包括使用 GMP 製造的臨牀級 Treg 的細胞療法,5調節性 B 細胞的作用和抗體介導的 B 細胞耗竭。6此外,闡明瞭抗原呈遞至 MR1 限制性粘膜相關不變 T (MAIT) 細胞或 CD1d 限制性不變性自然殺傷 T (iNKT) 細胞的非經典途徑,這些細胞與腸源性和內源性代謝物和脂質結合,提供了新的視角瞭解 AILD 的病理機制。7在這篇綜述中,我們將總結肝臟中專業和非專業抗原呈遞細胞 (APC) 抗原呈遞的這些新興方面及其對免疫肝臟環境的影響。闡明 MAIT 細胞、iNKT 細胞和肝竇內皮細胞 (LSEC) 抗原呈遞的新經典/常規和非常規/非常規機制,以及 APC 的吞噬作用和變裝,揭示了開發和新療法在 AILD 中的應用。此外,對(調節性)B 細胞和 Treg 的功能作用的瞭解以及它們最近在 AILD 中的成功治療靶向開闢了治療其他難治性肝病的新策略。
替代機制的抗原呈遞和對肝臟免疫調節的影響肝臟中的抗原呈遞
肝臟是 APC 和白細胞的大庫,肝內免疫偏向於耐受。8 , 9肝臟移植後令人印象深刻的致耐受作用變得明顯,10與其他實體器官(如腎臟、肺或心臟)移植相比,這可導致自發的移植耐受。11事實上,相當一部分患者可以在肝移植後停止免疫抑制治療,而其他實體器官的移植則需要終生治療。然而,分別有 10-40% 和 5% 的肝移植患者經歷了急性和慢性排斥反應。12肝臟中的 APC 由樹突細胞 (DC) 和巨噬細胞 (庫普弗細胞,KC) 以及非髓細胞如 LSEC、肝星狀細胞 (HSC)、膽管細胞和肝細胞 (HC) 組成。8此外,MHC-肽複合物通過接觸依賴性直接分子轉移或細胞外囊泡的細胞轉移實際上可以使任何細胞充當 APC,儘管結果不同,如下所述。
CD8 +和 CD4 + T 細胞對 APC 的許可分別通過 MHC-I 和 MHC-II 限制性抗原識別進行。8肝 APC,例如 DC,表達主要組織相容性複合體 I 類和 II 類(MHC-I、MHC-II),KC 和 LSEC 也是如此,儘管水平低於 DC。MHC-I + HCs、LSECs 和 DCs 可以直接將抗原呈遞給 CD8 + T 細胞,而 KCs、髓樣 DCs 和 LSECs 表達 MHC-II 並額外激活 CD4 + T 細胞。13然而,肝 CD4 + T 細胞啓動主要導致誘導耐受性 Foxp3 +和 Foxp3 + IL-10 +CD4 + Tregs。14 , 15 , 16 , 17此外,初始 CD8 + T 細胞的肝內啓動導致早產和非抗原特異性 CD8 + T 細胞的缺失。然而,T 細胞啓動的結果取決於整體抗原負荷,以及 MHC 複合物表達的環境:HCs 在穩態期間僅表達 MHC-I,這也見於病毒感染肝臟的膽管細胞或膽道閉鎖。18,19然而,上調和從頭MHC-II表達上膽管和碳氫化合物可發生在病毒感染的或發炎的肝臟並引起的Th1或Th2效應應答。19 , 20 , 21在臨牀肝炎(AIH、PBC、酒精性肝炎)中,HCs異常表達MHC-II,這是在炎症微環境中由炎性細胞因子干擾素γ(IFNγ)誘導的,懷疑是異常的MHC -II表達可能在自身免疫性肝炎的發病機制中發揮作用。20然而,在肝細胞上選擇性過度表達 MHC-II 的轉基因小鼠沒有表現出任何自身免疫性肝炎的易感性或患病率增加。21有趣的是,在 PBC 的早期階段,可以在膽管上皮細胞上檢測到 MHC-II 亞區基因(HLA-DP、HLA-DR 和 HLA-DQ)的異常表達,而在晚期疾病中,這些基因的表達減少。22在這種情況下,值得注意的是,某些 HLA-DR 和 HLA-DQ 基因座的表達與 AIH 和 PBC 的風險增加有關,而其他基因座似乎傳達了保護。23這一發現表明 MHC-II 介導的抗原呈遞的特定但尚未完全瞭解的特徵可能是 AILD 免疫病理學中不可或缺的一部分。
吞噬作用和異裝
Trogocytosis 與 AIH、PBC、藥物性肝損傷和脂肪性肝炎的發病機制有關,並且在乙型肝炎 (HBV) 和丙型肝炎 (HCV) 病毒感染期間觀察到它。一般來説,吞噬作用描述了 T 細胞與專業或非常規 APC 之間的載肽 pMHC-I 和 pMHC-II 複合物的細胞 - 細胞接觸和 T 細胞受體 (TCR) 依賴的膜轉移。值得注意的是,效應 T 細胞 (Teffs) 或 Tregs 獲得 pMHC-II 複合物會影響它們的活性。兩種細胞類型都可以獲得 pMHC-II 複合物,對於 CD4 + T 效應細胞,這種獲取與高度活化的 CD4 + T 效應細胞有關,而對於 Treg,MHC-II 肽配體增強了它們的抑制能力。24對於 Teffs,吞噬作用在細胞週期進程中連續發生,並標誌着高度增殖細胞的 IFNγ 產量高於 pMHC-II - CD4 +效應 T 細胞。相反,在活化的 Tregs 中,與 pMHC-II - Tregs相比,pMHC-II 的獲得導致效應細胞增殖的抑制以抗原特異性方式增強。這種增強的抑制是由於免疫突觸中的 Treg-Teff 密切接觸導致 Treg 衍生的免疫抑制介質如轉化生長因子 β (TGFβ)、白細胞介素 (IL-) 10 或環磷酸腺苷 (cAMP) 的直接作用。24,25此外,Tregs 上的 CTLA-4 阻斷 APC 上的 CD80/86 信號傳導,隨後下調 CD28 共刺激效應,這是效應 T 細胞擴增所必需的。26
除了吞噬作用外,細胞間蛋白質轉移還通過細胞外囊泡 (EV) 和外泌體發生。27 , 28然而,細胞間蛋白質轉移的確切機制需要仔細檢查,並且可能不會完全以一種方式發生。
吞噬作用和通過外泌體接受膜蛋白會產生 MHC 包裹的細胞,其具有自身或外來抗原的瞬時非典型呈遞,這會改變 T 細胞的活化和功能。引發免疫調節的重要機制是通過吞噬作用、變裝和對效應細胞施加耐受性的細胞外囊泡或外泌體(“耐受體” 29)的細胞間轉移而發生的。異裝是指將預先形成的肽:MHC 類分子複合物從一個細胞轉移到另一個細胞,而無需進一步加工抗原肽。
Trogocytosis,也稱為載肽人白細胞抗原 (HLA) 分子通過細胞外囊泡的細胞間轉移,可以產生廣泛的影響,例如免疫反應的啓動和放大、無反應性的誘導、調節的誘導。細胞、免疫刺激受體的脱敏、效應 T 細胞的耗竭或病毒感染傳播到以前未感染的細胞。30
因此,一般而言,抗原呈遞可以以下直接和間接方式發生: a.直接呈遞,其中病毒抗原由內源性 MHC-I 分子呈遞,例如通過病毒感染的 DC,將病毒抗原呈遞給 CD8 + T 細胞;灣 交叉呈遞,例如死亡細胞的攝取和隨後通過內源性 MHC-I 分子將這些外源性抗原呈遞給 CD8 + T 細胞;C。異裝,通過胞吞作用或外泌體將細胞間 MHC-I-肽從 APC 或腫瘤細胞轉移到 DC 並隨後激活 CD8 +T 細胞(此過程不需要 DC 處理細胞內抗原);和 d。MHC-II 敷料,通過外源性抗原-MHC-II 複合物從 DCs 到鄰近 DCs、CD4 + T 細胞、2 型先天淋巴細胞 (ILC2s) 或自然殺傷細胞的細胞間 MHC-II 轉移(通過吞噬作用/外泌體)發生。NK)和淋巴結基質細胞。27這種接觸導致 T 細胞活化,DCs/ILC2s 表達共刺激分子。ILC2s 表達 CD80、CD86 和 MHC-II,並通過吞噬作用獲得 MHC-II,從而在寄生蟲感染中誘導 Th2 反應。31 個ILC2 能夠分泌 Th2 效應細胞因子 IL-4、IL-5 和 IL-13。32關於 MHC-II,從 DC 到小鼠 NK 細胞的吞噬作用導致 CD4 + T 細胞反應的抑制,因為 NK 細胞缺乏共刺激分子 CD80/CD86,因此不會像 DC 一樣引發 CD4 + T 細胞活化。33因此,在獲得 MHC-II 後,MHC-II 包裹的 NK 細胞會抑制 DC 誘導的 CD4 + T 細胞反應。33
在肝臟中,大多數實質和非實質細胞是常規或非常規 APC,能夠進行吞噬作用或產生細胞外囊泡/外泌體:HC、膽管細胞、LSEC、HSC 和肝臟駐留白細胞。34肝臟中的吞噬細胞增多症最初被確定為“零碎”壞死,後來更名為troxis 壞死,然後稱為 trogocytosis(古希臘語中的“啃/啃”)。Trogocytosis 描述了 T 細胞受體 (TCR) 和表達抗原的 MHC-II 肝細胞之間免疫突觸的形成,這導致 CD4 + T 細胞獲得免疫複合物,並重復、連續地“咬”入肝細胞誘導肝細胞壞死35, 36 , 37 , 38 (圖 1 )。
圖。1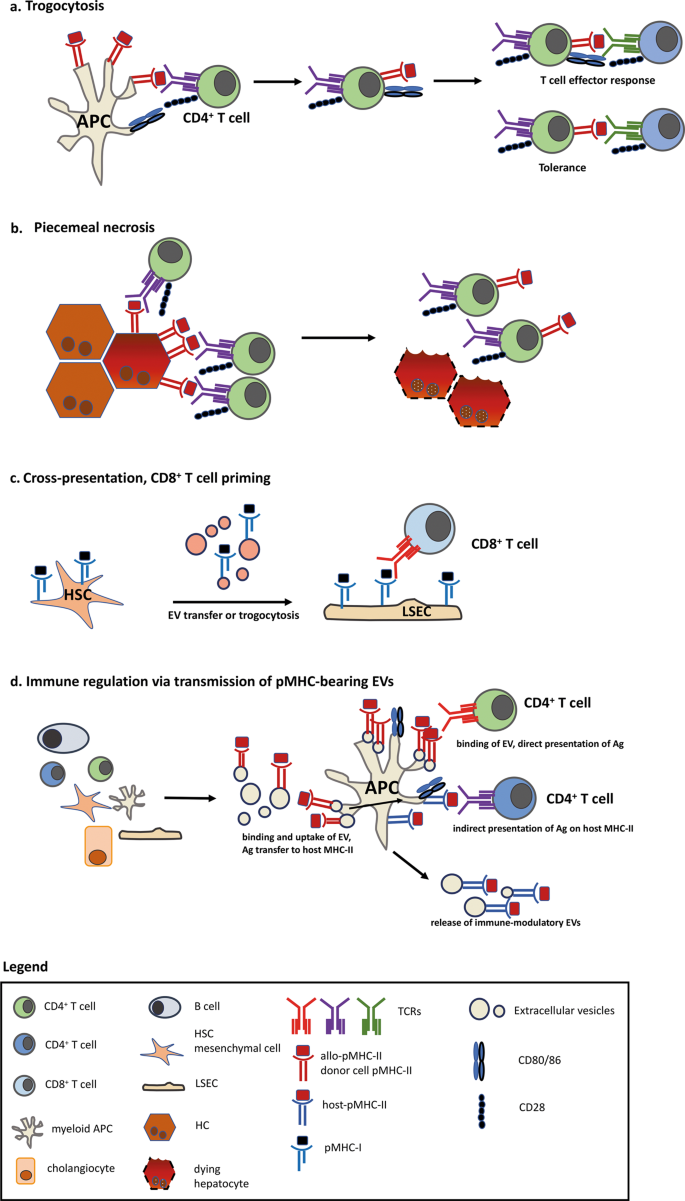
通過 EV 或吞噬作用進行 pMHC 和免疫調節分子轉移的例子。a肽:通過吞噬作用轉移載有 MHC 的複合物需要 APC 和 T 細胞之間的細胞間密切接觸。在轉移過程中,僅轉移肽:MHC 複合物;此外,CD80/CD86 等共刺激分子可以從 APC 轉移到 T 細胞。因此,T 細胞可以充當 APC,誘導幼稚 T 細胞的啓動。在沒有共刺激信號的情況下,耐受會導致 T 細胞凋亡和低反應性。b片狀壞死描述了在裝載肽的 MHC-II + HCs 和 CD4 +之間形成免疫突觸具有導致肽:MHC-II 轉移到 CD4+ T 細胞的同源 TCR 的 T 細胞。這個過程“吞噬”了部分肝細胞膜,並留下垂死的 HCs 和 CD4 + T 細胞以及獲得的肽-MHC-II 複合物。c HSCs 將 pMHC-I 分子轉移到 LSECs,LSECs 獲得交叉呈遞能力以引發 CD8 + T 細胞對病毒抗原的反應。d幾乎所有的實質和非實質細胞都會產生細胞外囊泡/外泌體。APC如何吸收和處理pMHC-II複合物以產生替代免疫反應的示意圖。首先,pMHC-II 複合物被 APC 吸收並呈遞,引發直接抗原呈遞和 CD4 +T 細胞在包含共刺激分子的免疫突觸中啓動。其次,MHC-II 結合的肽被 DC 吸收、加工並因此呈遞在宿主 MHC-II 分子(藍色)上以引發間接抗原呈遞和 CD4 + T 細胞啓動。第三,pMHC-II 複合物由攜帶 pMHC-II 複合物的免疫調節 EV 釋放,該複合物賦予遠程細胞 APC 特性
全尺寸圖片
後來,MHC 分子和 MHC: 肽複合物的轉移在肝臟免疫學中變得越來越重要,例如病毒性肝炎的傳播和持續、同種異體移植物的接受和排斥,並且它可以導致促進自身免疫的免疫突觸的異常形成。此外,病原體(例如*溶組織內阿米巴)*可以利用吞噬作用從宿主細胞中獲取和展示細胞表面分子,以逃避人血清成分的清除。39
一個非常最近的研究表明,MHC-I分子可以從造血幹細胞被轉移到LSECs,並且這些LSECs交叉本從被感染的HC病毒抗原保留和素細胞毒性CD8 +從循環T細胞40,41(圖 1)。因此,局部抗病毒免疫反應增強,感染的 HCs 被激活的細胞毒性 CD8 + T 細胞通過 TNFα 釋放殺死。LSEC 能夠表達可能支持 T 細胞活化的共刺激分子,如 CD80/86 和 CD40。42貝託利諾等人。證明肝臟誘導幼稚 CD8 + 的抗原特異性激活 T 細胞,與其在誘導早產和非抗原特異性 CD8 + T 細胞缺失方面的致耐受作用相反(墓地假設)。43初始 CD8 + T 細胞的激活取決於抗原負載,高抗原水平和 TCR 刺激強度會誘導激活的記憶 CD8 + T 細胞。該過程還部分取決於激活早期初始 CD8 + T 細胞的IL-2 分泌。44相反,如果抗原載量低,則會誘導耐受。45此外,初始 T 細胞的啓動會上調 LSEC 上程序性死亡配體 (PD-L)1 的表達,從而誘導 T 細胞凋亡。46
DCs作為專業的APCs,在耐受性的誘導中具有突出的作用。除了來自次級淋巴組織的 DCs 外,大多數肝 DCs 構成一個未成熟的亞型,其 Toll 樣受體 4 (TLR4)、MHC-II 和共刺激分子 CD80/CD86 的表達相對較低,這導致抗原呈遞較弱和較差。初始 T 細胞的啓動。47此外,與其他組織中的 DC 相比,在 CpG 刺激下,肝內 DC 產生更少的炎性細胞因子,例如 IL-6 和 IL-12p40。48肝內 DC 羣由類似於不成熟的耐受性 APC 的亞羣組成,這些 APC 對成熟具有抗性。48,49,50,51在很大程度上,肝內 DCs 是漿細胞樣 (B220 + ) DCs (pDCs),可響應 LPS 刺激產生致耐受性細胞因子,例如 IL-10 和 IL-27。48 IL-27 信號隨後可以通過信號轉導和轉錄激活因子 (Stat)3 信號在肝臟 pDC 上誘導 PD-L1 表達,從而產生能夠在體外誘導 CD4 + Foxp3 + Treg的耐受性 pDC 。48 , 52最近在 MHC 錯配小鼠肝臟同種異體移植物的背景下,pDCs 在耐受性方面的重要性得到了強調53:移植內 DC 表現出來自 MHC 錯配供體的 MHC-I 分子的異裝,並在不需要免疫抑制的情況下誘導宿主耐受。在人類中,與其他實體器官移植相反,肝臟同種異體移植物在五分之一的患者中是穩定的,不需要免疫抑制,這些接受者最終可以脱離免疫抑制治療。54 Crossed-dressed DCs (CD-DCs) 在心臟、腎臟、胰島和皮膚移植中發揮重要作用,因為 CD-DCs 促進移植排斥。55 , 56 , 57相反,在肝臟中,CD-DCs 支持移植物耐受,同種異體反應性效應 T 細胞的增殖被 CD-DCs 抑制。53肝臟同種異體移植物具有異常高水平的 PD-L1,由同種異體移植物衍生的非實質細胞和 CD-DC 表達,它支持 Treg 的誘導,但也抑制供體反應性宿主 T 細胞增殖並觸發同種反應性 T 細胞凋亡。53 , 58這種致耐受效應是基於通過觸發在骨髓細胞上表達的受體——DNAX 激活蛋白 12 kDa (TREM-DAP12) 的主動信號傳導,這是誘導 IL-10 產生所必需的。53小野等人. 表明移植物浸潤的 CD-DC 表現出激活的 DNAX 激活蛋白 12 kD (DAP12) 信號,這是誘導 IL-10 產生所必需的。缺乏 DAP12 的小鼠表現出 IL-10 的產生減少,這對於抑制 APC 對 Th1 效應子的激活至關重要。59有趣的是,與 WT 肝移植物相比,DAP12 *-/-*小鼠表現出急性同種異體移植排斥反應,伴隨着移植物浸潤 CD-DC 上 PD-L1/CD86 比率的降低。這一發現值得注意,因為循環 pDC 上高比例的 PD-L1/CD86 與循環 CD4 + CD25 hi Treg增加和人肝移植中的移植耐受性有關。60因此,作者建議 PD-L1+ pDC 是異裝的,並且在它們的模型中涉及介導移植物耐受性。53此外,PD-L1 + CD-DCs 的存在與 PD-1 + T 細胞免疫球蛋白和含粘蛋白結構域的蛋白 3 (Tim3) +效應記憶 T (Tem) 細胞在同種異體移植物中的積累相關,這些細胞刺激細胞死亡在 Tem 細胞中。59
查看全部論文請下載附件!