交配可以啓動穩定的 RNA 沉默,克服表觀遺傳恢復 2_風聞
观察员2号-2021-07-12 09:43
我們檢查了與iT相關的沉默信號在其他基因組位置的序列的潛在傳播。基因編碼分享序列同一性,但不是基因僅內含子或蛋白序列同一性,進行種系通過內沉默智達在反(圖 4克和補充圖 7D)。反式沉默只能在穩定建立的iT下檢測到,但不能與交配誘導的T沉默同時檢測到(補充圖 7e),表明交配誘導的沉默的啓動和維持在數量上是不同的(例如,小 RNA 的數量不同)或在質量上是不同的(例如,小 RNA 產生的時間不同或小 RNA 的不同性質)。與同源依賴的反式沉默一致,在從T 中刪除gfp後通過交配誘導的沉默建立的iTΔ不會使其他gfp基因在反式中沉默(補充圖 7f)。在所有情況下,沉默(反式或通過可分離的沉默信號)僅限於生殖系。此外,沉默信號的母本而非父本傳遞影響同源基因的表達(補充圖 7g)。在功效和/或沉默信號的傳輸這種差異可能反映了兩個配子和/或差異的性質或水平沉默通過兩個配子繼承信號的在細胞內環境的差異17,46。
基因可以從沉默中恢復並對反式沉默產生抗性當祖先暴露於神經元雙鏈 RNA (dsRNA) 導致 > 25 代沉默47時,先前觀察到T對 TEI 的敏感性。為了探索改變T表達的變化是否總是導致永久沉默,我們使用反式沉默作為啓動沉默的替代方法,並檢查了基因表達在種系中恢復的頻率。的相互作用Ť與智達導致強反式的沉默Ť如預期也從後代表達的弱激活智達(補充圖 7H)。這種重新激活可以通過與沉默信號相反的保護性信號的活動介導(補充圖 7i),導致一小部分iT動物的後代在每一代中都表現出表達(補充圖 7h)。然而,iT對Tcherry和TcherryΔpi的反式沉默效應(圖 5a和補充圖 7j,k)不太穩健。即使在具有純合子Tcherry和TcherryΔpi 的後代中沒有iT的情況下,一代暴露於iT也會導致沉默,但在幾代之內就恢復了表達。大約 60% 的Tcherry動物和幾乎 100% 的TcherryΔpi動物在七代內恢復(圖 5a)。有趣的是,儘管沉默的iT持續存在,但TcherryΔpi變得對反式沉默具有抗性(比較圖 5a 中的iT/Tcherry與iT/TcherryΔpi)。缺乏核定位的 GFP 和 mCherry 表明iT的持續沉默。這些觀察結果表明piRNAs與目標轉錄物(Tcherry)結合或與iT完全同源促進其對由iT製成的小 RNA 的反式沉默的持續敏感性。由於在種系內表達的內源基因被認為具有“許可”特徵,可以對抗 piRNA 的沉默(例如,PATC 序列14,CSR-1 靶向24),我們檢查了用gfp標記的內源基因的反式沉默。該PGL-1 :: GFP基因表現出從完全的開關反沉默由智達在第一代到檢測不到的沉默兩代內(圖 5b中)。這些結果為與穩定沉默相關的 RNA 提供了兩個令人驚訝的見解:(1) 即使在這些基因成功沉默幾代之後,它們也不足以誘導同源基因的穩定沉默;(2) 儘管最初是沉默的,但它們的活性可能會被來自最近活躍的同源基因的信號所抵消。
圖 5:在生殖系內的反式沉默之後,可以在幾代內恢復基因表達和對後續沉默的抗性。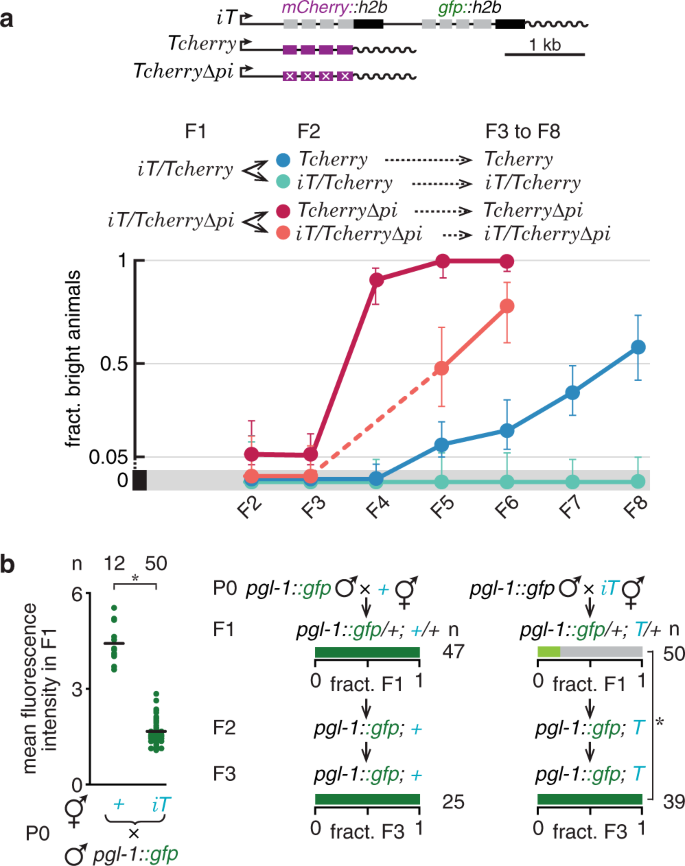 a Tcherry或TcherryΔpi動物與穩定沉默超過 150 代的iT交配,並在產生的雜交後代 (F1) 及其後代 (F2 到≤F8) 中對具有明亮Tcherry或TcherryΔpi表達的動物分數進行評分。誤差線表示 95% 的置信區間。所用轉基因的示意圖顯示在圖表上方。參見補充圖 7j,k,瞭解在每一代中為每個基因型和譜系分析的動物數量。繪製了明亮動物的分數,誤差線表示 95% CI。b pgl-1::gfp動物與非轉基因或iT交配動物和 PGL-1::GFP 的熒光在交叉後代(左)中量化或在交叉後代及其後代(中和右)中如圖1c中所示評分 。顯示了帶有隱性dpy標記(藍色字體)的染色體和評分的動物數量 ( n )。另見補充圖 7。星號表示P <0.05使用雙尾Student氏噸-test(B,左)或χ**2檢驗(b,右)。源數據作為源數據文件提供。
a Tcherry或TcherryΔpi動物與穩定沉默超過 150 代的iT交配,並在產生的雜交後代 (F1) 及其後代 (F2 到≤F8) 中對具有明亮Tcherry或TcherryΔpi表達的動物分數進行評分。誤差線表示 95% 的置信區間。所用轉基因的示意圖顯示在圖表上方。參見補充圖 7j,k,瞭解在每一代中為每個基因型和譜系分析的動物數量。繪製了明亮動物的分數,誤差線表示 95% CI。b pgl-1::gfp動物與非轉基因或iT交配動物和 PGL-1::GFP 的熒光在交叉後代(左)中量化或在交叉後代及其後代(中和右)中如圖1c中所示評分 。顯示了帶有隱性dpy標記(藍色字體)的染色體和評分的動物數量 ( n )。另見補充圖 7。星號表示P <0.05使用雙尾Student氏噸-test(B,左)或χ**2檢驗(b,右)。源數據作為源數據文件提供。
全尺寸圖片dsRNA 沉默的持續性取決於目標基因的調控環境幾項研究報告了不同條件下的 TEI,但研究之間的差異排除了對 TEI 易感性的一致解釋(補充表 1)。因此,我們同時使用相同的實驗條件餵養 RNAi 48來靶向相同的gfp序列,這些序列作為親本動物中低或單拷貝種系基因的一部分表達,並檢查了它們未經處理的後代 (F1-F5) 的沉默。因為親本dsRNA可以存入子代15,16,僅該沉默超出F2代仍然存在可以明確地認為是跨代。在測試的 6 個靶基因中,有兩個基因在 F2 後代中表現出沉默,但只有T顯示超過 F2 的沉默(圖 6a和補充圖 8a-f)。因此,即使針對在不同監管環境下在同一組織內表達的相同編碼序列,跨代沉默也是可變的。即使對於T,雖然可以在無偏繁殖時保持沉默,但一些動物可以從後代的沉默中恢復(圖 6b)。類似於從反式沉默中恢復(圖 5),儘管在父母中沉默了,後代仍表現出恢復(圖 6a)。持續 RNA 沉默與從 RNA 沉默中恢復的原因不能僅僅歸因於 HRDE-1 40因為儘管依賴 HRDE-1,但所有靶基因的沉默都不穩定(補充圖 8g)。我們研究了通過 dsRNA 增強沉默是否可以克服恢復以增加 TEI 的持續時間。去除顯示出對抗沉默的三種蛋白質,內切核酸酶 ERI-1 49、HERI-1 44或 MET-2 50,增強了沉默的持久性(圖 6c、d和補充圖 8h),儘管程度要小得多比之前報道的其他靶基因44、50。因此,T 它的變體是具有罕見調控背景的基因,這些基因使編碼序列能夠克服恢復並保留多代表達的變化。
圖 6:父母中被 dsRNA 沉默的基因通常從後代的沉默中恢復。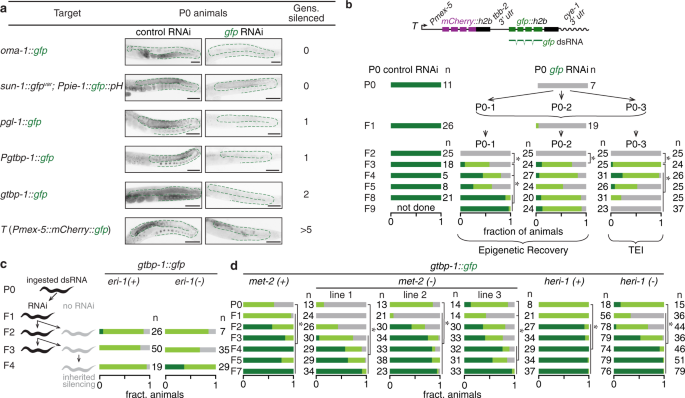 a含有相同gfp序列的六個靶基因暴露於相同來源的對照 RNAi 或gfp RNAi。P0 動物被餵食 dsRNA 24 小時,並分析了 P0 動物及其最多五代(F1-F5)未經處理的後代。代表性圖像突出了 P0 動物的生殖系(綠色輪廓)。指示了顯示沉默的後代的數量。請注意,sun-1::gfp**var也存在於具有PH::gfp的動物中,但並未沉默,因為其gfp**var序列與用於餵養 RNAi的gfp -dsRNA僅具有 <14-nt 的連續同源性。比例尺表示 50 µm。乙表達T 的P0 動物暴露於對照 RNAi(P0 對照 RNAi)或gfp-dsRNA(P0 gfp RNAi)24 小時,並在 P0 動物及其未處理的後代中分析沉默。在gfp RNAi 中,P0 和 F1 動物都被彙集在一起進行成像,但每個從一個 P0 祖先(P0-1、P0-2 或 P0-3)下降的後代被成像為單獨的分離物。顯示的所有世代均通過成像評分,但 F2s 除外,其通過眼睛評分。雖然一個分離株顯示了 TEI,但其他兩個分離株恢復了表達(表觀遺傳恢復)。如示意圖所示,gfp dsRNA的序列與gfp編碼序列的外顯子相匹配。c gtbp-1::gfp動物被餵食gfp -dsRNA(黑色)連續一、二或三代,並且它們在野生型(eri-1(+))或eri-1(-)背景中未經處理的後代(灰色)被評分為表達綠色熒光蛋白。d gtbp-1::gfp野生型(met-2(+)和heri-1(+))、met-2(-)或heri-1(-)背景中的gtbp-1::gfp雌雄同體被餵食gfp- dsRNA 24 小時和未處理的後代(F1-F7)的評分如補充圖8c所示 。同時進行其他菌株的 RNAi 餵養,因此gtbp-1::gfp 的數據此處與補充圖8c 中的相同 。在heri-1(-)動物中,P0 和 F1-F2 之間的統計差異是由於沉默增加,但 P0 和 F3-F7 之間的統計差異是由於沉默減少。大多數餵食對照 RNAi 和後代的動物都顯示出明亮的 GFP 表達(除了 45 只 F5 後代中的 2 只和heri-1(-)動物的 37 只 F7 後代中的 1只顯示暗淡表達)。指出了評分的動物數量 ( n )。星號表示 使用χ**2檢驗P < 0.05 。另見補充圖 8。源數據作為源數據文件提供。
a含有相同gfp序列的六個靶基因暴露於相同來源的對照 RNAi 或gfp RNAi。P0 動物被餵食 dsRNA 24 小時,並分析了 P0 動物及其最多五代(F1-F5)未經處理的後代。代表性圖像突出了 P0 動物的生殖系(綠色輪廓)。指示了顯示沉默的後代的數量。請注意,sun-1::gfp**var也存在於具有PH::gfp的動物中,但並未沉默,因為其gfp**var序列與用於餵養 RNAi的gfp -dsRNA僅具有 <14-nt 的連續同源性。比例尺表示 50 µm。乙表達T 的P0 動物暴露於對照 RNAi(P0 對照 RNAi)或gfp-dsRNA(P0 gfp RNAi)24 小時,並在 P0 動物及其未處理的後代中分析沉默。在gfp RNAi 中,P0 和 F1 動物都被彙集在一起進行成像,但每個從一個 P0 祖先(P0-1、P0-2 或 P0-3)下降的後代被成像為單獨的分離物。顯示的所有世代均通過成像評分,但 F2s 除外,其通過眼睛評分。雖然一個分離株顯示了 TEI,但其他兩個分離株恢復了表達(表觀遺傳恢復)。如示意圖所示,gfp dsRNA的序列與gfp編碼序列的外顯子相匹配。c gtbp-1::gfp動物被餵食gfp -dsRNA(黑色)連續一、二或三代,並且它們在野生型(eri-1(+))或eri-1(-)背景中未經處理的後代(灰色)被評分為表達綠色熒光蛋白。d gtbp-1::gfp野生型(met-2(+)和heri-1(+))、met-2(-)或heri-1(-)背景中的gtbp-1::gfp雌雄同體被餵食gfp- dsRNA 24 小時和未處理的後代(F1-F7)的評分如補充圖8c所示 。同時進行其他菌株的 RNAi 餵養,因此gtbp-1::gfp 的數據此處與補充圖8c 中的相同 。在heri-1(-)動物中,P0 和 F1-F2 之間的統計差異是由於沉默增加,但 P0 和 F3-F7 之間的統計差異是由於沉默減少。大多數餵食對照 RNAi 和後代的動物都顯示出明亮的 GFP 表達(除了 45 只 F5 後代中的 2 只和heri-1(-)動物的 37 只 F7 後代中的 1只顯示暗淡表達)。指出了評分的動物數量 ( n )。星號表示 使用χ**2檢驗P < 0.05 。另見補充圖 8。源數據作為源數據文件提供。
全尺寸圖片總的來説,我們提出我們對誘導的 RNA 沉默反應的觀察揭示了兩種類型的調控環境,它們驅動了秀麗隱杆線蟲種系內的表達(圖 7):I 型容易受到響應瞬態擾動的永久性變化和 II 型要麼抵抗擾動,要麼可以在幾代內恢復。需要額外的工作來發現區分 I 型基因和 II 型基因的特定調節分子及其排列。
圖 7:模型描繪了兩種具有不同跨代調控的基因。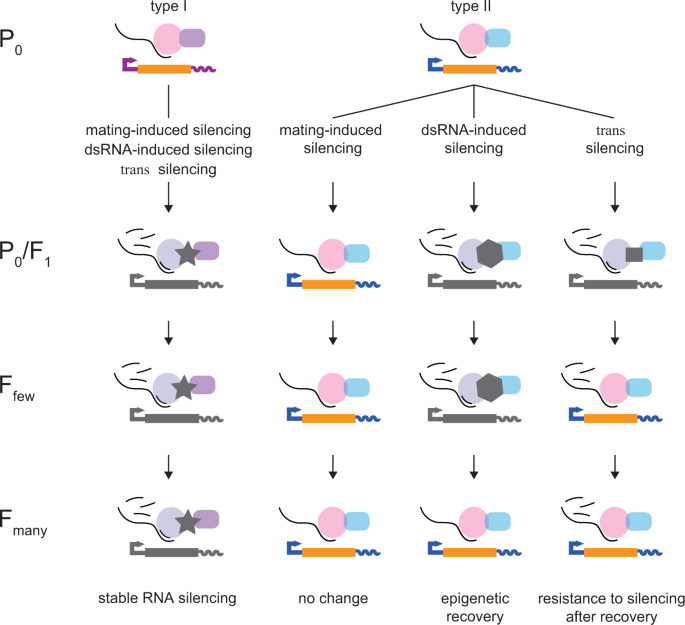 I 型基因穩定表達重組序列(本研究中描述的T、Tcherry、Tgfp等),但在使用多種方法之一啓動 RNA 沉默後仍可發生永久性遺傳變化(左欄)。II 型基因穩定表達重組序列(本研究中描述的gtbp-1::gfp、mCherry::mex-5等)並顯示 (1) 在交配誘導沉默時沒有變化,(2) 顯示沉默幾代後,當受到 dsRNA 沉默時,表觀遺傳恢復,(3) 顯示從沉默中恢復,然後在進行反式時產生抗性被另一個沉默的基因沉默。我們建議在 P0/F1 代期間對相同編碼序列的調節器的不同招募可以解釋永久性遺傳變化與從變化中恢復的情況。
I 型基因穩定表達重組序列(本研究中描述的T、Tcherry、Tgfp等),但在使用多種方法之一啓動 RNA 沉默後仍可發生永久性遺傳變化(左欄)。II 型基因穩定表達重組序列(本研究中描述的gtbp-1::gfp、mCherry::mex-5等)並顯示 (1) 在交配誘導沉默時沒有變化,(2) 顯示沉默幾代後,當受到 dsRNA 沉默時,表觀遺傳恢復,(3) 顯示從沉默中恢復,然後在進行反式時產生抗性被另一個沉默的基因沉默。我們建議在 P0/F1 代期間對相同編碼序列的調節器的不同招募可以解釋永久性遺傳變化與從變化中恢復的情況。
全尺寸圖片討論
交配誘導沉默的標誌是:(1)沉默是在遺傳後僅通過雄性精子開始的;(2)一旦開始,沉默是穩定的多代;(3)跨代沉默與DNA獨立的沉默信號有關,該信號在每一代中產生,可以遺傳一代,可以沉默同源序列;(4) 母體外顯子序列可以阻止沉默的啓動。雖然據我們所知,沒有其他已知現象具有所有這些特徵(補充表 2),但具有其中一些特徵的現象(在補充討論中詳述)可以為未來的機械研究提供信息。
我們對雙順反子操縱子T及其衍生物的分析表明,競爭性母體信號在後代中建立基因表達。雖然母系遺傳的 PRG-1 和 piRNA 介導了後代中父系遺傳的T拷貝的交配誘導的沉默(圖 2),但只要存在母系保護信號,沉默就會被反對(圖 2f)。這種保護信號可以遠離母體基因組發揮作用,儘管其身份目前尚不清楚,但有兩個觀察結果限制了可能性。一,來自T的部分mCherry編碼區的母體存在可以保護mCherry和gfp表達(圖 3)。 2e ),表明未剪接的前 mRNA 或 DNA 的序列依賴性識別作為雜交後代中的保護靶標。二,活性T繼續容易受到交配誘導的沉默的影響,而不管前幾代的保護或逃避沉默(補充圖 5e,f),這表明交叉後代需要繼承母體保護信號以在每一代中保持一致的基因表達.
這項工作表明,遺傳雜交的方向可以強烈影響雜交後代的表型(圖1))。此外,由於並非來自雜交的每個兄弟姐妹都具有相同的表型,因此選擇用於進一步操作的兄弟姐妹可能會產生深遠的影響。隨後的跨代持續沉默可以使表型獨立於基因型,從而導致錯誤的結論。因此,當使用遺傳雜交產生品系時,需要控制遺傳雜交的方向和選擇用於繁殖的個體雜交後代的選擇——尤其是在評估表觀遺傳現象時。例如,我們確保每次雜交都使用雌雄同體中存在的轉基因進行,以避免在我們之前的研究中啓動交配誘導的沉默,該研究檢查了來自神經元47的 dsRNA 沉默。
交配誘導沉默的跨代穩定性甚至在數百代後仍具有恢復表達的潛力(圖 3)表明這種機制在進化時間尺度上可能很重要。經受這種沉默的基因可以在針對其表達的選擇中存活下來,並且由於改變表觀遺傳沉默的環境變化或沉默機制中的突變(例如在hrde-1中)而在後代中表達。因此,這種機制可以緩衝來自選擇壓力的有害基因,類似於分子伴侶如何緩衝來自選擇壓力的缺陷蛋白質51。秀麗隱杆線蟲中的許多內源基因被 HRDE-1 22、40、52 , 53,其中一些可能是在具有該基因的雄性與沒有該基因的雌雄同體交配時獲得的。
使獲得性變化永久化並加速適應性進化的機制的可能性令人相當興奮10 , 54 , 55。我們使用 RNA 沉默作為誘導表觀遺傳變化的一個例子的分析表明,獲得性變化的穩定性可能在大多數基因中受到限制,並且需要特定的調控環境來促進穩定的表觀遺傳變化。通過比較生殖系內表達的兩種不同轉基因,有人提出跨代沉默的持續時間取決於個體生物體56所採用的隨機“狀態” 。然而,檢查具有不同調控背景的相同編碼序列(圖 6和補充圖 2) 表明沉默的程度不是細胞或生物體水平的屬性,而是基因水平的屬性。事實上,同一組織內的不同基因對 RNA 沉默有不同的遺傳要求(例如,bli-1沉默而不是dpy-7沉默需要核 Argonaute NRDE-3 57)。這需要對引起的變化的持續性額外監管環境是由酵母RNA介導的表觀遺傳變化的分析支持58,59,60。因此,穩定的表觀遺傳變化既需要一種複製或放大誘導變化的機制,也需要招募或激活這種機制的基因特異性調控環境。
方法概括
通過使用標準方法61產生和維持所有秀麗隱杆線蟲菌株。菌株在 20°C 下生長,除了一些在prg-1(-)和mut-16(-) 中發生突變的菌株外,它們在 15°C 下生長(參見補充表 3以獲得完整的菌株列表和補充所用寡核苷酸的表 4 )。在所有情況下,匹配對照雜交在與測試雜交相同的温度下進行。轉基因T ( oxSi487) was introduced into mutant genetic backgrounds through genetic crosses using transgenic hermaphrodites and mutant males to avoid initiation of mating-induced silencing. In all crosses, transgenic genotypes are represented without repetition for simplicity (e.g. ‘T’, ‘Tcherry’ to refer to homozygous animals T/T, Tcherry/Tcherry, respectively). Genotypes represented as ‘+’ are non-transgenic animals with marker mutation(s) (+/+ in colored font) or wild-type animals (+/+ or +). Cross progeny from genetic crosses were identified by balancing or marking oxSi487 with recessive mutations in dpy-2(e8) unc-4(e120)、unc-4(e120)、dpy-2(e8)、unc-8(e49) dpy-20(e1282)和 CRISPR-Cas9 產生了dpy-10 的等位基因。在一些雜交中,通過使用 PCR對oxSi487轉基因進行基因分型來鑑定雜交後代。在大多數情況下,使用 Cas9 蛋白和 sgRNAs 62進行基因組編輯(補充表 5)。使用 Nikon AZ100 顯微鏡在相同的非飽和條件下通過成像測量所有轉基因菌株的沉默。使用 NIS Elements (Nikon) 和 ImageJ (NIH) 對圖像進行量化。