不同人羣的新冠疫苗接種策略_風聞
梦想去飞翔-临床医学硕士-做一个靠谱医生。2021-07-23 16:00
在前面,我們已經討論了新冠疫苗的有效性,副反應。(請分別參考《新冠疫苗的價值》、《新冠疫苗的副反應》)
今天我們討論不同人羣該如何接種新冠疫苗。
需注意,不同人羣的新冠病毒風險有較大差異。比如,一個68歲的人跟30歲的人做對比,無論是感染的容易程度,還是感染後的重症風險,死亡風險都有較大差異。
因此,不同人羣應該選擇不同的疫苗接種策略。
一,3歲到18歲人羣
目前的研究證實,兒童相對不易感染新冠[1-3];而且,他們即便感染新冠病毒,出現重症乃至死亡的可能性也較成年人顯著偏低[4-5]。
特定的一些醫學狀況會增加重症風險,比如先心病、糖尿病等。兒童的新冠病毒感染問題將在後面專門文章討論,本篇不詳細討論。
兒童的新冠感染後可能誘發兒童多系統炎症綜合徵(multisystem inflammatory syndrome in children, MIS-C)。該病類似川崎病,但跟川崎顯然不同。
比如,中國是川崎病的高發地區(僅次於日本、韓國),但中國卻很少有MIS-C的報道。一方面可能是中國內地新冠感染控制得較好。但也可能是種族因素。
來自歐美的研究證實,雖不肯定,但初步表明MIS-C在非洲裔、西班牙裔羣體裏發病率較高;而眾所周知,川崎病在東北亞的日本、韓國、中國相對高發。
另外,MIS-C容易發生在既往體健的年齡較大兒童和青少年,這點跟川崎病也顯著不同。英美的較大規模病例研究證實:發病年齡中位數為8-11歲(範圍1-20歲)[6]。
除兒童本身的風險外,我們還要考慮他們傳播給他人的可能性[7-8]。尤其是當整個成年人羣有較高比率接種疫苗後,兒童的感染將成為免疫屏障的突破口。
也就是説,兒童接種疫苗是有公共衞生價值的。但客觀説,我們仍需審慎評估兒童接種疫苗的副反應,收益。
比如,已知兩個已上市的mRNA疫苗有較高的保護效能。但是,這兩個疫苗在男性青少年身上見到了稍偏高的心肌炎/心包炎的風險[9-10]。
而腺病毒載體疫苗可以看到相對偏高的血栓風險、免疫性血小板減少性紫癜、吉蘭-巴利綜合徵(Guillain-Barre syndrome ,GBS)等[11]。
對比來看,中國的滅活疫苗的安全性數據較好。雖然筆者尚未有兒童接種的數據,但國內已經批准在部分地區開展3歲~18歲接種新冠疫苗。
根據目前已有的數據,筆者支持3歲~18歲接種國產滅活新冠疫苗。而不接種mRNA疫苗、腺病毒載體疫苗。對於重組蛋白疫苗的安全性和數據還待進一步確定。
不過,對於非中國大陸的兒童來説,接種mRNA疫苗也是很好的選擇。因為他們感染新冠的風險明顯高過中國大陸兒童。在此情況下,該疫苗的獲益遠大於風險。
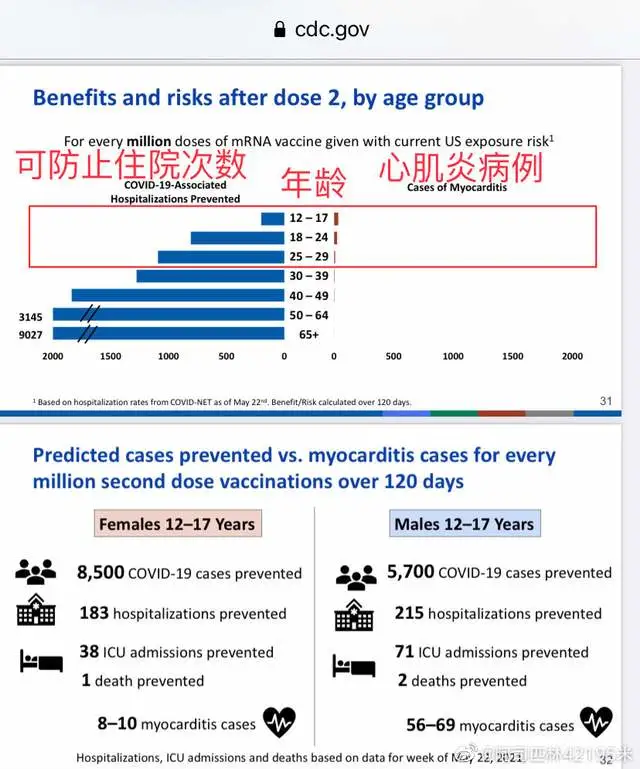
6月23日,美國CDC疫苗專家組直播mRNA疫苗和心肌炎的研討會上做了副反應與收益對比
二,特定的高危人羣
有些特定人羣更容易感染新冠病毒,有些人羣更容易因為感染出現高危狀況。
比如,在中國醫護人員,進出口岸的工作人員是目前的易感人羣。
而≥50歲,器官移植者、免疫抑制治療的病人、重度肥胖、糖尿病患者等等是感染後易高危人羣。
對於這些人羣,需要疫苗提高較強的保護力。一方面可以保護他們不被感染,另一方面也要幫助他們不把病毒傳染給他人。
對於特定人羣,世界各國都在研究是否給予疫苗強化[11],從而更好地保護他們。
不過,目前尚無確切的數據做支撐。筆者綜合各方面的信息,提出一個可能較優的方案;但必須提醒大家:尚無確鑿的對照研究數據做支撐------雖然這方面的研究已經有初步研究[12],該研究也支持阿斯利康疫苗與BNT疫苗混打強化是有益的。
1,兩針滅活疫苗+1劑mRNA疫苗
第三針mRNA疫苗間隔至少3個月。
這可能是兼顧安全性、疫苗保護效力的最佳方案。
因為已知滅活疫苗的安全性可能是最好的,而mRNA疫苗的副反應主要發生在第2劑(比如心肌炎/心包炎)。
2,三針滅活疫苗,第三針至少間隔3個月以上
安全性有較好的保障;但因為並不是混打。其強化效果可能不如mRNA;但可預計比單純打2針效果更好。
3,強化第三針mRNA疫苗,
前面兩針接種阿斯利康,或者mRNA疫苗,在間隔足夠時間後強化第三針mRNA;這可能是國外強化疫苗的合理選擇。
但要小心:第二劑的mRNA副反應較大,那麼第三劑呢?目前還不清楚。
4,免疫抑制治療中的患者
激素、免疫抑制劑治療的系統性風濕病患者、器官移植病患等。其最佳接種策略可能是:兩針滅活疫苗+1劑mRNA疫苗。
治療藥物可能對疫苗接種有一定影響,這也是為什麼選擇mRNA疫苗作為強化的理由。具體討論可以參考後續文章。
紅斑狼瘡病人可能需要疫苗強化
三,孕婦與哺乳期女性
對孕婦、哺乳期女性的疫苗接種已有相當多的研究數據。來自動物研究、接種疫苗的孕婦的小型前瞻性隊列研究的數據沒有顯示出有害影響[14-23]。即,mRNA新冠疫苗接種沒有增加流產、早產、胎兒畸形等等副反應。
不但如此,已經證明母體抗體通過胎盤轉移、通過母乳,為新生兒提供針對SARS-CoV-2的被動免疫[14-23].
目前,筆者尚未查詢到中國滅活疫苗在孕婦、哺乳期女性的安全性數據的具體研究報告。但可以預計,滅活疫苗在孕婦、哺乳期女性使用是安全的。
考慮到腺病毒載體疫苗的安全性相對較差,尤其是在女性身上似乎有更高的血栓風險(參考《新冠疫苗的副反應》)。因此,多數專家不支持孕婦、哺乳期女性使用它。
實際上,多年來孕婦、哺乳期女性的其他疫苗使用數據都證明了疫苗的安全性;也證明這些疫苗對出生嬰兒有一定保護作用。沒有理由不相信新冠疫苗在孕婦、哺乳期使用的安全性。
孕婦、哺乳期使用疫苗對小寶貝有保護
四,既往感染過新冠的康復者
既往感染過新冠病毒的康復者也應考慮接種新冠疫苗。
已有大量的研究證實,感染新冠後的康復者體內的中和抗體消失較快。跟疫苗接種者對比,康復者的抗體滴度、持續時間都不夠理想。
所以,美國CDC建議 既往感染新冠的康復者也接種新冠疫苗[24],而且不建議這些康復者在接種前行血清學檢測[24]。因為這樣做沒有意義。
唯一的顧慮是,感染新冠後而引發MIS-C的病人。他們接種新冠疫苗後是否會引發顯著的免疫反應?目前傾向於他們接種疫苗也是安全的。但仍需要更多研究數據做支撐。
CDC還建議,接受了針對COVID-19的單克隆抗體或恢復期血漿治療的患者,應將疫苗接種時間從治療開始推遲至少90天[24]。
研究發現,既往感染者接種一劑mRNA疫苗就可以產生足夠強的抗體、T細胞反應[25-29]。但因為缺乏臨牀保護率的數據;所以他們仍應該接種兩劑。這符合美國CDC目前的指南[24]。
尚沒有中國的既往感染者的疫苗接種研究數據。根據目前的資料來看,我傾向於這些康復者病友接種兩劑滅活疫苗即可。
五,非高危的普通人
對於18歲-49歲的健康者(非糖尿病、非重度肥胖)來説,感染新冠的風險相對偏低。尤其是在中國大陸的普通人來説。
因此,接種目前的國產滅活疫苗就足以保護自己。
有些可能需要到國外工作,或者密切接觸國外來訪者,選擇一劑mRNA新冠疫苗做為強化也是可以的。
但是,一些國家不接受中國滅活疫苗;因此,可能需要兩劑mRNA疫苗才能比較自由的國際往來。
(免疫抑制治療的病人,比如風濕病人,器官移植者的新冠疫苗接種見下一篇)
參考資料:
1,Dong Y, Mo X, Hu Y, et al. Epidemiology of COVID-19 Among Children in China. Pediatrics 2020; 145.
2,CDC COVID-19 Response Team. Coronavirus Disease 2019 in Children - United States, February 12-April 2, 2020. MMWR Morb Mortal Wkly Rep 2020; 69:422.
3,Zimmermann P, Curtis N. Coronavirus Infections in Children Including COVID-19: An Overview of the Epidemiology, Clinical Features, Diagnosis, Treatment and Prevention Options in Children. Pediatr Infect Dis J 2020; 39:355.
4,Stokes EK, Zambrano LD, Anderson KN, et al. Coronavirus Disease 2019 Case Surveillance - United States, January 22-May 30, 2020. MMWR Morb Mortal Wkly Rep 2020; 69:759.
5,Liguoro I, Pilotto C, Bonanni M, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur J Pediatr 2020; 179:1029.
6,Davies P, Evans C, Kanthimathinathan HK, et al. Intensive care admissions of children with paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS) in the UK: a multicentre observational study. Lancet Child Adolesc Health 2020; 4:669.
7,Qiu H, Wu J, Hong L, et al. Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. Lancet Infect Dis 2020; 20:689.
8,Kelvin AA, Halperin S. COVID-19 in children: the link in the transmission chain. Lancet Infect Dis 2020; 20:633.
9,https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-3-6-may-2021 (Accessed on May 26, 2021).
10,Gargano JW, Wallace M, Hadler SC, et al. Use of mRNA COVID-19 Vaccine After Reports of Myocarditis Among Vaccine Recipients: Update from the Advisory Committee on Immunization Practices - United States, June 2021. MMWR Morb Mortal Wkly Rep 2021; 70:977.
11,Simpson CR, Shi T, Vasileiou E, et al. First-dose ChAdOx1 and BNT162b2 COVID-19 vaccines and thrombocytopenic, thromboembolic and hemorrhagic events in Scotland. Nat Med 2021.
12,https://clinicaltrials.gov/ct2/show/NCT04885907?term=covid+vaccine+transplant&cntry=CA&draw=2&rank=1.
13,Joana Barros-Martins G, Swantje I. Hammerschmidt, Anne Cossmann, et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOxI nCoV-19/BNT162b2 vaccination . Nature Medhttps://dol.org/10.1038/s41591-0214n449-9
14,FDA. Emergency Use Authorization (EUA) . Pfizer-BioNTech COVID-19 Vaccine/ BNT162b2 https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/pfizer-biontech-covid-19-vaccine (Accessed on February 25, 2021).
15,Emergency Use Authorization (EUA). Moderna COVID-19 Vaccine/mRNA-1273 https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/moderna-covid-19-vaccine (Accessed on February 25, 2021).
16,CDC National Center for Immunization & Respiratory Diseases. COVID 19 vaccine safety update. Advisory Committee on Immunization Practices (ACIP) March 1, 2021 https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-02/28-03-01/05-covid-Shimabukuro.pdf (Accessed on March 02, 2021).
17,Gray KJ, Bordt EA, Atyeo C, et al. COVID-19 vaccine response in pregnant and lactating women: a cohort study. medRxiv 2021.
18,Mithal LB, Otero S, Shanes ED, et al. Cord blood antibodies following maternal coronavirus disease 2019 vaccination during pregnancy. Am J Obstet Gynecol 2021.
19,Rottenstreich A, Zarbiv G, Oiknine-Djian E, et al. Efficient maternofetal transplacental transfer of anti- SARS-CoV-2 spike antibodies after antenatal SARS-CoV-2 BNT162b2 mRNA vaccination. Clin Infect Dis 2021.
20,Perl SH, Uzan-Yulzari A, Klainer H, et al. SARS-CoV-2-Specific Antibodies in Breast Milk After COVID-19 Vaccination of Breastfeeding Women. JAMA 2021; 325:2013.
21,Shimabukuro TT, Kim SY, Myers TR, et al. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons. N Engl J Med 2021; 384:2273.
22,Prabhu M, Murphy EA, Sukhu AC, et al. Antibody Response to Coronavirus Disease 2019 (COVID-19) Messenger RNA Vaccination in Pregnant Women and Transplacental Passage Into Cord Blood. Obstet Gynecol 2021.
23,Beharier O, Plitman Mayo R, Raz T, et al. Efficient maternal to neonatal transfer of antibodies against SARS-CoV-2 and BNT162b2 mRNA COVID-19 vaccine. J Clin Invest 2021; 131.
24,Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States. https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html (Accessed on May 16, 2021).
25,Manisty C, Otter AD, Treibel TA, et al. Antibody response to first BNT162b2 dose in previously SARS-CoV-2-infected individuals. Lancet 2021; 397:1057.
26,Prendecki M, Clarke C, Brown J, et al. Effect of previous SARS-CoV-2 infection on humoral and T-cell responses to single-dose BNT162b2 vaccine. Lancet 2021; 397:1178.
27,Saadat S, Rikhtegaran Tehrani Z, Logue J, et al. Binding and Neutralization Antibody Titers After a Single Vaccine Dose in Health Care Workers Previously Infected With SARS-CoV-2. JAMA 2021; 325:1467.
28,Krammer F, Srivastava K, Alshammary H, et al. Antibody Responses in Seropositive Persons after a Single Dose of SARS-CoV-2 mRNA Vaccine. N Engl J Med 2021; 384:1372.
29,Bradley T, Grundberg E, Selvarangan R, et al. Antibody Responses after a Single Dose of SARS-CoV-2 mRNA Vaccine. N Engl J Med 2021; 384:1959.

