病毒是怎麼變異的?人類能消滅它嗎?| 病毒超話_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-08-19 11:20

1. 病毒是怎麼變異的?
2. 病毒改變多少,才算是新毒株?
3. Delta株傳染性增強,為什麼毒力沒有降低?
4. 人類能消滅新冠病毒嗎?
但是,在此之前,我們要先談一談什麼是“種”。
撰文 | 李慶超(山東師範大學)
新冠病毒一直在變異。疫情反反覆覆,人人提心吊膽。我們期盼着特效藥能擊敗它、物理隔離能阻止它、疫苗能消滅它,結果它又來了,換了馬甲又來了。這一次來勢洶洶的Delta毒株,去年10月就在印度出現了,它究竟是怎麼產生的?是怎麼鑑別出來的?它這麼厲害,還會有更厲害的下一代嗎?它的傳染性增強了,還會進化出新病毒嗎?……
在回答這些問題之前,我們要先談一談“種”的問題。
先有雞?先有蛋?
先有蛋還是先有雞?先賢亞里士多德給不出答案,生物學家卻能給出確切的答案。
因為面對這個問題的時候,他們腦海中的“雞”和“蛋”的概念是不同的。亞里士多德思考的是“雞生蛋,蛋生雞”,這種互為因果的無限序列是沒有真正起源的[1]。而生物學家會先問清楚,這裏的“蛋”是什麼蛋,“蛋”的定義是什麼,之後可以給出比較合理的解釋。如果“蛋”指的是雞蛋、鴨蛋這類鳥蛋,甚至加上烏龜蛋、恐龍蛋爬行動物的蛋這類,這類羊膜卵大概出現在3.12億年前[2]。而雞(Gallus gallus domesticus),是由紅原雞 (Gallus gallus)馴化而來,最多可能是八千年前[3]。如此説來,蛋的出現遠遠早於雞。
明確一下,如果“蛋”就是指“雞蛋”呢?一般認為,雞蛋是“雞下的蛋”,即便這個蛋落地能打滾,劈開蹦出個哪吒來,也沒關係。相比而言,“能孵出雞”,並不是成為雞蛋的必要條件。這麼一來,雞蛋就必須有個叫雞的動物去生它,於是邏輯上講,顯然是先有雞。
那麼這隻開天闢地的雞從哪裏來呢?從蛋裏孵出來的,而這個蛋是一個與雞很接近,但還不是雞的動物下的。因為雞的概念中,“從雞蛋裏孵出來”雖然是一個事實,但是萬一可以從別的蛋裏孵出來,不妨礙它是一隻雞。
如果強調這個雞蛋是“能孵出雞”的蛋呢?那答案就是先有蛋。因為在這種認識下,實質上是把雞的整個生命過程延伸到了受精卵階段。人們對多種野生叢林家禽的雜交和馴化產生雞的過程知之甚少,因此無法確切知道雞的非雞祖先與雞之間是否存在一個清晰的轉換點。與現代雞幾乎相同的動物(即原始雞)產下的受精卵具有與現代雞相同的 DNA(因為母親的卵子、父親的精子或受精的受精卵發生突變),那麼這個蛋就已經是(能孵出雞的)雞蛋了。因此從這個角度講,先有蛋。只不過這個蛋可能是“不是雞的動物”產的。
Ok,如果這個雞蛋是“雞生的蛋”,並且“能孵出雞”呢?好吧,這樣的話,這個題目真正迴歸它的本意了:循環論證,無始無終。
“種”之“辨”:物種的概念
從上面的討論我們看出,明確概念並達成共識是進行有效討論的前提。
概念有時候是模糊的。概念的模糊性有時候還真不是因為咱讀書少,而是因為概念本身就是個人造的物件兒,而它所描述的事實卻豐富多彩得多。用一句“違背祖師爺遺訓”的話來説:概念是人們用來描述現實的,而現實並不負責“長在”概念上。尤其是生命科學,“祖師爺”留下的概念可是老被突破和擴充。
比如“種”這個概念,就極其複雜(看到“種”這個漢字,你腦袋裏會湧現一系列認識)。單就“物種”(species)一詞也夠來一壺了(生殖隔離嗎?只有這個那就格局小了)。科學哲學家約翰·威爾金斯 (John Wilkins) 細數了 26種“物種”的概念,並進一步將物種概念分為七種基本概念[4]:
(1) 基於生殖隔離的有性生物的biospecies(生物物種)
(2) 基於無性生殖(克隆羣體)的agamospecies (無性種)
(3) 基於生態位的生態物種
(4) 基於進化譜系的進化物種
(5) 基於遺傳隔離的遺傳物種
(6) 基於表型差異的形態物種
(7) 分類物種,即由分類學家確定的物種。
我們回到雞生蛋的問題上來,雞這個物種是由紅原雞演化而來,紅原雞在繁衍過程中不斷出現突變,並被篩選,最終形成了我們今天所熟知的雞。可是紅原雞從哪一“輩”開始,或者從哪一個蛋開始就孵出了真正意義上的雞了呢?這個答案難以考證,或許也無法回答。人為規定的、虛擬的經緯線是精確的固定的,天然形成的、實實在在的海岸線卻難以測量出真正的長度。概念很美好,但真正使用一個個概念去考察一個連續變動的現實過程時,就會感覺很費勁。因為物種的演化過程是漸進和連續的,突變需要一步一步地變。
“種”之“變”:突變與變種
給新冠病毒起名字,主要考慮的是病毒之間的演化關係。
2020年2月11日,國際病毒分類委員會ICTV宣佈將新型冠狀病毒正式命名為“嚴重急性呼吸綜合徵冠狀病毒2”(severe acute respiratory syndrome coronavirus 2),英文簡寫為SARS-CoV-2)[5]。這表明,新型冠狀病毒從分類學角度上講,是SARS冠狀病毒(SARS-CoV)的近親。
ICTV強調,新型冠狀病毒(SARS-CoV-2)名稱中的 SARS 是為了突出它們與原始病毒在演化上的關係,而不是臨牀疾病層面的關係。這一命名是分類學家給出的命名,但是藴含了表型(可導致肺炎)、形態及分類地位(病毒顆粒皇冠狀的冠狀病毒科)及近緣關係(跟SARS病毒比較接近)等豐富的信息。這個名字比較清晰地界定了造成本次疫情的病毒物種。
突變
沒有突變就沒有多彩多姿的生命,更不會有人類。這種潛存於每次細胞增殖、個體繁殖和病毒複製過程中的遺傳物質複製的“錯誤”,給自然選擇創造了差異化的“選手”,是演化得以進行的原材料。
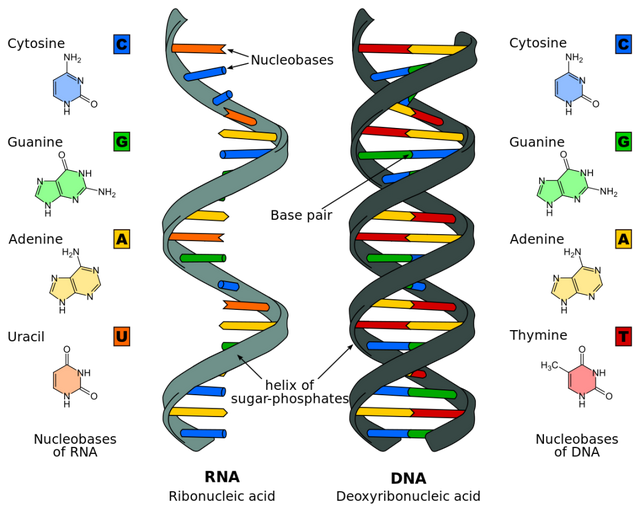
遺傳信息儲存在核酸的一級結構中,就像這篇文章,也是由字符組成的,只不過核酸的“字符”是鹼基。遺傳物質的傳遞就是鹼基序列的複製。這個過程是複製酶完成的。
Tips:聚合酶Vs複製酶
生命中遺傳信息的傳遞需要將核苷酸(底物)按照母本序列(模板)、以鹼基互補配對的方式,合成新的子代核酸(產物),這個反應是由聚合酶(Polymerase)催化的。
不同的聚合酶可以將遺傳信息傳遞給新基因組,發揮複製的功能,稱為複製酶(Replicase);或者將遺傳信息傳遞給非基因組的功能性RNA分子(mRNA等),發揮轉錄功能。
根據模板、子代核酸的種類不同來分,聚合酶可以分為(以DNA為模板,合成DNA的)DNA聚合酶、(以DNA為模板,合成RNA的)RNA聚合酶、(以RNA為模板,合成RNA的)RNA複製酶、(以RNA為模板,合成DNA的)逆轉錄酶等。
廣義的突變(Mutation)是指遺傳信息(核酸序列)的改變。病毒是一種無細胞結構的專性胞內寄生微生物,其核心組分是基因組核酸。將病毒基因組比喻為一本書,負責基因組擴增的複製酶相當於抄寫員。從病毒整個基因組上來説,病毒突變種類有:
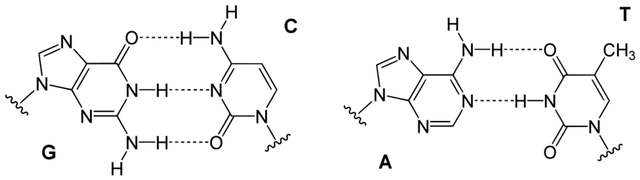
1. 點突變(point mutation),是指單鹼基改變,或小片段的插入或缺失。點突變類似於在抄寫過程中,抄寫員走神,抄錯了字符,它是由病毒基因組複製酶的錯誤複製導致的,是所有病毒基因組複製中都可能出現的一種變異形式(所有病毒生命週期中都存在基因組複製過程,而其複製酶均有不同程度的易錯性),它的發生頻率主要取決於“抄寫員”病毒基因組複製酶的保真性,對於RNA病毒來説,其RNA複製酶不具備校對活性——也就是沒法校對複製是否正確,並及時修正——因此RNA病毒的突變率是最高的。相比之下,DNA病毒(比如天花)的複製酶具有校對活性,因此突變率較低。
2. 重組(recombination),即同一種病毒不同病毒株間基因組分子的大片段交換。重組相當於抄寫員抄寫過程中寫到一半換了一本書,新書的上半部分是《西遊記》,下半部分是《紅樓夢》。當同一細胞感染了兩種(或以上)親緣關係相近的病毒,基因組分子間就可能發生重組交換或基因組複製模板轉移,導致重組突變。
3. 重排(reassortment),即分節段基因組病毒的基因組分子重新組合。重排類似於將1~4冊《哈利波特》與5~7冊《納尼亞傳奇》裝在一起。重排是一種特殊的重組形式,存在於流感病毒等分節段基因組病毒中。同一細胞裏面感染了兩種(或以上)親緣關係相近的病毒,病毒包裝過程中分節段基因組重新分配,產生新的病毒子代。
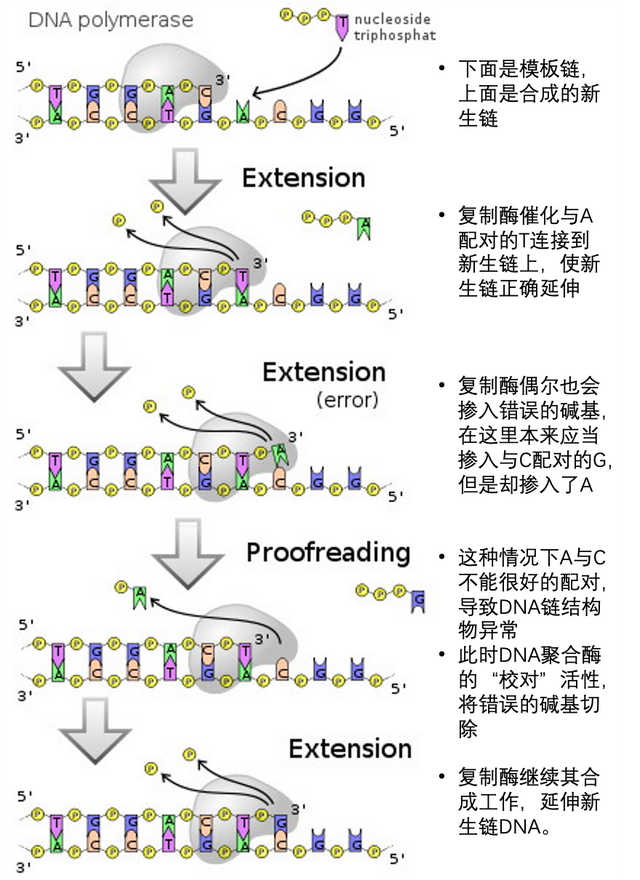
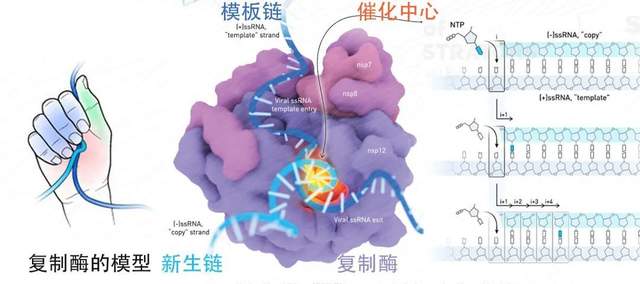
事實上用“抄寫員”來比喻複製酶還不夠精確,它更像一個排積木的小手,根據模板鏈(或稱母鏈)的鹼基排布序列,以鹼基互補配對的原則,選擇合適的鹼基,排列出新生鏈(子鏈)。模板鏈1和新生鏈2是互補配對的關係,當新生鏈3按此過程產生自己的子鏈3時,3的序列與原模板鏈1完全一致。؏؏ᖗ乛◡乛ᖘ؏؏完美。
並不!
不論是DNA複製酶還是RNA複製酶,其複製過程中摻入的核苷酸並非次次準確。也就是那排積木的小手總是要放些錯的積木上去……如果這些錯誤的鹼基摻入被留在了新生鏈中,就是鹼基突變。
突變過多會讓基因組信息不穩定,影響基因組的功能。因此,DNA聚合酶往往具有校對活性(proofreading),這是一種3’到5’的核酸外切酶活性,可以將錯誤的鹼基切掉,再繼續連接正確的鹼基。DNA聚合酶的保真性可以達到每複製107 到109 個鹼基才發生一次錯誤,相當於100萬字的小説抄100遍才出現一次錯誤(《紅樓夢》約79萬字)。
相比之下,RNA聚合酶沒有校對活性,複製每千到每十萬個鹼基就可能發生一次錯誤,這種犯錯傾向(error-prone)是RNA病毒複製酶的特性(老天爺故意的)。此外,RNA病毒基因組在患者體內的含量很大,RNA病毒複製週期短、複製水平高,每天會產生大量含有不同突變的RNA病毒基因組。這一切造就了RNA病毒極高的遺傳多樣性和可變性。更不用提環境誘變因素(射線、能修飾鹼基的化學物質、特殊鹼基或鹼基類似物等)、宿主RNA編輯酶(腺苷脱氨酶等)等因素會進一步增加RNA病毒的突變率。
需要指出的是,對於點突變來説,由於它是病毒基因組複製酶的錯誤複製導致的,這種錯誤是隨機發生的,因此病毒的突變可以發生在任何位點上。
那麼,我們在檢測病毒序列的時候,是否可以看到突變在整個基因組中隨機分佈呢?這要看突變位於何處,突變之後造成何種後果。
一般情況下,病毒的非編碼序列區(不表達蛋白的地方)會有很多基於序列的重要元件,而編碼序列區主要通過編碼蛋白後的蛋白質功能發揮作用(三個核苷酸特定排序的密碼子決定一個氨基酸)。根據突變對編碼序列的影響,可以將點突變分為移碼突變和置換突變。
移碼突變中,由於編碼序列在插入或缺失(非三整倍數)鹼基後,造成讀碼框移碼,原有蛋白質編碼序列被破壞,蛋白質不能正常表達。這種情況類似於一個五言絕句古詩,插入或刪除掉幾個字後,你再按照五字一句來讀,就不知所云了。置換突變是指不影響讀碼框的點突變,其突變的後果取決於密碼子發生了何種變化。同義突變:有些氨基酸的密碼子有多種,編碼同一種氨基酸的密碼子之間的變化不影響氨基酸種類。錯義突變:密碼子的變化導致其編碼的氨基酸種類發生變化。無義突變:氨基酸密碼子變為終止密碼子,終止密碼子可導致蛋白質合成提前終止。
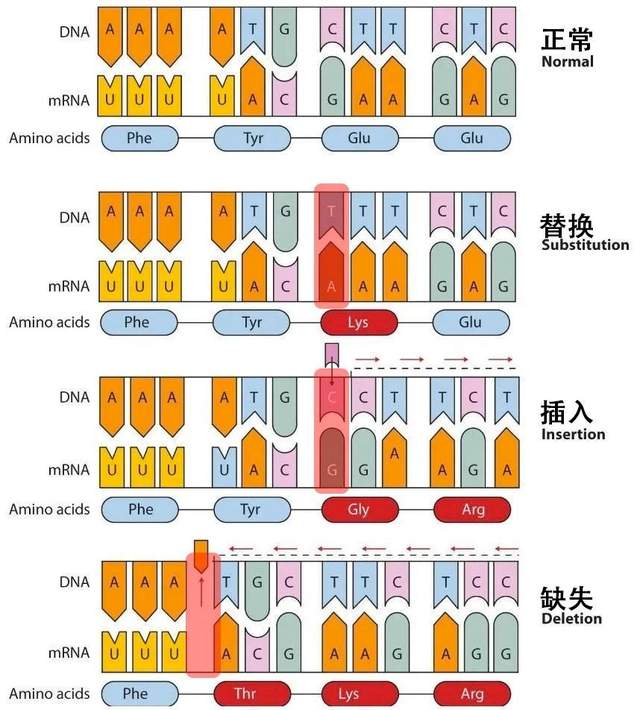
突變造成的後果反映到表型來説,可能有以下幾種情況。
功能喪失突變(loss of function),也稱為失活突變,導致基因產物功能較少或沒有功能(部分或全部失活)。功能獲得性突變(gain of function),也稱為激活突變,改變基因產物,使其作用變得更強(增強激活),甚至獲得異常功能。使病原體的毒性增強或感染新宿主的實驗一般是不被允許的。自然界中這種突變發生的概率極低,但是影響卻最為深遠。顯性負突變,會產生與野生型基因拮抗的基因產物。這些突變通常會導致分子功能改變(通常是無活性的),並以顯性或半顯性表型為特徵。致死突變,是導致攜帶突變的生物體死亡的突變。回覆突變,是恢復原始序列並因此恢復原始表型的點突變。
病毒的突變可能會影響病毒複製所必需的蛋白質的編碼以及RNA或DNA元件序列,因此,大量的突變往往是有害的——對病毒本身有害。這些含有有害突變的病毒不能複製自身,從而被淘汰了。
有害突變之外,還有相當一部分突變屬於“同義突變”,即突變前後對病毒沒有影響。最終,只有少數突變對病毒適應性具有正面作用,被富集和固定下來。
簡而言之,病毒一直在隨機突變,但很多突變會讓病毒“死得更快”,只有少量突變會留存下來。
由於病毒基因組一般較短、信息冗餘度很低,囿於病毒自身生存複製需求、宿主先天性免疫和適應性免疫壓力的(適應性)篩選,病毒基因組的突變位點大部分集中在病毒基因組的某些區域——通常是其結構蛋白的抗原決定區域,因此,我們能夠檢測到的病毒突變在基因組上的分佈是不均勻的。比如新冠病毒的大量突變就集中在它的刺突膜粒蛋白編碼基因上。
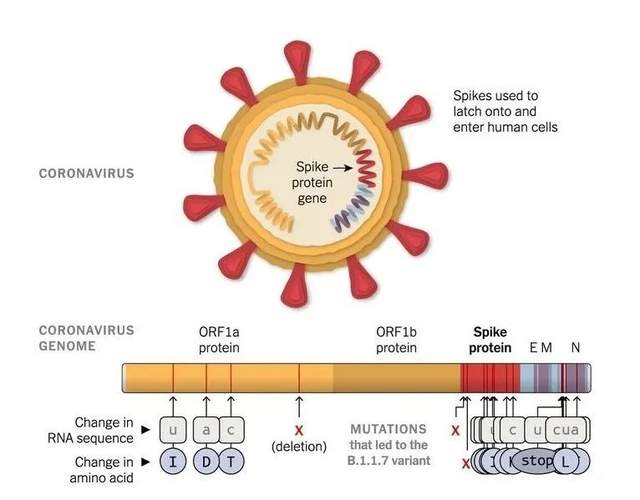
病毒變異研究的重頭戲是致病病毒抗原性的變化。“病毒抗原變異”有兩個專有概念,分別為抗原漂移(antigenic drift)和抗原漂變(antigenic shift),前者是指較為細微的變化,而後者是指抗原性的巨大變化。當然,有些正向選擇遺留下來的突變也存在於非編碼區或者非結構蛋白編碼區。
變種
新冠病毒還在不斷變化,產生了新的變種(variant,又譯作變異體)。變種病毒是指攜帶基因突變的病毒。如果突變足夠多的話,可以根據序列差異將病毒劃分為不同的基因型(genotype)、亞型、突變株等——劃分的標準是序列差異大小,不同病毒的劃分標準不盡相同。
其實,在同一患者體內感染的一種病毒,也在不斷複製的過程中發生着各種突變,因此,體內不同病毒基因組分子的序列中也存在不同。換言之,一個患者體內會測出不同的病毒基因序列(詳見《新冠變異株哪兒來的?慢性感染者竟可能是人體培養箱》)。
這種病毒以大量變種羣體存在的形式稱為準種(quasispecies)。上述已經存在的病毒基因型的劃分,描述的是病毒的遺傳多樣性;而準種中正在產生的各種變種,描述的是病毒的高度變異性。遺傳多樣性是變異和自然篩選共同作用下病毒演化的結果。
目前我們發現的新冠病毒變異株還沒到分家成“型”的地步,更算不上是新的病毒物種。只不過因為這些突變株對公共衞生構成的威脅更大——傳染性更強,導致的症狀更嚴重,或者對疫苗的抗性更強——需要引起人們足夠的重視。
其中,已知四種變異毒株最令人關注,並被WHO列入需要重視的變種清單[8],
Alpha 變異毒株( B.1.1.7),最早在英國肯特郡發現,已傳播到 50 多個國家/地區,有可能還在變異,Beta 變異毒株(B.1.351),最早在南非發現,已擴散到至少 20 個其他國家/地區Gamma 變異毒株(P.1),最早在巴西發現,已擴散到其他 10 多個國家/地區Delta 變異毒株(B.1.617.2),最早在印度發現,已擴散至92個國家。
更具體的變種特性可以回顧《新冠病毒Delta變異株強勢反擊,防疫需借鑑疫苗的現實世界數據丨117三人行》。
目前鬧的最兇的Delta毒株最早於2020年10月在印度被發現,這種新的變異毒株攜帶E484Q和L452R突變,可能導致免疫逃逸和傳染性增強。世衞組織將其命名為B.1.617,2021年5月31日用希臘字母δ(Delta)命名。事實上,B.1.617總共包含15處突變,有6處發生在刺突蛋白上,其中又有3處比較關鍵:L452R和E484Q突變發生在刺突蛋白與人體細胞“血管緊張素轉化酶2(ACE2)”受體結合的區域,L452R提高了病毒侵入細胞的能力,E484Q有助增強病毒的免疫逃逸;第三處突變P681R也能使病毒更有效地進入細胞。這些突變的綜合效應使病毒能部分避開一些中和抗體,且傳染性增強數倍[9]。
目前接種的疫苗還是有效的,至少可以預防重症和減少死亡。
現在我們知道,研發新冠病毒的藥物或疫苗,病毒變異是必須考慮的問題,因為病毒變異會導致其藥物敏感性和抗原性發生改變,從而影響藥物治療效果和疫苗保護效果。
有人問,病毒不是傳染性越強,毒力越弱嗎?為什麼Delta都像水痘一樣容易傳播了,毒力卻沒變?(詳見《襲擊南京的Delta毒株,和水痘一樣容易傳染,一人可傳八九人》)
病毒生存演化的方向應當是通過“優化”毒力“追求”更高的適應性,即病毒傳播係數R0的最大化,而所謂毒力的“優化”,可能是毒力增強,也可能是毒力減弱。對於某個病毒而言,自然選擇到底是增加還是減少病原體的毒力,具體取決於宿主、病毒和環境之間的特定組合。因此,病毒的演化不必然帶來病毒毒力的增強;新冠病毒變異株傳染性增強,也並不必然帶來毒性增強或減弱。
“種”之“滅”,病毒能消滅嗎?
傳染病是由病原體引發的,因此可以通過根除病原體來根除傳染病。事實上,人類也確實成功地消滅了一種可怕的傳染病:天花。1980年5月8日,第33屆世界衞生大會正式宣佈:“世界各國人民贏得了勝利,根除了天花”。消滅天花這一人類壯舉並非偶然達成,它的實現是一系列因素綜合的結果:
1. 病原體只感染人,沒有其他宿主或病毒儲庫。這就意味着只需要管好人就可以了,不需要處理難以控制的野生動物。
2. 感染後潛伏期短、發病快、症狀明顯。這意味着在監控傳染源的時候非常容易鑑別診斷,不會出現難以防範的“默默散播病毒” 的無症狀感染者。
3. 感染後自愈或接種疫苗後,可獲得強烈、持久的免疫保護。這意味着可以通過疫苗有效地防控該疾病。
4. 病原體可變性差。這意味着“天花病毒”這個病原體不會較快出現抗原性、抗藥性等突變,給現有的疫苗或藥物防控效果製造麻煩。
5. 教育、社會心理、政府決策、國際合作,等政治、經濟、社會條件。民眾瞭解、社會重視,決策正確,全球一致行動。
總結下來,天花就是一個人盡皆知、凶神惡煞、卻只有一招殺手鐧、不知變化的鐵憨憨。這種情況下,消滅病毒是可行的。
事實上,在與其他傳染病的鬥爭中,人類也獲得了極大的勝利,同時在消滅這些疾病的時候,因為某些原因,並未如期達成目標。例如脊髓灰質炎,目前仍然是阿富汗、巴基斯坦和尼日利亞的地方性流行病。世界衞生組織認為,只要還有一名兒童感染有脊灰病毒,所有國家的兒童就仍有感染該疾病的危險。
脊髓灰質炎病毒之所以沒有被清除,是因為其不符合上面提到的第二條和第四條——脊灰病毒感染後可能只引起輕微腹瀉而被忽視;弱毒活疫苗本身具有突變返強的能力。
人類在防治麻疹的過程中也獲得了重大的勝利,根據麻疹病毒的特性,它也是一種有望被人類消滅的病毒,但是其不符合第五條:人們對麻疹並不怎麼重視,畢竟多數情況下,麻疹不會引起嚴重的病症。
HIV和瘧疾極難清除,是因為疫苗研發困難,以及病原體變異性造成治療過程中的耐藥性。至於禽流感,則因為存在野生動物宿主,要消除它簡直難如登天。
非典型性肺炎SARS似乎已經銷聲匿跡了。這不禁讓人不禁聯想,新冠病毒能不能被清除呢?我們對照上面提到的5個條件來看一看:
1. 病原體只感染人?
看來並不是,新冠病毒可以感染除人以外的多種動物,但好在與人類接觸十分密切的馴化動物不會造成嚴重的傳染。
2. 感染後潛伏期短、發病快、症狀明顯?
並不是——感染新冠後,可能無症狀或輕症,這部分人羣難以檢測和管理,使疫病防控困難。
3. 感染後自愈或接種疫苗可獲得強烈、持久的免疫保護?
目前疫苗的有效性(主要是防止重症或死亡的保護率)得到檢驗和認可,但新冠病毒感染或接種疫苗之後的保護(不被再次感染的)效率及持續保護的時間還有待檢驗。
4. 病原體可變性差?
顯然新冠病毒的可變性很強。變來變去,防不勝防。
5. 教育、社會心理、政府決策、國際合作……等政治、經濟、社會條件能協作一致?
這一條在不同國家對抗疫情過程中有極其鮮明的對照,大家關注已久,應深有體會。
新冠病毒不是個蠻橫鐵憨憨,而是一個狡猾善變的滑頭鬼。那我們到底是該“消滅”它,還是該與它“共存”呢?這要看主觀上想不想,和客觀上能不能。
主觀上應該是“該消滅”,如果真有這麼一個溜光鋥亮的標語:“病毒也是生命,也有生存的權利”,這種病怕是沒治。客觀上能不能呢?就這種病毒來説,沒有先例,困難重重,但非絕無希望,且這個“希望”是相信的人越多,則希望越大(任何疾病的清除都需要全球合作)。
既然有希望,便做麼?這個就取決於權衡。譬如彩票,中獎是有概率的,代價似乎也不大,權衡之後,有人就去買,有人就不去買,這都很正常,但是如果中獎了,不管買不買,都羨慕。除中國外,世界上相當一部分人已經不得不被迫“與病毒共存”了。
我們能做什麼?短期不求在全人類中消滅新冠病毒,至少一省、甚至一國,在相當一段時間內是可以達到“清零”的。退一萬步講,消除病毒的路線不成功,最終發展成為“事實共存”(疫苗或藥物可用,病毒傳播、致死率下降,但並未消失),再調整策略也不遲。
“我”雖為人類,人類不必在“我”,人類當然可以與病毒共存,且正在與很多病毒共存,但我不想成為被新冠病毒檢驗的人類,我該戴口罩戴口罩,該打疫苗打疫苗,該配合防疫工作就配合防疫工作。畢竟以“消滅病毒”之態度,保住了“我”的性命,才談得上共存不共存。
參考文獻
[1] Sorensen, Roy (2003). A Brief History of the Paradox: Philosophy and the Labyrinths of the Mind. Oxford: Oxford University Press. pp. 4–11.
[2] Benton, Michael J.; Donoghue, Philip C. J. (2007-01-01). “Paleontological Evidence to Date the Tree of Life”. Molecular Biology and Evolution. 24 (1): 26–53.
[3] Benton, Michael J.; Donoghue, Philip C. J. (2007-01-01). “Paleontological Evidence to Date the Tree of Life”. Molecular Biology and Evolution. 24 (1): 26–53. doi:10.1093/molbev/msl150. ISSN 0737-4038. PMID 17047029.
[4] wikiwand.com/en/Species
[5] https://talk.ictvonline.org
[6] https://www.virology.ws/2009/05/10/the-error-prone-ways-of-rna-synthesis/
[7] https://meetings.ami.org/2020/project/sars-cov-2-rna-dependent-rna-polymerase-rdrp-and-remdesivir-mechanism-of-action/
[8] https://www.bbc.com/zhongwen/simp/science-57529842
[9] http://www.xinhuanet.com/2021-06/22/c_1127588313.htm