mRNA-1273 疫苗誘導的針對 SARS-CoV-2 變體的抗體的耐久性_風聞
观察员2号-2021-08-19 10:58
報告
mRNA-1273 疫苗誘導的針對 SARS-CoV-2 變體的抗體的耐久性查看 ORCID 個人資料阿瑪倫德拉·佩古1 , † ,莎拉·奧康奈爾1 , † ,查看 ORCID 個人資料斯蒂芬·D·施密特1 , † ,西吉·奧戴爾1 , † ,查看 ORCID 個人資料克洛伊·A·塔拉納1、賴麗琳2、吉姆·阿爾伯特3、查看 ORCID 個人資料埃文·安德森2、漢密爾頓·貝內特4、查看 ORCID 個人資料Kizzmekia S. Corbett1 , ‡ ,布里塔·弗拉克1、查看 ORCID 個人資料麗莎傑克遜5、佈雷特·利夫4、朱莉·萊傑伍德1、凱瑟琳·J·盧克6、馬可夫斯基3、查看 ORCID 個人資料瑪莎·C·內森1、查看 ORCID 個人資料保羅·C·羅伯茨6、查看 ORCID 個人資料馬里奧國王1、查看 ORCID 個人資料寶琳娜·A·雷博萊多7、查看 ORCID 個人資料克里斯蒂娜·A·羅斯塔德2、查看 ORCID 個人資料納丁 G. Rouphael7、衞時1、查看 ORCID 個人資料王令樹1、查看 ORCID 個人資料艾麗西亞·T·威奇1、查看 ORCID 個人資料恩聖陽1、mRNA-1273 研究組§ ,約翰·H·貝格爾6、巴尼·S·格雷厄姆1、約翰·R·馬斯科拉1、Mehul S. Suthar2、阿德里安·B·麥克德莫特1、Nicole A. Doria-Rose1 , *科學 2021 年 8 月 12 日:eabj4176DOI:10.1126/science.abj4176
抽象的SARS-CoV-2 突變可能會減弱疫苗誘導的保護性免疫反應,尤其是在抗體滴度隨時間減弱的情況下。在這裏,我們評估了 SARS-CoV-2 變體 B.1.1.7 (Alpha)、B.1.351 (Beta)、P.1 (Gamma)、B.1.429 (Epsilon)、B.1.526 (Iota)、和 B.1.617.2 (Delta) 在七個月內由疫苗 mRNA-1273 引發的結合、中和和 ACE2 競爭抗體。單次給藥後很少出現交叉反應中和反應。在對第二劑疫苗的反應高峯期,所有個體對所有變體都有反應。在 mRNA-1273 疫苗的主要系列接種後 6 個月內,針對變體的結合性和功能性抗體在大多數受試者中持續存在,儘管水平較低。在所有檢測中,B.1.351 的抗體識別率最低。
SARS-CoV-2 是導致 COVID-19 的病毒,它已感染了全球數百萬人,加劇了持續的全球大流行(1)。RNA病毒突變率、複製和重組在大量個體中的結合有利於具有提高的複製能力和傳播性以及免疫逃逸的病毒變體的出現。特別感興趣的是 B.1.1.7(20I/501Y.V1 或 Alpha)、B.1.351(20H/501Y.V2 或 Beta)、P.1(Gamma;首先在巴西發現)、B. 1.429(Cal20 或 Epsilon;首先在加利福尼亞發現)和 B.1.617.2(Delta;首先在印度發現);和 Variant of Interest B.1.526(Iota;首次在紐約發現)。在多項研究中,B.1.351 對恢復期或疫苗接種者血清的中和作用最具抵抗力,對使用基於 2020 年 1 月首次描述的病毒株(Wuhan-Hu-1 ,2 – 9)。大多數這些先前的研究在第一次或第二次接種後不久的時間點評估了接種個體的血清,並且關於此類反應持久性的數據有限。同樣,臨牀研究報告了對 B.1.1.7、B.1.351 和 B.1.617.2 變體的療效和有效性有所降低 ( 10 – 12 )。儘管此類數據為了解疫苗針對病毒變體的性能提供了重要見解,但它們尚未完全解決交叉反應結合和功能性抗體的耐久性問題。
在這裏,我們調查了 SARS-CoV-2 變體對接受兩劑 100 微克劑量的 SARS-CoV-2 疫苗 mRNA-1273 的個體的血清識別的影響。mRNA-1273 編碼 WA1 的全長穩定刺突蛋白,並以間隔 28 天的兩個劑量系列給藥。我們先前描述的結合和中和活性對抗WA1 SARS-CoV的-2穗上縱向7個月從第一次接種疫苗的志願者中由mRNA-1273疫苗(的第1階段試驗13 - 16)。在當前的研究中,我們證明了使用多種方法來評估 SARS-CoV-2 疫苗引發的對變異病毒的體液免疫的效用。我們測試了來自三個年齡組中每個 8 名志願者的隨機樣本的血清:18-55、55-70 和 71 歲以上,所有這些人都有四個時間點的樣本:第一次給藥後 4 周,以及第二劑後兩週、3 個月和 6 個月(分別為第一劑後第 29、43、119 和 209 天)。
使用三種功能測定和兩種結合測定來評估對 SARS-CoV-2 刺突蛋白的體液免疫反應。SARS-CoV-2 中和是使用基於慢病毒的假病毒測定和活病毒病灶減少中和試驗 (FRNT) 來測量的 ( 17)。第三個功能測定是基於 MSD-ECLIA(Meso Scale Discovery-電化學發光免疫測定)的 ACE2 競爭測定。該方法測量了 mRNA-1273 疫苗引發的抗體與標記的可溶性 ACE2 競爭結合點在 MSD 板上的特定 RBD(WA1 或變體)的能力。通過流式細胞術分析與細胞表面表達的全長尖峯結合的抗體。在 MSD-ECLIA 平台中通過干涉測量法測量與可溶性蛋白質的結合。在這些正交血清學檢測中的每一箇中,針對 WA1 和 B.1.1.7 和 B.1.351 變體對所有樣品進行了評估。此外,在兩種中和試驗中以及在細胞表面試驗中針對含有 D614G 突變的 WA1 對所有樣品進行了測試。如下在結合測定中測試了其他變體:S-2P和RBD結合,P.1 針對所有樣品;針對所有樣品的細胞表面尖峯結合,P.1、B.1.429、B.1.526 和 B.1.617.2。通過針對 P.1、B.1.429、B.1.526 和 B.1.617.2 的假病毒中和來評估樣本子集——第 43 天捕捉峯值響應,第 209 天觀察耐久性。每個測定中使用的特定序列在表 S1 中定義。
我們首先評估了抗體活性隨時間變化的模式。與測定一致,在單次給藥後(第 29 天)觀察到所有變體的低水平識別(圖 1)。針對所有變體的活性在第二次給藥後兩週(第 43 天)達到峯值,隨着時間的推移到第 209 天(圖 1)中度下降。值得注意的是,在每個樣本的基礎上為每個測定獲得的值彼此相關(圖 S1)。我們接下來評估每個變體的相對影響,同時考慮所有時間點。採用假病毒測定法,對 D614G 的中和活性最高,對 B.1.351 的中和活性最低,所有其他測試變體的值落在這兩個變體之間(圖 1A和圖 2A))。與我們小組 ( 15 ) 和其他人 ( 18 )之前的報告類似,D614G 的假病毒中和 ID50 比 WA1 高 3 倍(圖 2G)。相比之下,使用活病毒 FRNT 中和試驗(圖 1B和圖 2B),WA1 的滴度高於 D614G,與該試驗之前的報告一致(19)。對於所有其他變體,在活病毒和假病毒中和試驗中的影響是一致的:針對 B.1.1.7 的滴度與 D614G 相似,而針對 B.1.351 的滴度較低。WA1 RBD ACE2 競爭最高,B.1.1.7 中等,B.1.351 最低(圖 1C和圖 2C))。使用兩種不同的方法測量尖峯結合抗體。在細胞表面刺突結合測定中,血清抗體與轉染細胞表面的全長膜嵌入刺突結合,並通過流式細胞術進行測量 ( 20 )。在該測定中(圖 1D和圖 2D),WA1 和 D614G 幾乎無法區分,與 B.1.1.7、B.1.526、B.1.617.2 的結合降低約 1.5 倍,以及 2.4 至 3.0 倍減少對 P.1、B.1.429 和 B.1.351 的約束。我們還使用 MSD-ECLIA 多重結合測定同時測量 IgG 與穩定的可溶性刺突蛋白 S-2P(21) 和源自 WA1 和 B.1.1.7、B.1.351 和 P.1 變體的 RBD 蛋白。ECLIA 檢測顯示與變體 S-2P(圖 1E和圖 2E)和 RBD(圖 1F和圖 2F)蛋白的結合略有降低,結合從高到低的排序如下:WA1,B .1.1.7、P.1 和 B.1.351。圖2G中列出了每個測定中每個變體的總體效果,其顯示了WA1和變體或D614G和變體的值之間比率的幾何平均值。在所有測定中,與 WA1 或 D614G 相比,B.1.351 是導致滴度降低最大的變體。
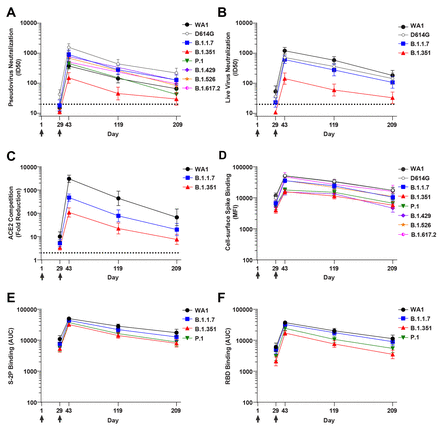 下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 1 結合和功能性抗體在 mRNA-1273 疫苗的第二劑後持續 6 個月。對於所有測定,在 4 個時間點對來自 n=24 個個體的血清進行採樣。在第 1 天和第 29 天(箭頭),個體接種了 100 μg mRNA-1273。符號表示幾何平均值;誤差線,95% 置信區間。( A ) 假病毒中和,表示為 50% 抑制稀釋 (ID50)。虛線,檢測限 (>20)。假病毒包括 WA1、D614G、B.1.1.7、B.1.351、P.1、B.1.429、B.1.526 和 B.1.617.2。( B ) 活病毒 FRNT 中和,表示為 50% 抑制稀釋 (ID50)。虛線,檢測限 (>20)。病毒包括 WA1、83E(尖峯是 D614G)、B.1.1.7 和 B.1.351。( C) ACE2 與 RBD 結合的競爭,通過 MSD-ECLIA 測量,並表示為與無血清對照相比,在有血清的情況下 ACE2 結合的減少倍數。虛線,檢測限 (>2)。RBD 蛋白包括 WA1、B.1.1.7 和 B.1.351。( D ) 結合到細胞表面表達的全長尖峯,通過流式細胞術測量並表示為中值熒光強度 (MFI)。峯值包括 WA1、D614G、B.1.1.7、B.1.351、P.1、B.1.429、B.1.526 和 B.1.617.2。( E ) 與可溶性刺突蛋白 S-2P 的結合,通過 MSD-ECLIA 測量並表示為曲線下面積 (AUC)。S-2P 蛋白包括 WA1、B.1.1.7、B.1.351 和 P.1。( F) 與受體結合域蛋白 (RBD) 的結合,通過 MSD-ECLIA 測量並表示為曲線下面積 (AUC)。RBD 蛋白包括 WA1、B.1.1.7、B.1.351 和 P.1。
下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 1 結合和功能性抗體在 mRNA-1273 疫苗的第二劑後持續 6 個月。對於所有測定,在 4 個時間點對來自 n=24 個個體的血清進行採樣。在第 1 天和第 29 天(箭頭),個體接種了 100 μg mRNA-1273。符號表示幾何平均值;誤差線,95% 置信區間。( A ) 假病毒中和,表示為 50% 抑制稀釋 (ID50)。虛線,檢測限 (>20)。假病毒包括 WA1、D614G、B.1.1.7、B.1.351、P.1、B.1.429、B.1.526 和 B.1.617.2。( B ) 活病毒 FRNT 中和,表示為 50% 抑制稀釋 (ID50)。虛線,檢測限 (>20)。病毒包括 WA1、83E(尖峯是 D614G)、B.1.1.7 和 B.1.351。( C) ACE2 與 RBD 結合的競爭,通過 MSD-ECLIA 測量,並表示為與無血清對照相比,在有血清的情況下 ACE2 結合的減少倍數。虛線,檢測限 (>2)。RBD 蛋白包括 WA1、B.1.1.7 和 B.1.351。( D ) 結合到細胞表面表達的全長尖峯,通過流式細胞術測量並表示為中值熒光強度 (MFI)。峯值包括 WA1、D614G、B.1.1.7、B.1.351、P.1、B.1.429、B.1.526 和 B.1.617.2。( E ) 與可溶性刺突蛋白 S-2P 的結合,通過 MSD-ECLIA 測量並表示為曲線下面積 (AUC)。S-2P 蛋白包括 WA1、B.1.1.7、B.1.351 和 P.1。( F) 與受體結合域蛋白 (RBD) 的結合,通過 MSD-ECLIA 測量並表示為曲線下面積 (AUC)。RBD 蛋白包括 WA1、B.1.1.7、B.1.351 和 P.1。
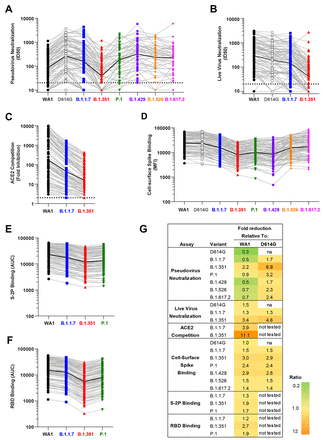 下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 2 每個 SARS-CoV-2 病毒變體的相對影響在不同的檢測中是相似的。符號顯示所有樣本在所有時間點的數據;淺灰色線連接來自每個樣本的變體數據;黑線顯示所有樣本的幾何平均值。所有病毒都採用顏色編碼,如圖 1 所示。( A ) 假病毒中和試驗中的 ID50。虛線,檢測限 (>20)。( B ) 活病毒 FRNT 中和中的 ID50。虛線,檢測限 (>20)。( C ) ACE2 與 WA1、B.1.1.7 和 B.1.351 的 RBD 結合的競爭,表示為與無血清對照相比,存在血清時信號的降低倍數。虛線,檢測限 (>2)。( D ) 結合到細胞表面表達的全長尖峯,表示為中值熒光強度 (MFI)。( E) 與 S-2P 的結合,表示為曲線下面積 (AUC)。( F ) 結合,表示為 AUC。( G ) 值比的幾何平均值。不,不適用。
下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 2 每個 SARS-CoV-2 病毒變體的相對影響在不同的檢測中是相似的。符號顯示所有樣本在所有時間點的數據;淺灰色線連接來自每個樣本的變體數據;黑線顯示所有樣本的幾何平均值。所有病毒都採用顏色編碼,如圖 1 所示。( A ) 假病毒中和試驗中的 ID50。虛線,檢測限 (>20)。( B ) 活病毒 FRNT 中和中的 ID50。虛線,檢測限 (>20)。( C ) ACE2 與 WA1、B.1.1.7 和 B.1.351 的 RBD 結合的競爭,表示為與無血清對照相比,存在血清時信號的降低倍數。虛線,檢測限 (>2)。( D ) 結合到細胞表面表達的全長尖峯,表示為中值熒光強度 (MFI)。( E) 與 S-2P 的結合,表示為曲線下面積 (AUC)。( F ) 結合,表示為 AUC。( G ) 值比的幾何平均值。不,不適用。
為了量化反應的廣度,我們計算了在每個測定和時間點保持可檢測抗體滴度的血清數量(圖 3)。在所有時間點的所有受試者中均檢測到與 WA1、B.1.1.7、B.1.351 和 P.1 序列的 S-2P 和 RBD 結合的抗體。同樣,在所有時間點都檢測到針對 WA1、D614G 和所有六種變體與全長細胞表面表達的尖峯結合。相比之下,功能測定揭示了變體的抗體識別缺陷。在假病毒中和試驗中,與我們之前的報告一致(13),在 1 劑後(第 29 天),25% 的血清中和了 WA1。83% 的第 29 天血清中和了 D614G,如上所述,它在該測定中比 WA1 更敏感;但 33% 的人中和了 B.1.1.7,只有 8% 的人可以中和 B.1.351。類似地,在活病毒試驗中,大多數第 29 天的血清中和了 WA1、D614G 和 B.1.1.7,但只有 8% 的血清中和了 B.1.351;在 63% 的血清中檢測到 ACE2 與 B.1.351 RBD 結合的競爭。雖然單劑 mRNA-1273 疫苗在第二次疫苗接種之前的間隔內提供了對 COVID-19 疾病的部分保護 ( 22 ),但 mRNA 疫苗 BNT162b2 也報告了類似的數據 ( 10 , 11)),這一觀察一劑後中和程度和廣度有限,強調了 mRNA 疫苗的完整兩劑方案對於預防 SARS-CoV-2 變體的重要性。
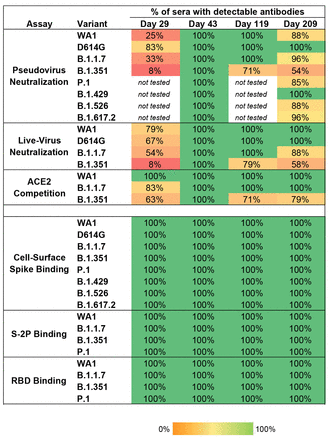 下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 3 所有個體都具有針對 SARS-CoV-2 變體的結合抗體,並且大多數個體在第二次接種疫苗後的六個月內保持了針對病毒變體的功能活性。對於每個變體,值是檢測到抗體的血清(每個時間點 n = 24)的百分比。對於假病毒和活病毒的中和,樣本在 ID50>20 處稱為可檢測;對於 ACE2 阻斷,與無血清對照相比,信號降低了 2 倍;對於 S-2P 和 RBD 結合,AUC>100;對於細胞表面尖峯結合,MFI>100。
下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 3 所有個體都具有針對 SARS-CoV-2 變體的結合抗體,並且大多數個體在第二次接種疫苗後的六個月內保持了針對病毒變體的功能活性。對於每個變體,值是檢測到抗體的血清(每個時間點 n = 24)的百分比。對於假病毒和活病毒的中和,樣本在 ID50>20 處稱為可檢測;對於 ACE2 阻斷,與無血清對照相比,信號降低了 2 倍;對於 S-2P 和 RBD 結合,AUC>100;對於細胞表面尖峯結合,MFI>100。
第二次給藥後兩週(第 43 天),所有血清都中和了所有假病毒。反應隨時間減弱:在該測定中,第二次給藥後 6 個月(第 209 天)的所有血清中和了 D614G 和 B.1.429,但中和其他變體的血清較少,分別為 88%、96%、96%、88%、 85% 和 54% 的血清分別中和 WA1、B.1.1.7、B.1.617.2、B.1.526、P.1 和 B.1.351。類似地,使用活病毒測定法,所有血清在第 43 天都對 WA1、D614G、B.1.1.7 和 B.1.351 有活性;在第 209 天,所有血清都中和了 WA1 和 D614G,88% 的血清中和了 B.1.1.7,58% 的血清中和了 B.1.351。此外,ACE2 競爭試驗顯示在較晚的時間點對 B.1.351 的活性降低(圖 3)。總的來説,功能測定顯示在單次給藥後或在第二次給藥後 6 個月後,對 B.1.351 和其他變體具有可檢測活性的血清頻率降低。重要的是,所有受試者在反應高峯時對所有變體都具有廣泛的交叉反應功能活性。因此,隨着時間的推移表現出免疫反應減弱的個體可能具有記憶 B 細胞,能夠在暴露於病毒的情況下對這些變體產生記憶性反應,或者可能使用額外劑量的疫苗。
為了瞭解個別突變對相關變體中提到的免疫逃逸的貢獻,我們針對 B.1.1.7、P.1 和 B.1.351 變體中存在的帶有 D614G 和 N501Y 的假病毒檢測了第 43 天的血清;Y453F,在貂簇找到5種變體(23,24); 和 N439K,它對某些治療性單克隆抗體具有抗性 ( 25 )。這些突變中沒有一個顯示對第 43 天血清中和的顯着影響(圖 S2)。相比之下,存在於 B.1.351、P.1 和 B.1.526 中的 E484K 顯着影響中和靈敏度,其幾何平均 ID50 低 2.4 倍(圖 S2)。
老年人對疫苗接種的免疫反應通常較弱 ( 26 )。我們之前表明,接種 mRNA-1273 疫苗在 56 至 70 歲和 71 歲及以上的受試者中引發了針對 SARS-CoV-2 WA1 的抗體,這些抗體與在 18-55 歲的成年人中引發的抗體一樣有效(15)和持久(13),中和活病毒的最老受試者的效力略有下降(13)。在這裏,我們觀察到在第 209 天,年齡最大的個體中針對 SARS-CoV-2 尖峯變體的滴度降低的趨勢,在某些變體的某些測定中具有輕微的統計學顯着差異。差異很小,組間有重疊(圖 S3 到 S5)。重要的是,最老組中的許多受試者在第二次疫苗接種後 6 個月仍保持對變異體的中和活性(圖 S5)。
恢復期的個體會發展出隨着時間的推移而成熟的 B 細胞譜系,從而增加他們對 SARS-CoV-2 變體的活性 ( 27 )。為了檢驗在接種 mRNA-1273 的個體中會發生類似現象的假設,對於每個時間點,我們計算了針對每個變體的活性與 WA1 的比率;然後我們比較了第 43 天和第 209 天的比率。對於 S2P 和 RBD,第 209 天的 WA1 與 B.1.351 結合的比率大於第 43 天,這意味着識別 B.1.351 的抗體衰減更快(圖. 4 ). 然而,對 ACE2 競爭抗體和針對 B.1.351 的活病毒中和觀察到了相反的效果。這也可以在圖 1 中看到,其中變體的點在第 43 天比在第 209 天對於 S-2P 和 RBD 結合更接近,但在活病毒中和中在第 209 天彼此更接近。對於 B.1.1.7 觀察到相同的模式。假病毒中和或細胞表面刺突結合隨時間沒有顯着差異。這些數據表明,雖然與變異體結合的抗體比 WA1 抗體衰減得更快,但變異體的功能性抗體可能減弱得更慢。
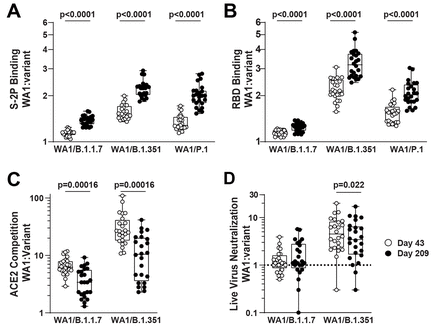 下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 4 病毒變異體的結合抗體比 WA1 抗體衰減得更快,但變異體的功能性抗體衰減得更慢。符號顯示每個樣品的 WA1 值除以指示變體的值。p 值:配對t檢驗。( A ) S-2P 綁定。( B ) RBD 綁定。( C ) ACE2 比賽。( D ) 活病毒中和。
下載高分辨率圖像 在新標籤頁中打開 下載幻燈片圖 4 病毒變異體的結合抗體比 WA1 抗體衰減得更快,但變異體的功能性抗體衰減得更慢。符號顯示每個樣品的 WA1 值除以指示變體的值。p 值:配對t檢驗。( A ) S-2P 綁定。( B ) RBD 綁定。( C ) ACE2 比賽。( D ) 活病毒中和。
mRNA-1273 引發的針對 SARS-CoV-2 變體的抗體活性在第二次給藥後持續六個月,儘管與 WA1 和 D614G 相比水平降低,在測試的最新時間點,超過一半的受試者保持對 B.1.351 的中和活性. 在這段時間內,所有受試者均保持高水平的結合抗體識別所有測試變體,包括 B.1.351 和 B.1.617.2。這些不同方法的結果在第一次接種疫苗後的 7 個月內也顯示出類似的動態。編碼 WA1 尖峯 (mRNA-1273) 或 B.1.351 尖峯 (mRNA-1273.351) 或兩者共同給藥的第三劑 mRNA 疫苗對抗體效力和廣度的影響目前正在調查中:28 )。雖然需要更多的研究來解決肯定會在病毒感染嚴重的地區出現的新變異的影響,但我們的數據令人鼓舞,在面對病毒變異時使用這種疫苗。