環境監測假陽性,為什麼難以杜絕?_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-09-04 12:41

撰文 | 李慶超(山東師範大學)
8月25日,北京中國科學院大學奧運村校區校園內環境監測樣本中發現一處點位為新冠病毒陽性,臨時封閉,全員核酸檢測後,未發現人員陽性。不久,校園重新開放。幸好,這只是一場虛驚。
這種在環境樣本監測中發現陽性樣本,但最後判定並非“真污染”的情況,類似於核酸檢測實驗室中發生的假陽性現象。當前,“人物同防”已成為我國疫情防控的重點,環境新冠核酸監測是常態化防控中不可或缺的環節。但是,環境監測屢屢出現“假陽性”,給疫情防控帶來了困擾。
環境中的核酸污染來源很多。今天,我們主要講講病毒基因擴增(如在核酸檢測中)等操作可能帶來的污染應怎樣防控。同時,也要問問,完全清除環境監測中的假陽性,是否能做到?我們要先從核酸檢測的原理講起。
1 病原體檢測
病原特異性檢測是最直接和有效的傳染病診斷方法。它可以給出特定病原體存在或不存在的證據,一般來説有三種檢測思路:
①直接觀測:直接觀測病原體本體的存在。例如用染色或培養觀察的方式來檢測細菌,用電鏡觀察病毒。這種方法常用於診斷感染或發現新病毒。
②組分檢測:並不直接檢測病原體本身,而是檢測病原體所含的特異性物質,來判斷其是否存在。比如,檢測到新冠病毒的部分特異性核酸序列,就能證明人體內存在新冠病毒。現在我們做的核酸檢測,就是採用組份檢測的思路。
③感染後果檢測:通過檢測病原體感染宿主造成的特異性後果來間接檢測病原體的存在,例如某些特徵性的損傷或病理反應,及免疫反應產生的特異性抗體引發的血清學現象等等。臨牀中常用的方法是檢測病原體的特異性抗體。這種方法操作簡單、無需特殊儀器,但是存在窗口期,僅能證明某人接觸過病原體抗原(可能是自然感染、也可能是疫苗注射)併產生了抗體,但不能知道體內是否有病原體。
2 核酸檢測
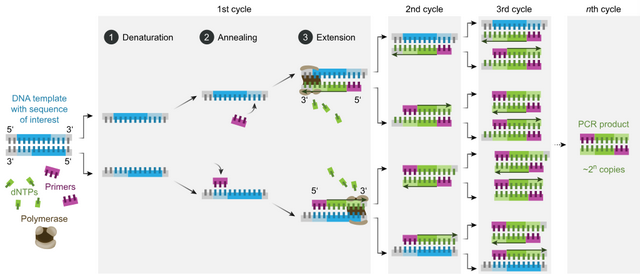
核酸檢測的本質是特異性引物指導下的特異性序列擴增和檢測,具有極高的靈敏性。它的原理是:1)設計使用特異性的核酸探針,2)該探針可以根據鹼基互補配對原則來結合特異性的病毒序列,3)並在聚合酶的幫助下進行DNA延伸擴增,4)在熒光物質的幫助下,5)通過檢測DNA擴增的結果來判斷是否存在特異性的病毒序列,從而證明是否存在病毒。其中非常重要的因素是特異性引物和模板。
世間生靈百態,都使用核酸(主要為DNA,RNA病毒為RNA)作為遺傳物質。遺傳信息就儲藏在長長的核酸分子的鹼基(DNA為A、T、C、G;RNA為A、U、C、G)的排序中。而你、我的差異,你我與病毒的差異都寫在這些由鹼基序列組成的遺傳信息中。病毒遺傳信息,也就是核酸鹼基序列(模板)的存在,就可證明病毒的存在。
探針或引物是一段短的(長度通常在20個鹼基左右)單鏈脱氧核糖核酸。可以根據鹼基互補配對原則( C≡G、A=T或 A=U),與其它核酸鏈進行配對。引物或探針的設計是檢測特異性病毒序列的關鍵,要在待檢測病毒獨有的序列上進行設計。我們以20個鹼基特定序列為例,隨機產生此序列大概需要4^20次方的隨機DNA序列(數據容量為1TB,而人類基因組信息約為3GB),再加上一對引物、並考慮擴增長度的限制,基本能夠達到特異性檢測的目的。與模板互補配對後,引物在DNA聚合酶的幫助下來合成DNA。而合成後的DNA又可以作為模板供下一輪引物結合,和DNA合成,如此一來,特定的DNA片段可以指數級的擴增,新產生的DNA鏈可在有限的循環內(一般為35-40)達到很高的量,足以被檢測。這種神奇的技術就是聚合酶鏈式反應(Polymerase Chain Reaction,PCR),而能夠實時監測擴增量的PCR稱為熒光定量PCR(qPCR),後者是實驗室最常用的病毒核酸檢測方法。
3 怎樣預防假陰性和假陽性?
檢測實驗的關鍵有兩個,一個是靈敏性、一個是特異性。通俗的説,靈敏性是指樣品裏“有”(陽性),檢測結果證明為“有”(陽性)的能力;而特異性,是指樣品裏“沒有”(陰性),檢測結果證明為“無”的(陰性)能力。
檢測實驗害怕的結果也有兩個,一個是假陽性,一個是假陰性。假陽性是指,本來沒有,檢測説是有;假陰性是指本來有,檢測説沒有。
一把寶劍,最鋒利處,恰是其最脆弱之處。PCR技術具有極高的靈敏性,同時也導致其極易產生假陽性。PCR或qPCR檢測的假陽性往往是由以往的PCR擴增產生的產物污染後續試驗樣本或檢測體系造成的,因為PCR擴增產物是同一對引物完美的模板。這是核酸檢測實驗室需要千方百計避免的惡夢。
1.合理的實驗室設計
根據衞生部 2010 年頒佈的《醫療機構臨牀基因擴增檢驗實驗室工作導則》,一個合格的臨牀基因擴增檢驗實驗室需要設置四個隔開的工作區域:
試劑儲存和準備區:貯存試劑的製備、分裝和擴增反應混合液的配製(最好在超淨工作台中進行)標本製備區:核酸(RNA、DNA)提取(視樣品情況可在生物安全櫃中操作)、 貯存及其加入至擴增反應管;擴增區:DNA 和 cDNA 的擴增及檢測(定量 PCR 分析), 巢式 PCR 測定的第二次加樣必須在擴增區進行擴增產物分析區:擴增片段的進一步分析測定(全自動核酸擴增 儀,如定量 PCR 儀時,產物分析區可以和擴增區合併)
進入各個工作區域必須嚴格遵循單一方向順序,通過傳遞窗傳遞樣品,氣流方向也要按照單一流向,要從潔淨區到污染區,可按照上述隔間順序空氣壓力遞減的方式進行,防止擴增產物隨氣流進入上游區域。其中標本製備區可設立正壓條件(製備區氣壓高於其他地區,外部空氣無法流入正壓區),避免從鄰近區進入本區的氣溶膠污染。
擴增區和擴增產物分析區是產生 PCR 產物氣溶膠的主要區域,所以可設立負壓條件(指該區氣壓低於外部,區域內的空氣無法流到外面),避免氣溶膠外泄。基因擴增實驗室通常用實驗室的相對正壓或負壓來控制氣流,如安裝排風扇、負壓排風裝置、空調通風系統等,最好採用全送全排方式,條件和空間允許的話,每個區域可設定緩衝區。

2.嚴格的實驗操作和管理
要做到準確檢測,光有合格的檢測實驗室還不夠,還需要嚴格培訓操作人員。人為因素(錯誤操作等)和操作人員本身(頭髮、皮屑等)的因素,在樣品製備、 PCR 擴增和 PCR 前 / 後的實驗操作中,都可能會引起氣溶膠污染。不規範的操作,可在移液器使用過程中、在PCR 儀使用中,或在 PCR 產物分析過程中引起污染。

進入實驗室的人員需受到嚴格的管控,進入前需進行嚴格的培訓。同時要特別留意非實驗室人員的進入和行為對實驗室的影響,例如清潔人員、儀器安裝和維修人員、物業人員等。這些人員不在培訓之列,但很難避免其進入,在實驗室維護和污染排查中應給予足夠的重視。
3.嚴謹的對照實驗
設置嚴謹的對照有利於監控試劑和環境,排查污染,避免重大的檢測結果偏差事故。主要的實驗對照有三種:
陽性對照:正常實驗條件下,陽性對照一定可以出現陽性結果。如果陽性對照出現陰性結果,表明本次實驗體系存在問題,那麼本次實驗中其他陰性結果是否為真是存疑的。因此,陽性對照一般用於監測試劑質量、儀器運行,是實驗體系一切正常的指標。
空白對照:是指用水代替模板 DNA 進行 PCR 反應,每次實驗都要進行空白對照。它能幫助我們確定 PCR 反應中所使用的溶液和試劑是否存在污染,幫助我們排除假陽性結果。如果空白對照出現陽性結果,則表示反應過程中存在交叉污染或者實驗室空氣存在污染。需結合環境對照結果,判斷污染源,如環境對照呈現陰性結果,就要儘快更換使用的溶液和試劑。
環境對照:又稱開管對照,用於確定實驗空氣中是否存在氣溶膠污染。在試劑準備、樣品製備、核酸製備和 PCR 擴增準備四個階段中,均需設置環境對照。該對照是在管中加入不含核酸的適量體積的水,在樣品測試整個過程中均敞開與空氣接觸,與樣品同時進行PCR反應。如果結果顯示陽性,那麼提示某個房間或者分區已經出現氣溶膠污染。
4.細緻地清除污染
在核酸檢測的過程中,即使完全按照規範操作,也無法避免樣品滴濺、擴散到操作枱等其他地方,因此,必須要日常消殺和清除DNA,避免污染。清除污染的工作主要包括:
消毒殺菌:每個實驗室都要進行。包括紫外線照射、異丙醇或酒精噴灑擦拭及高温高壓滅菌等方式。
降解DNA:用於實驗室DNA模板的降解。例如紫外線照射可以減少長片段DNA的污染,而用次氯酸鈉 (5-10%)、 甘氨酸-鹽酸緩衝液、鹽酸(1mol/L)清潔枱面、操作工具、樣品架、塑料及玻璃器皿,可以消除大部分DNA污染。
使用UNG-熱啓動Taq酶系統:該系統的工作原理是用脱氧尿苷三磷酸(dUTP)代替脱氧胸腺三磷酸(dTTP),從而產生dUTP標記的PCR產物。這一產物會在下一次PCR反應進行之前被尿嘧啶DNA-糖苷酶(UNG)降解,確保PCR擴增的全部是天然DNA,而不是含有dUTP的擴增模板DNA。
4 百密一疏的大環境污染
防治核酸檢測的各種污染,總體上來説是一個侷限於檢測實驗室內的問題。但也有不少專家撰文認為,大環境污染也會給核酸檢測和病毒篩查帶來假陽性。
所謂大環境污染,是指發生於實驗室外的環境或人羣之中的核酸污染。例如,各類分析顯示,疫苗的使用可能會讓非感染人羣接觸到病毒序列,從而在檢測過程中被檢測為陽性。滅活病毒疫苗、mRNA疫苗、病毒載體疫苗等含有病毒序列的疫苗中,都可以引發這類核酸污染;亞單位疫苗中殘存的核酸序列,也可能導致污染。
此種顧慮不無道理,但是治理和收益嚴重不匹配,筆者建議公眾不必放在心上。從治理上來説,疫苗生產很難做到100%清除病毒序列。而人體中存在大量的核酸酶,對外源物質具有很高的動態清理能力,即便疫苗中含有病毒序列,注射進入人體後也會被很快降解。萬一,萬一就是那麼倒黴,注射疫苗後短時間內去做核酸檢測,被報告為陽性,也可以通過二次檢測確認為陰性,排除感染嫌疑。
要説硬要去預防上述情況,可以考慮在PCR檢測引物設計時,將檢測位置設計在mRNA疫苗、腺病毒疫苗或亞單位疫苗中不存在的非結構蛋白編碼基因上,這樣可以規避上述疫苗中殘存的序列對病毒檢測造成的感染。這種方案不適合滅活病毒疫苗,因為滅活苗含有整個基因組。當然,也不是沒有辦法,理論上可以採用疫苗毒株與野毒差異的序列進行檢測。還是那句話,實在沒必要……(要説滅活病毒疫苗滅活不完全,或者弱毒疫苗返強造成的感染的檢測,這種極端的例子,交給專家,檢測公司幹不了這個活兒)。
安啦,大家散了吧。
等等,忘了説:醫療垃圾或實驗室垃圾需要特殊專業公司處理(按斤收錢幫你倒垃圾),如果相關機構違規處理,就有可能導致病原體泄露。那可是大大的壞,那就關門不要在業界混了。