重組耐藥卡介苗,治療耐藥結核病的強力助攻_風聞
中科院之声-中国科学院官方账号-2021-10-12 10:38
中華悠悠五千年的歷史長河,一直籠罩着結核病的陰霾,形形色色的人也是因為結核病失去了寶貴生命,比如武則天的兒子李弘如果不是疑死於結核病可能就不會有武則天當女皇帝。死於結核病的還有“一身詩意千尋瀑,萬古人間四月天”的中國第一位女性建築學家林徽因,“年十二,即讀畢四書及五經”且以國學大師著稱的劉師培教授,就連文學鉅著中“閒靜似姣花照水,行動似弱柳扶風”的林黛玉也居考據是因為結核病玉殞香消。
接種卡介苗是預防結核病的有效手段之一,但其對人體不能產生長期的保護,探索新的結核病治療方案是科研人員一直以來不懈追求的目標。近期,中國科學院廣州生物醫藥與健康研究院的一項最新研究成果,成功打破卡介苗輔助治療研究的瓶頸,成為治療耐藥結核病的強力助攻。
結核病是一種由結核分枝桿菌(Mycobacterium tuberculosis,簡稱結核菌)引起的慢性疾病,主要是通過氣溶膠的形式由呼吸道進行傳播。通常結核菌會使人肺部發病,即發展為肺結核。結核病的高發病率和高死亡率對公共衞生安全造成了嚴重的威脅。
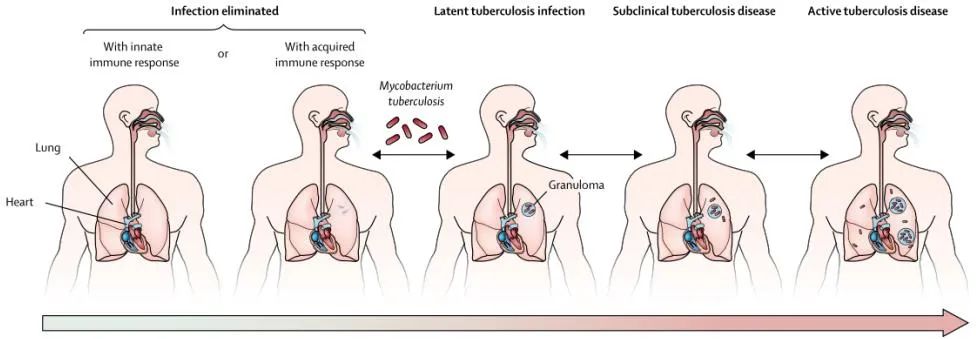
結核病的感染和傳播
世界衞生組織(WHO)發佈的《2020年全球結核病報告》指出,2019年全球共有約1000萬新發結核病患者,並且有超過140萬人死於結核病。特別是耐藥結核菌的出現給結核病的治療帶來了嚴峻的挑戰。結核病在世界範圍內均有發現,影響範圍極廣,尤其是在一些經濟落後、醫療衞生資源匱乏的地區,結核病發病率極高。全球有1/4的人是結核菌的潛伏感染者,結核菌潛伏感染者沒有任何症狀表現,但是通常約5%~10%的潛伏感染者最終會發展為活動性結核病。
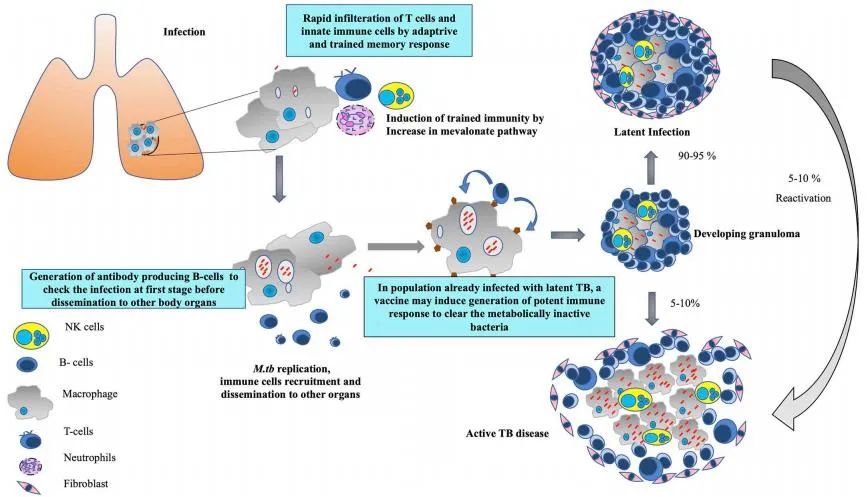
結核分枝桿菌的感染週期和感染過程
結核病可以通過注射BCG(Mycobacterium bovis bacille Calmette Guerin,簡稱卡介苗)進行預防,這種疫苗是100多年前科學家歷時13年,將牛型結核分枝桿菌經過不斷連續傳代獲得的減毒株。
在中國,建議新生兒在出生24小時後至3個月內接種卡介苗,接種後可能會在手臂接種位置出現紅腫甚至形成結痂,這都屬於正常的接種反應。卡介苗是世界上被使用人次最多的一種疫苗,安全性非常好,但是預防效果備受爭議。卡介苗對兒童腦結核具有持久的強效保護作用,並且可以防止嚴重播散性結核病的出現,但對預防肺結核,尤其是成人肺結核效果較差。卡介苗與人感染的結核菌非常相近,基因序列同一性超過99%。由於許多治療結核病的藥物也可以殺滅卡介苗,所以卡介苗不能作為治療性疫苗使用。
中國科學院廣州生物醫藥與健康研究院研製出治療性重組耐藥卡介苗(RdrBCG),即利用一種遺傳系統將選取的兩個基因整合到耐藥卡介苗(drug-resistant BCG, drBCG, 對某些結核藥物具有抗性的卡介苗)的基因組上,成功構建了能夠穩定表達外源基因的RdrBCG。這兩個基因一方面有利於RdrBCG的體內外生長,另一方面能夠誘發宿主對結核菌的殺傷作用。
通過連續5個月飼養接種了RdrBCG疫苗的重度免疫缺陷小鼠,發現小鼠沒有出現發病現象,更沒有死亡,説明RdrBCG安全性高。將定期接種RdrBCG疫苗與現有臨牀療法(幾種藥物合用)聯合使用治療感染結核菌的小鼠,發現接種了RdrBCG的小鼠脾和肺的菌載量明顯比對照組小鼠少(只進行藥物治療和/或接種了普通卡介苗的組為對照組),説明接種RdrBCG後可以產生持續協同殺菌的效果。同時對接種了RdrBCG的小鼠肺切片進行組織病理學研究,發現RdrBCG輔助治療耐藥結核還可以改善肺部病理,有望提高愈後的康復質量。此外RdrBCG在體內持續存在能夠幫助患者避免復發或降低因再感染而發病的風險。RdrBCG的研究成功打破了耐藥結核無治療性疫苗可用的僵局,為設計針對結核菌等難治病原菌的治療性疫苗提供了新的設計概念。
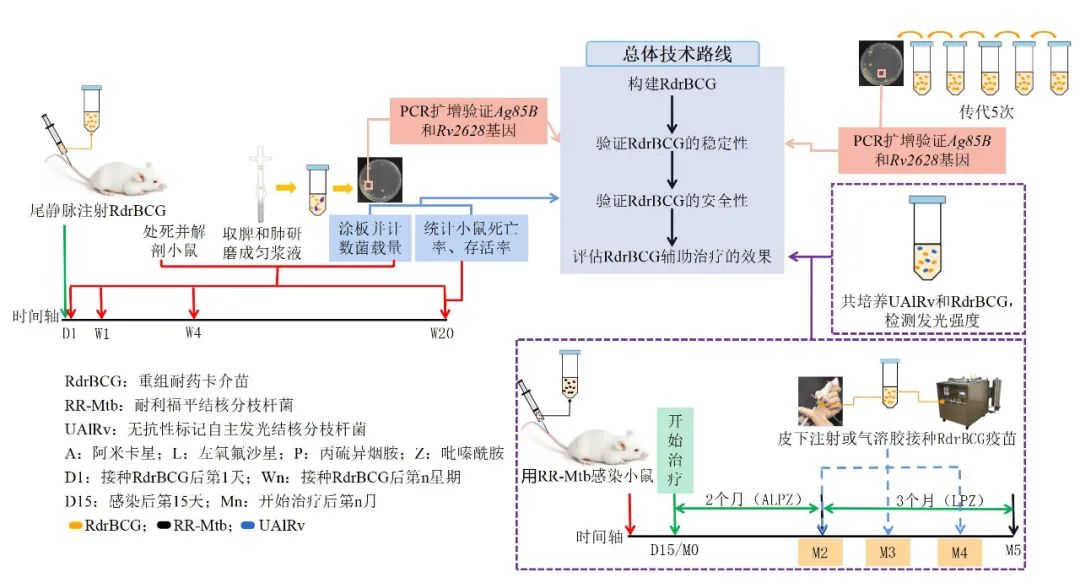
RdrBCG構建和體內外評估過程(作者繪製)
同時,還有一些問題急需進一步的探究:複發率是治療方案的評價指標之一,接下來將其作為長期藥物療法和RdrBCG聯合治療的評價指標。未來研究不僅只圍繞RdrBCG的輔助治療效果,還要挖掘RdrBCG對於耐藥結核病的預防效果,同時對於RdrBCG清除結核菌的分子機制進行研究。研究顯示性別差異是影響疫苗效果的因素之一,一般男性的免疫能力比女性的差,臨牀上大量研究也表明,結核病男性患者通常為女性患者的2倍。本次實驗中我們使用的是雌性小鼠,所以接下來還會使用雄性小鼠對RdrBCG疫苗的治療效果進行更進一步的探究與驗證。
對抗結核病不僅需要科學人員的深度研究,我們普通人也要力所能及,做好個人防護,及時通風換氣,不斷強身健體。每代人有每代人的責任和義務,每個時期有每個時期所面對的難題,我們必須有自強不息的精神和勇往直前的勇氣來對抗結核病。
參考文獻:
1. Bansal R, Sharma D, Singh R. Tuberculosis and its treatment: An Overview. Mini Rev Med Chem, 2018, 18(1):58-71.
2. Chiwala G, Liu Z Y, Mugweru J N, Wang B X, Khan S K, Bate P N N, Yusuf B, Hameed H M A, Fang C T, Tan Y J, Guan P, Hu J X, Tan S Y, Liu J X, Zhong N S, Zhang T Y. A recombinant selective drug-resistant M. bovis BCG enhances the bactericidal activity of a second-line anti-tuberculosis regimen. Biomed Pharmacother, 2021, 142:112047.
3. Fatima S, Kumari A, Das G, Dwivedi V P. Tuberculosis vaccine: A journey from BCG to present. Life Sci, 2020, 252:117594.
4. Furin J, Cox H, Pai M. Tuberculosis. Lancet, 2019, 393(10181):1642-1656.
5. Harisinghani M G, McLoud T C, Shepard J A, Ko F P, Shroff M M, Mueller P R. Tuberculosis from head to toe. Radiographics, 2000, 20(2):449-470.
6. Vynnycky E, Fine P E M. The natural history of tuberculosis: the implications of age-dependent risks of disease and the role of reinfection. Epidemiol Infect, 1997, 119:183-201.
7. WHO. Guidelines on the management of latent tuberculosis infection. 2015.
8. WHO. Global tuberculosis report 2020. 2020a. https://apps.who.int/iris/bitstream/handle/10665/336069/9789240013131-eng.pdf
9. WHO consolidated guidelines on tuberculosis. Module 4: treatment – drug-resistant tuberculosis treatment. 2020b. https://www.who.int/publications/i/item/9789240007048
10. LangeC, Aaby P, Behr M A, Donald P R, Kaufmann S H E, Netea M G, Mandalakas A M. 100years of Mycobacterium bovis bacille Calmette-Guérin. Lancet Infect Dis, 2021, S1473-3099(21)00403-5.
審核:張天宇
來源:中國科學院廣州生物醫藥與健康研究院