接種滅活疫苗後,新冠加強針可以選擇mRNA疫苗嗎?_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2021-10-22 20:51
鞏固我國“免疫長城”,使用不同類型疫苗進行序貫加強免疫,在提高免疫應答方面可能具有獨特的優勢。mRNA疫苗是序貫加強免疫策略中的優選疫苗。
隨着新冠病毒Delta變異株在全球肆虐及突破性感染問題日益凸顯,如何對我國現有的“免疫長城”進行鞏固顯得尤為重要。使用不同類型疫苗進行序貫加強免疫在提高免疫應答方面可能具有獨特的優勢。mRNA疫苗因在臨牀研究和上市後實踐中均表現出優越的預防新冠感染的效果,使其成為新冠疫苗序貫加強免疫策略中的優選疫苗。現階段,我國新冠疫苗接種以滅活疫苗為主,因此是否可能在完成滅活疫苗基礎免疫後使用mRNA疫苗進行序貫加強以增強免疫反應,是一個備受關注的問題。
今年9月18日在Journal of Medical Virology雜誌在線發表的一項土耳其真實世界研究1為這個問題提供了初步答案。這項研究顯示,與使用第3劑滅活疫苗同源加強免疫相比,在完成2劑滅活疫苗後使用BNT162b2 mRNA疫苗進行序貫加強接種誘導的IgG抗體水平為前者的27倍1。
序貫免疫策略為何可以誘導更好的免疫應答?土耳其序貫加強免疫研究的詳細數據如何?是否還有其他序貫免疫研究?序貫接種的安全性如何?本文將就這些問題作一介紹。
不同疫苗接種策略的概念
**疫苗替代:由不同廠家生產的相同技術路徑的疫苗在固定免疫程序上相互替代。**例如常規免疫程序中使用兩種不同品牌的滅活疫苗。
**加強免疫:使用同一款疫苗,在常規免疫完成後加強接種。**例如接種完成2劑滅活疫苗後,接種第3劑進行加強免疫。
**序貫免疫:不同技術路徑疫苗的間隔接種,包括基礎免疫序貫和加強免疫序貫。**例如完成2劑滅活疫苗接種後,接種1劑mRNA疫苗作為加強。
歐洲序貫免疫研究的啓示:
異源疫苗協同互補,1+1>2
目前全球獲批的不同類型疫苗各有特點,例如滅活疫苗和亞單位疫苗誘導的T細胞應答較弱,而腺病毒載體疫苗雖然可誘導T細胞應答,但中和抗體水平應答較低2。而mRNA疫苗既可以誘導強烈的體液免疫,又可以激活多表位T細胞免疫3。使用不同技術路徑的疫苗序貫接種有望通過不同機制之間的互補,增加免疫反應的強度、廣度和持久性,帶來更全面和強效的保護。
為應對疫苗供應波動和特定不良反應引起的接種策略變化,歐洲在今年較早時開展的異源接種研究主要關注了1劑腺病毒載體疫苗後序貫1劑mRNA疫苗的方案。這些研究為序貫接種方式的潛在互補作用提供了較直觀的證據。
例如英國隨機對照臨牀試驗Com-COV研究4顯示,接種第1劑ChAdOx1-S(ChAd)或BNT162b2(BNT)疫苗後28天(圖1上),兩種疫苗均誘導了初始免疫,ChAd疫苗組細胞應答水平較高,mRNA疫苗組體液應答水平較高(紅黃兩組位置偏上;綠藍兩組位置偏右)。在接種第2劑後28天(圖1下),ChAd/ChAd組細胞應答水平未進一步升高,ChAd/BNT序貫組(紅色)細胞和體液免疫應答水平均明顯升高,較其他組更有優勢(紅色組散點主要位於右上方)4。
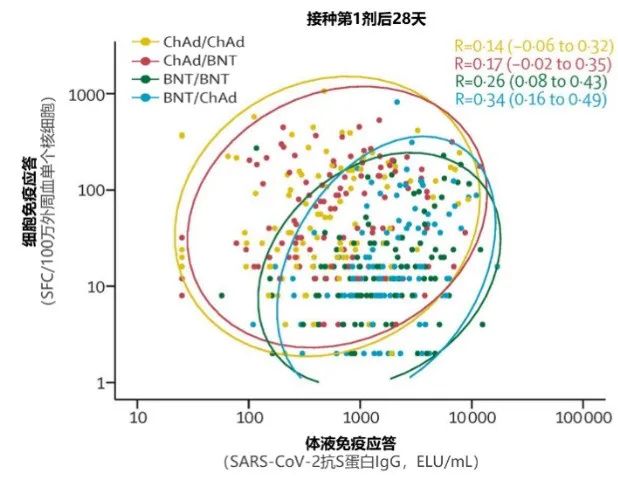
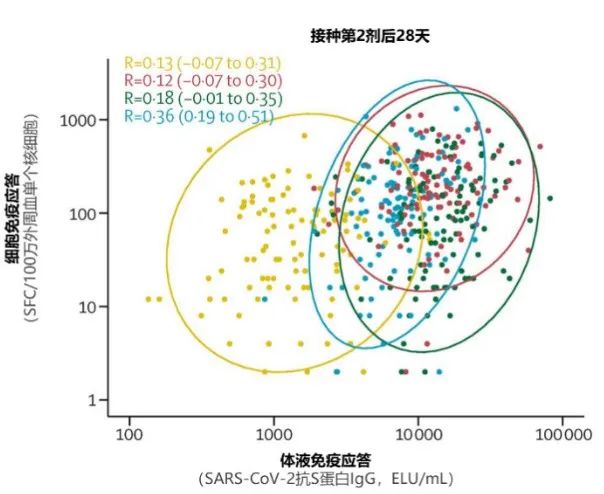
SFC:斑點形成細胞。採用ELISPOT方法,可通過檢測特定細胞因子(例如IFN-γ)分泌細胞(SFC)頻率,評估T細胞應答水平。
圖1(上、下) 不同腺病毒疫苗和mRNA疫苗接種方案下體液和細胞免疫應答的相關性4
由於存在潛在互補機制,與同源免疫相比,異源序貫接種方案可誘導更強的體液免疫和細胞免疫。其他在初始2劑時使用不同疫苗的研究5-7也得出了類似的結果。
真實世界研究:2劑滅活疫苗後使用mRNA疫苗序貫加強免疫可高效激活免疫應答
在完成2劑滅活疫苗初始免疫後一段時間再使用異源疫苗進行加強接種的方案更符合我國現狀。從原理上而言,滅活疫苗誘導的免疫反應以體液免疫為主,而mRNA疫苗則能同時強效激活體液免疫和T細胞免疫3,4,8,因此有望在滅活疫苗的基礎上提供高效的加強免疫效果。
最近發表的土耳其研究1首次為上述理論上的優勢提供了初步研究證據。
該研究納入45名已完成2劑滅活疫苗接種的Yeditepe大學醫院醫護人員。
-首先在第2劑接種後1個月時檢測抗體水平(2IVV組)。
- 然後在第2劑滅活疫苗接種後6個月左右,分為2組接種不同路徑的疫苗進行加強,並再次檢測抗體水平。
18例接種滅活疫苗作為第3劑(3IVV組)
27例接種BNT162b2 mRNA疫苗作為第3劑(2IVV+BNT組)
此外另納入23名未接種疫苗的醫護人員作為對照組。
研究1結果顯示,2IVV+BNT組受試者抗S蛋白受體結合域(RBD)IgG(IgG-S)水平明顯升高(圖2中示綠色圓點均位於右側)。3IVV組抗N蛋白IgG(IgG-N)水平較高(圖2)。
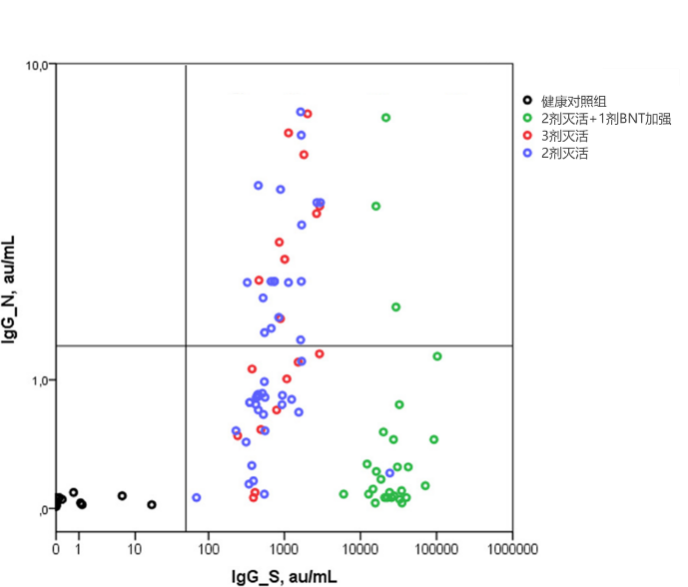
圖2 不同滅活和mRNA疫苗接種方案下的體液免疫應答1
這一結果是符合預期的。可以預防感染的中和抗體主要是針對S-RBD的抗體9,10,也因此基於蛋白設計的疫苗(包括mRNA疫苗、重組蛋白亞單位疫苗、腺病毒載體)均主要誘導針對S-RBD抗體。而滅活疫苗使用的原料為經滅活處理的全病毒,因此可誘導抗N蛋白抗體。而抗N蛋白抗體本身是一種與中和作用無關、特異性相對較低的抗體9,10。
在具體數據方面,滅活疫苗加強後IgG-S水平中位值為947.3 au/mL,較第2劑接種後升高1.7倍;mRNA疫苗加強後IgG-S水平中位值為25538 au/mL,較第2劑接種後升高46.6倍。加強後兩組之間IgG-S中位水平相差27倍1**。**
既然我們觀察到滅活-mRNA疫苗序貫接種可以強效誘導抗體應答,那麼對細胞免疫的影響如何呢?這方面目前數據有限,一項小樣本病例報告11顯示,2例完成2劑滅活疫苗接種後7個月、血清S蛋白結合抗體和中和抗體水平已降至基線水平的受試者,在接種1劑LPP-Spike-mRNA疫苗後抗S特異性體液和T細胞應答水平均明顯升高(圖3)。
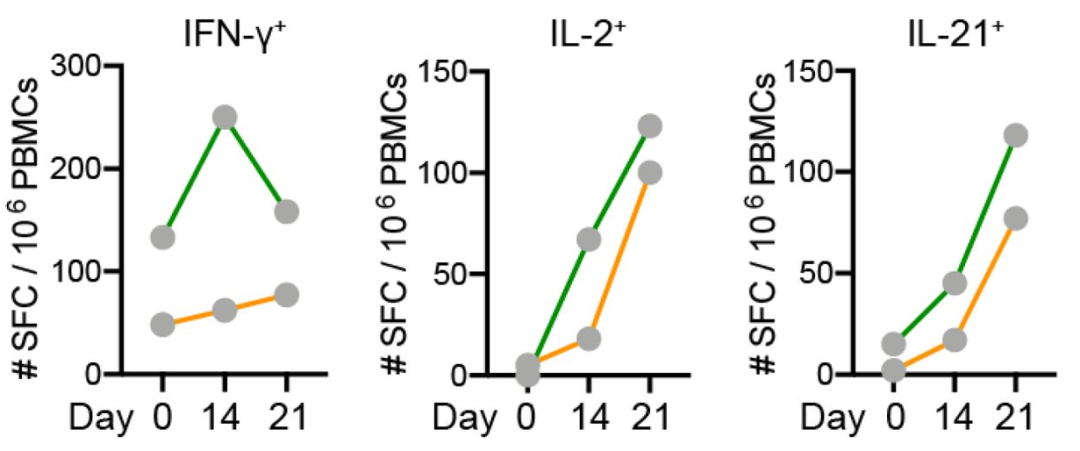
圖3 滅活-mRNA序貫接種後的抗原(S-RBD)特異性T細胞應答11
雖然目前受試者數量有限,但上述來自真實世界的研究數據均提示滅活-mRNA序貫是一種富有前景的免疫策略。今後關於此類策略的進一步研究證據,包括中和抗體和人羣保護力數據值得期待。
除mRNA疫苗以外,可同時誘導細胞免疫的腺病毒載體疫苗也是異源加強免疫的候選疫苗之一。最近一項江蘇省疾病預防控制中心開展的隨機對照臨牀研究12顯示,完成2劑滅活疫苗接種的受試者在3~6個月後序貫接種1劑Ad-5腺病毒載體疫苗,誘導的中和抗體水平明顯高於第3劑使用同種滅活疫苗加強免疫的受試者,為序貫免疫的優越性提供了進一步證據(圖4)。
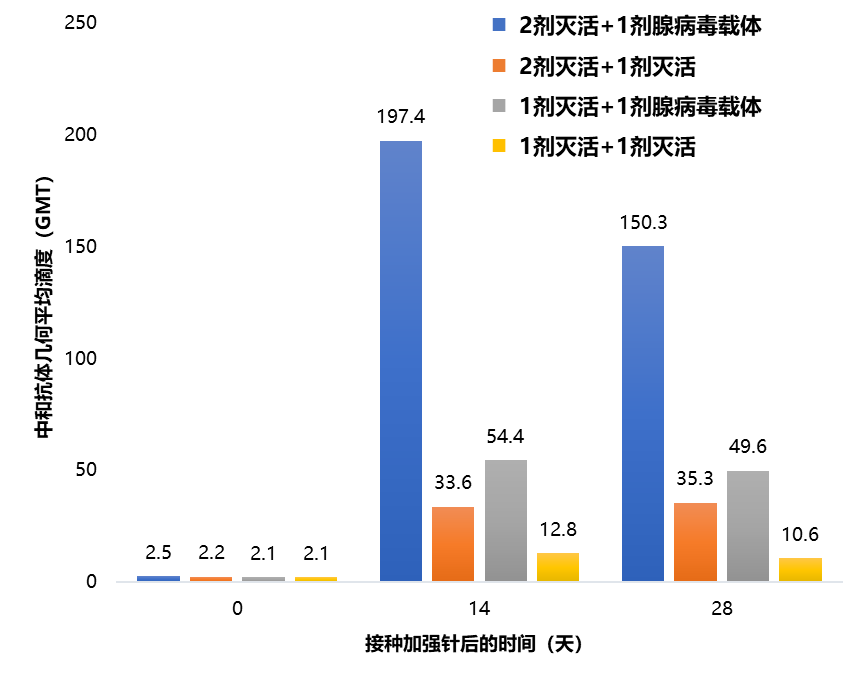
圖4 不同滅活疫苗和腺病毒載體疫苗接種方案下抗SARS-CoV-2活病毒中和抗體水平12
序貫免疫的安全性如何?
總體而言,序貫免疫方案的耐受性良好。前述滅活-腺病毒載體疫苗研究中接受序貫免疫的受試者局部和全身不良反應發生率有升高的趨勢12。Com-COV研究顯示接受序貫免疫的受試者全身不良反應發生率略有升高,但以輕中度為主,導致解熱鎮痛藥使用比例增高,並未導致住院13。也有研究顯示接受腺病毒載體-mRNA疫苗序貫接種和接受2劑mRNA疫苗接種的受試者不良事件發生率無明顯差異14。
總結與展望
現有研究數據顯示,滅活疫苗+mRNA疫苗序貫加強與同源加強免疫相比,可誘導更高效的抗體免疫應答。這一效果可能不僅來源於mRNA疫苗本身的強效免疫應答作用,還有可能源於不同技術路線疫苗之間潛在的協同互補作用。我國目前接種的新冠疫苗以滅活疫苗為主,完成2劑基礎免疫接種後疫苗的有效性隨時間推移不斷下降。滅活疫苗+mRNA疫苗序貫加強免疫策略研究數據的出爐,不僅為我國當前新冠疫苗免疫策略背景下更好地抗擊疫情、爭取儘快恢復常態帶來了希望,也為一些現實問題提供了數據支持,尤其是對於在高輸入風險地點工作的人員,或是由於工作、學習、交流需要,要到境外疫情高風險地區或國家的人羣,異源序貫加強免疫可能是一種較好的選擇。
目前還有更多研究正在進行中,例如香港大學正在開展的mRNA疫苗/滅活疫苗序貫研究等15。期待這些研究結果為未來免疫策略的調整和優化提供更多支持證據,幫助我們以更科學和合理的方法鞏固“免疫長城”,早日迴歸常態。
參考文獻
1. Keskin AU, Bolukcu S, Ciragil P, et al. SARS-CoV-2 specific antibody responses after third CoronaVac or BNT162b2 vaccine following two-dose CoronaVac vaccine regimen. J Med Virol 2021; doi: 10.1002/jmv.27350.
2. He Q Mao Q, An C, et al. Heterologous prime-boost: breaking the protective immune response bottleneck of COVID-19 vaccine candidates. Emerg Microbes Infect 2021; 10: 629–637.
3. Teijaro JR, Farber DL. COVID-19 vaccines: modes of immune activation and future challenges. Nat Rev Immunol 2021;21:195-197.
4. Liu X, Shaw RH, Stuart ASV, et al. Safety and immunogenicity of heterologous versus homologous prime-boost schedules with an adenoviral vectored and mRNA COVID-19 vaccine (Com-COV): a single-blind, randomised, non-inferiority trial. Lancet 2021;398:856-869.
5. Borobia AM, Carcas AJ, Pérez-Olmeda M, et al. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet 2021;398:121-130.
6. Groß R, Zanoni M, Seidel A, et al. Heterologous ChAdOx1 nCoV-19 and BNT162b2 prime-boost vaccination elicits potent neutralizing antibody responses and T cell reactivity. July 15, 2021 (https://www.medrxiv.org/content/10.1101/2021.05.30.21257971v2). preprint.
7. Hillus D, Schwarz T, Tober-Lau P, et al. Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1 nCoV-19 and BNT162b2: a prospective cohort study. Lancet Respir Med 2021; doi: 10.1016/S2213-2600(21)00357-X.
8. International Veterinary Vaccinology Network. COVID-19 vaccine: the eight technologies being tested. 2021(https://www.intvetvaccnet.co.uk/blog/covid-19/vaccine-eight-types-being-tested).
9. MacDonald A. COVID-19 Antibody Testing: S vs. N Protein. 2021(https://www.technologynetworks.com/diagnostics/blog/covid-19-antibody-testing-s-vs-n-protein-340327).
10. McAndrews KM, Dowlatshahi DP, Dai J, et al. Heterogeneous antibodies against SARS-CoV-2 spike receptor binding domain and nucleocapsid with implications for COVID-19 immunity. JCI Insight 2020;5:e142386.
11. Lin A, Liu J, Ma X, et al. Heterologous vaccination strategy for containing COVID-19 pandemic. May 23, 2021(https://www.medrxiv.org/content/10.1101/2021.05.17.21257134v1) preprint.
12. Li J, Hou L, Guo X, et al. Heterologous prime-boost immunization with CoronaVac and Convidecia. September 06, 2021. (https://www.medrxiv.org/content/10.1101/2021.09.03.21263062v1) preprint.
13. Shaw RH, Stuart A, Greenland M, et al. Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data. Lancet 2021;397:2043-2046.
14. Schmidt T, Klemis V, Schub D, et al. Immunogenicity and reactogenicity of heterologous ChAdOx1 nCoV-19/mRNA vaccination. Nat Med 2021;27:1530-1535.
15. Li Ka Shing Faculty of Medicine, The University of Hong Kong. Combination of mRNA and Inactivated COVID-19 Vaccines, a Prospective Cohort Study. 2021 (https://www.med.hku.hk/en/covid-19/vaccine/study/combination).