不願參與兒童臨牀試驗,她在事業巔峯放棄了科研 | 喪鐘何時鳴響_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-10-29 15:15
上一期《美國人最恐懼的病毒,疫苗研發失敗了 | 喪鐘何時鳴響(1)》講到,人類對脊灰病毒發起的第一次反擊失敗了。十年生聚,十年教訓,第一支安全有效的脊灰疫苗終於問世,試驗結果報告會盛況空前,萬眾歡呼。一支疫苗,將要改變多少孩童的命運,又影響了多少研究者的一生……
撰文 | 何笑松(加州大學戴維斯醫學院退休教授)
01 他山之石,可以攻玉
科爾默和布羅迪的脊灰疫苗臨牀試驗失敗之後,整整二十年間,沒人敢於再作同樣的嘗試。儘管如此,這期間其它病毒疫苗的研究,以及脊灰病毒領域其它工作的進展,為脊灰疫苗的最終誕生鋪平了道路。
詹納發明牛痘疫苗130年、巴斯德發明狂犬疫苗50年後,針對人類病毒的第三種疫苗問世,這就是黃熱病疫苗。黃熱病是一種通過蚊子攜帶的病毒傳播的急性傳染病,患者的肝臟受到損害,出現黃疸,黃熱病因此得名。由於病毒造成廣泛的內臟出血,因此又名病毒性出血熱。黃熱病的死亡率高達50%。1793年,美國當時的首都費城發生一次黃熱病大暴發,奪走了全城五萬居民中十分之一的性命。1853 年美國新奧爾良的黃熱病暴發更是造成30%的居民死亡。其恐怖程度,不下於近年來西非出現的另一種病毒性出血熱——埃博拉病毒出血熱。直到今天,黃熱病還流行於非洲和中南美洲的熱帶地區。
1930年代,紐約洛克菲勒研究所的病毒學家蒂勒(Max Theiler) 正在研究黃熱病毒。他發現來自病人的黃熱病毒可以在小鼠的大腦中生長複製,而經過鼠腦傳代培養的病毒可以在體外培養的雞胚組織中生長,並且,這些病毒失去了感染小鼠內臟器官的能力。既然病毒感染造成的內臟出血是黃熱病的主要臨牀症狀和致死原因,那麼不能感染內臟的病毒是否就可以作為疫苗使用?
但是,這些經過鼠腦傳代的病毒有個問題:它們感染腦組織的能力增強了——這對於疫苗來説顯然不是好事。蒂勒與他的同事們繼續探索,將病毒在多種不同的組織培養中連續傳代,試圖消除它們感染神經細胞的能力。到了1937年,他們發現,先將雞胚胎的中樞神經系統除去,然後切碎,用來培養病毒,在這樣的組織中連續傳代89次以後,得到了一個代號為17D的病毒變種,既不能感染內臟器官,也不能感染腦組織。而且這個變種的性狀穩定,即使在包含中樞神經系統的雞胚組織中繼續傳代培養,也不會恢復其感染神經組織的能力。
1938年,以17D病毒作為黃熱病疫苗的臨牀試驗在巴西進行,大獲成功。第一種安全有效的弱化減毒活病毒疫苗誕生了。蒂勒首創的方法——在組織細胞中連續傳代培養病毒,以降低其致病能力——後來被成功用於開發多種病毒性傳染病的減毒活疫苗。蒂勒因黃熱病疫苗的工作獲得1951年的諾貝爾生理學或醫學獎,成為迄今為止唯一因發明疫苗而獲諾獎的個人。提名蒂勒作為諾獎候選人的,就是他在洛克菲勒研究所的同事,後來研製成脊灰減毒活疫苗的沙賓[1]。
蒂勒在雞胚組織中培養黃熱病毒時,沙賓也想讓脊灰病毒在組織培養中生長。可是脊灰病毒不能感染雞胚。於是沙賓改用人的胚胎。他從3至4個月的流產死胎取得腦、肺、腎、肝、脾等不同組織,切碎後與脊灰病毒混合培養。結果發現,只有在神經組織中,脊灰病毒才能生長[2]。
沙賓的這項研究雖然實現了讓脊灰病毒在人或者動物體外的組織培養中生長,但對於研製疫苗卻沒有什麼實際意義。巴斯德用兔子脊髓製成的狂犬疫苗有一種副作用,發生的頻率雖低,後果卻十分嚴重:癱瘓甚至死亡。這是因為脊髓中的神經細胞軸突外包裹着一層護套,就像電線外面的絕緣層,這層護套的一個主要成分是髓鞘基質蛋白(MBP)。將含有MBP的疫苗注射到人體內,在罕見的情況下,會激發人體免疫系統對MBP的免疫反應,進而將自身神經組織中的MBP誤認為外來的入侵者,向它發起攻擊,神經組織受損後就造成癱瘓。這也就是巴斯德的狂犬疫苗後來被取代的原因。所以用於製造疫苗的原料不能來自神經細胞,以免被MBP污染。
02 最慷慨的諾獎得主
怎樣才能避免使用猴子脊髓,或者人類神經組織,而又方便地得到大量的脊灰病毒,用來製造疫苗?
解決這個問題的,是哈佛醫學院的教授安德斯( John Enders)和他的兩名研究生,韋勒(Thomas Weller)和羅賓斯(Frederick Robbins)。安德斯的研究興趣是在體外培養來自動物和人類的各種病毒。在他的指導下,韋勒曾經成功地培養了腮腺炎病毒。
1948年3月30日,韋勒和羅賓斯從一個流產死胎的手臂及肩部取得一些皮膚、脂肪和肌肉組織,剪碎後分裝到12個含有營養液的培養瓶中。他們當時正在嘗試培養水痘病毒,將病毒加進四個培養瓶中,另外四瓶不加病毒,作為對照。做完這些,還多出四瓶組織,沒有用處。就在此時,安德斯走進實驗室,看見兩個學生在做的事,就説:“我們冰箱裏有些脊灰病毒,要不要也試試?”於是那最後四瓶胚胎組織中就加了脊灰病毒。由於此前沙賓只能在神經組織中成功培養脊灰病毒,實驗室裏沒人指望這四瓶非神經組織中能出現什麼奇蹟。
此後每隔幾天,韋勒從培養瓶中取出一點培養液,檢查是否含有病毒。他失望地發現,加了水痘病毒的那四個培養瓶中,沒有病毒生長。那麼脊灰病毒情況如何?韋勒所用的脊灰病毒是一個能夠感染小鼠、使之癱瘓的變異病毒株。他將培養液稀釋後接種到小鼠體內,奇蹟出現了:小鼠癱瘓了!進一步實驗發現,在52天的傳代培養過程中,培養液中病毒總數增加的倍數達到10的16次方,這表明脊灰病毒不僅能在所培養的非神經組織中生長,而且複製的程度達到了極高的水平[3]。
此後,師生三人又發現,脊灰病毒還能在人和猴子的其它一些組織細胞中生長,包括來自猴子腎臟的細胞。這一發現的重大意義在於,從此以後脊灰病毒可以從體外培養的細胞中大量地產生,不再需要依靠接種活動物;所用的組織不包含神經細胞,因此不必擔心製成的疫苗含有MBP,引起癱瘓和死亡。
除此之外,羅賓斯還發現,體外培養的細胞被脊灰病毒感染後,在顯微鏡下可見細胞發生收縮,進而死亡。安德斯將這種細胞形態的變化命名為病毒的“細胞毒性效應”[4]。這表明只要用顯微鏡觀察所培養的細胞,就可以迅速判斷脊灰病毒的存在,而不再需要費時費力地將病毒注射到動物身上,等候癱瘓發生。
1954年,安德斯、韋勒和羅賓斯三人榮獲諾貝爾生理學或醫學獎,獎金三人平分。獲獎理由是“發現了脊灰病毒在多種組織培養中生長的能力。”是安德斯本人的堅持,使得他的兩個學生成為共同獲獎者。羅賓斯事後回憶道:“安德斯完全可以成為唯一獲獎者,所有的人,包括韋勒和我,都不會認為這有什麼不妥。三人共同獲獎完全是出於安德斯博士的慷慨大度,這正是他的偉大之處。”
03 首次疫苗研發為何失敗?
從1940年代初到1950年代初,美國的脊灰癱瘓發病率呈逐年上升之勢,從每年一萬例增加到近六萬例,直接或間接地影響到幾乎每一個美國人的生活。脊灰疫苗的研製刻不容緩。
然而,1931年的一項研究成果,為脊灰疫苗增添了一份不確定性。當年英國的一家病理學期刊上發表了一篇論文[5],標題是“不同脊灰病毒株之間的免疫學差異”。從每個病人身上得到的病毒通常稱為一株病毒。論文作者描述了他們的實驗:給猴子接種一株已知的脊灰病毒MV,也就是科爾默和布羅迪用來製作疫苗的同一株病毒,使猴子發病。恢復之後,再給猴子接種MV毒株,這一次猴子不再得病,因為猴子經過第一次感染後有了對脊灰病毒的免疫力——這是盡人皆知的事實,不是新發現——但後面的結果就不同了。
作者從一個1928年在澳大利亞死於脊灰的孩子屍體中取出脊髓,接種到已有免疫力的猴子身上,猴子又一次得病了!針對MV病毒的免疫力對這種澳洲的脊灰病毒無效!這一結果告訴我們,自然界中存在着至少兩種不同的脊灰病毒。
這篇論文的作者伯內特(Marcfarlane Burnet)和麥克納馬拉 (Jane Macnamara) 來自遙遠的澳洲,名不見經傳。他們的文章雖然發表了,得到的反應卻是信疑參半;直到1935年科爾默和布羅迪的疫苗試驗失敗後(詳見本系列第一篇),才逐漸受到重視。如果脊灰病毒感染後誘發的免疫力沒有交叉保護作用,以一種病毒製成的疫苗對另一種病毒無效,有效的疫苗就必須包括各種不同的脊灰病毒。
能引起癱瘓的脊灰病毒究竟有多少種?
答案直到二十年以後才完全揭曉。
04 巾幗雙雄
到了1940年代,脊灰病毒的病理學與免疫學研究終於進入快車道,取得一系列長足的進步。當時的病毒學界乃至整個科學界完全由男性主宰,女性研究人員寥寥無幾,出類拔萃者更是鳳毛麟爪。卻有兩位女性病毒學家,猶如夜空中一對明亮的雙星,以其驕人的研究成果令世人刮目相看。一位是耶魯大學的霍斯特曼(Dorothy Horstmann),另一位是霍普金斯大學的伊莎貝爾·摩爾根(Isabel Morgan)。
霍斯特曼從加州大學舊金山醫學院畢業,取得醫學博士學位。在醫學院學習期間,霍斯特曼對傳染病的研究產生了濃厚的興趣。1940年,她申請到範德堡大學醫院繼續接受住院醫生訓練,該院的醫學總監莫根(Hugh Morgan) 卻以她是女性為由不予考慮。幾個月後,由於沒有招到足夠人選來填充空缺, 莫根給霍斯特曼發去一信,詢問對方是否仍對範德堡的住院醫生職位有興趣。此時他已經忘了當初拒絕這位“霍斯特曼博士”的理由了。直到霍斯特曼接受了位置,報到就職以後,莫根見到了一位女士站在面前,這才大吃一驚!
霍斯特曼在範德堡順利完成了住院醫生訓練,於1942年加入耶魯大學醫學院的一個脊灰病毒研究團隊。當時的病毒學界已經知道脊灰病毒能在消化道複製,但只有在中樞神經系統的感染才造成疾病。然而對病毒是通過怎樣的途徑進入神經系統,卻不甚瞭然。流行的觀點是,病毒由口鼻進入人體到達鼻咽部,隨即經由嗅覺通道直接入腦[6]。
霍斯特曼與她的同事們研究的重點是脊灰病毒的傳播方式,包括兩個方面:一是病毒怎樣在人體內遷移,造成癱瘓,即病理學層面的研究;二是病毒怎樣在社區內擴散,造成疾病流行,即流行病學角度的研究。霍斯特曼對病毒經由嗅覺通道到達神經系統的主流觀念有所懷疑,因此進行了一系列探索,從脊灰病患體內不同的部位分別取得樣本,從中尋找病毒。她發現所有病人都能通過糞便排出病毒,説明腸道的確是病毒的主要繁殖場所。而在檢查血液樣品時,從111名病人採集的血樣中只有一份含有病毒,而且是來自一名未發生癱瘓的被感染者。
這個唯一的陽性結果看似一個偶然發生的例外事件。可是霍斯特曼沒有輕易放過這個 “例外”。她進一步用猿猴進行實驗。給猴子餵食脊灰病毒,第11天以後,猴子開始發生癱瘓。霍斯特曼從餵食病毒的次日開始,定期連續採集血樣,注射到其它猴子的脊髓中,觀察發生癱瘓的情況,以判斷血液中是否含有病毒。終於發現,只有在餵食病毒後的第4到6天,血液中含有能引起癱瘓的病毒[7]。
具體來説,病毒通過餵食進入猴子體內,先在腸道內繁殖擴增,從第4天開始,病毒進入血液。第6天以後,免疫系統開始產生針對病毒的抗體,釋放到血液中,與病毒結合, “中和”了病毒的感染能力,以當時的技術水平,也就不可能再探測到病毒的存在了。由於能在血液中測到病毒的間隔短暫,稍縱即逝,所以先前檢查的病人血樣99%是陰性。而霍斯特曼以其敏鋭的洞察力抓住了不及1%的“例外”,終於得到革命性的發現。受到這一研究結果的啓發,在被感染後發生癱瘓前的潛伏期病人血液中終於也發現了病毒。
霍斯特曼的研究推翻了脊灰病毒進入人體後直接由鼻咽到達大腦的錯誤觀念。進入體內的病毒是先在腸道繁殖擴增,然後才通過血液循環到達中樞神經系統,感染神經細胞,造成癱瘓的。其重要意義在於,如果在人體接觸病毒之前,利用疫苗誘導產生針對脊灰病毒的中和抗體,血液中有了這樣的抗體,就可能構成一道屏障,阻斷病毒感染神經系統的途徑,達到防止癱瘓的目的。
霍斯特曼的工作為脊灰疫苗奠定了理論基礎。而通過動物實驗為其提供佐證的,就是霍斯特曼的同齡人伊莎貝爾·摩爾根。
伊莎貝爾·摩爾根出生於一個科學家庭。父親托馬斯(Thomas Morgan)因闡明染色體在遺傳中的作用而獲得1933年的諾貝爾生理學或醫學獎,母親麗蓮(Lilian Morgan)也是著名的果蠅遺傳學家。摩爾根從斯坦福大學獲得博士學位後,首先到洛克菲勒大學研究病毒感染後的免疫反應,隨後於1944年加入了霍普金斯大學的一個脊灰研究團隊。她與同事通過猴子感染實驗,發現人羣中流行的野生脊灰病毒有三種,而不是兩種類型,每個病毒株感染後誘發的抗體只對同型病毒有保護作用[8]。
摩爾根最重要的工作是將當年布羅迪的嘗試[9]向前大大推進一步,用甲醛滅活的脊灰病毒作為疫苗,成功地防止了被脊灰病毒感染的猴子發生癱瘓。在此之前,雖然甲醛已被用來製造滅活流感疫苗,但在其它病毒疫苗則還沒有成功的先例。摩爾根試驗了不同的化學試劑,證明了甲醛能有效地殺死脊灰病毒。她先給猴子注射不同劑量的死脊灰病毒,測定猴子血液裏的中和抗體含量,然後給猴子注射同型活病毒, 觀察猴子發生癱瘓的比例。用這樣的方法,她確定了誘導產生保護性中和抗體所需的最低疫苗劑量,同時還發現只注射一次疫苗不足以誘發足夠的保護能力,只有重複注射幾次,才能充分保護猴子免於發生癱瘓。這也就是疫苗的增強接種,是摩爾根對疫苗領域的重要貢獻[10]。
甲醛滅活脊灰疫苗在猴子中試驗成功後,研製適用於人類的滅活疫苗就成為順理成章的下一步。誰來擔此重任?摩爾根成為眾望所歸的不二人選。但出人意料的是,由於脊灰疫苗最重要的保護對象是兒童,這就必然要涉及在兒童中進行一系列臨牀試驗,與此相關的各種風險和不確定因素,令摩爾根極為猶豫不安。最終,38歲的摩爾根選擇了急流勇退,在她的研究生涯達到巔峯的黃金歲月,於1949年離開了霍普金斯大學,隨同丈夫遷居外州,從此退出了研究第一線,將大部分時間精力用於相夫教子。同事們驚訝之餘,除了表示理解,無不為她惋惜。
1960年,49歲的摩爾根重返課堂,在哥倫比亞大學獲得生物統計學的碩士學位,隨後就為紐約一所癌症研究所提供諮詢服務,直到退休。
1958年,喬治亞州暖泉市建起了一道脊灰名人牆,牆上鑲嵌着17座青銅頭像,其中15座是對脊灰研究作出重大貢獻的傑出科學家,摩爾根(右七)是其中唯一的女性。另外兩座分別為在世時曾大力推動脊灰研究的羅斯福總統(右二),和他的一名得力助手奧康納(Basil O’Connor,右一)。
 美國喬治亞州暖泉市脊灰名人牆
美國喬治亞州暖泉市脊灰名人牆
當年因身為女性,連個住院醫生職位都差點得不到的霍斯特曼,後來成為耶魯大學醫學院有史以來聘任的第一名女性正教授(1961年),耶魯大學的第一名女性講席教授(1969年),並於1975年當選美國科學院院士。霍斯特曼終身未婚。去世後,她的肖像進入了耶魯大學醫學院的名人畫像廊,成為獲此殊榮的第一名女性。
霍斯特曼和摩爾根的成果為脊灰滅活疫苗奠定了基礎。摩爾根退出脊灰研究領域後,是誰接着跑完下一棒,最終研製成功人用滅活脊灰疫苗?
05 最後的接力
1947年,出生在一個俄國猶太移民家庭、年僅33歲的薩爾克(Jonas Edward Salk)來到匹茲堡大學醫學院就任副教授,急切地希望得到經費來啓動他的研究工作。當時在美國有一個全美脊灰基金會,負責籌集並掌管脊灰研究的專項經費。這個基金會是由美國歷史上最著名的總統之一,帶領美國走出大蕭條、贏得第二次世界大戰勝利的富蘭克林·羅斯福總統親自倡導成立的。羅斯福本人是個殘障人士,他在39歲時患病造成下肢永久癱瘓,被診斷為脊髓灰質炎(也有後世學者認為這可能是誤診,他的症狀更接近於吉蘭-巴雷綜合症,一種影響神經系統的自身免疫疾病)。薩爾克從這個基金會得到一筆資助,對脊灰病毒進行分型。雖然摩爾根等人已經根據脊灰病毒在猴子體內所誘發抗體的交叉保護能力,發現脊灰病毒有三種類型,但基金會認為,為了研發有效的疫苗,必須確保不存在第四型病毒。薩爾克的課題任務就是證實摩爾根等人的結果。
脊灰病毒的分型工作耗時、費力、枯燥,課題又是重複性的,缺少激動人心的創新之處,因此很少有人願意承擔。薩爾克帶領他的團隊,花了整整兩年時間,檢查了世界各地採集的250株脊灰病毒,用了近兩萬只猴子,終於證實脊灰病毒的確只有三種類型。最常見的Ⅰ型佔所有病例的80%,Ⅱ型和Ⅲ型各佔10%。脊灰疫苗只需要包含這三型病毒中的每型各一株,就可以預防所有的脊灰病毒感染。
雖然薩爾克只是證實了他人已有的結果,但他在這項課題中表現出來的充沛精力和專注精神,給脊灰基金會留下了深刻的印象。1951年,他從基金會得到了每年20萬美元(大約相當於今天的兩百萬美元)的大筆經費,用來開發脊灰疫苗。
薩爾克與他的團隊改良了安德斯的脊灰病毒體外培養技術,為生產脊灰疫苗提供原料。他選用猴子的腎臟細胞來培養脊灰病毒,並且用旋轉的玻璃試管代替靜止的培養瓶來培養細胞,提高了病毒的產量。薩爾克還用猴腎細胞培養來探測脊灰抗體。把血清和病毒混合後加入細胞中,如果血清中含有足量的抗體,細胞就可以存活生長;如果細胞被病毒殺死,則表明抗體不存在或量太少。在此之前,檢測脊灰抗體的唯一辦法是將血清和病毒混合後注射到猴子體內,觀察猴子是否發生癱瘓。
薩爾克從紐約大學醫學院畢業後,曾在密西根大學的弗蘭西斯(Thomas Francis)教授指導下從事博士後研究,用甲醛殺死乙型流感病毒,製成滅活乙型流感疫苗。現在,他決定採用同樣的方法制作滅活脊灰疫苗,這也就是當年布羅迪嘗試過、但沒有成功,後來由摩爾根用猴子模型證明確實可行的方法。通過他已完成的脊灰病毒分型研究,薩爾克知道哪一株病毒在細胞中的生長最旺盛,感染猴子以後誘發的抗體水平最高。他就根據這些標準,在三種類型脊灰病毒中的每型各選一株,作為疫苗的原料。
對最常見的Ⅰ型病毒,薩爾克選擇的是馬奧尼株,這是從俄亥俄州一個名叫馬奧尼的孩子身上分離得到的病毒。雖然這株病毒誘發的抗體水平高,但它的感染能力和毒性特別強,用來製作疫苗是否安全,後來引起了很大的爭議。然而當時薩爾克有他的道理:毒性弱的病毒誘發的抗體水平低,疫苗的保護效果可能不夠好;而且毒性強表示只要很少量的病毒就能使猴子癱瘓,萬一病毒沒有完全被甲醛殺死,疫苗中即使只含有極微量的活病毒,接種到猴子體內後也能被發現,這就提高了疫苗質量檢測的靈敏度,增加了產品的安全保障。
薩爾克在猴腎細胞中培養出病毒,置於冰水中,加入甲醛處理。然後每隔一段時間,取出一點樣品,注射到猴子腦部,觀察是否造成癱瘓。他發現甲醛處理大約十天以後,猴子就不再癱瘓,表明病毒已被殺死。為了確保安全,他把處理的時間再延長一至兩天。三株病毒中,最難殺死、需時最長的就是Ⅰ型病毒的馬奧尼株。
1952年,薩爾克開始對他的滅活疫苗進行初步試驗,所用的試驗對象是一百多名集中收養的殘疾和智障兒童。像這樣完全以弱勢羣體作為臨牀試驗對象,雖然違背今天的臨牀試驗倫理道德標準,但在當時的美國是普遍接受的做法。最初的試驗是摸索性質的:甲醛處理10天或者更長,三株病毒疫苗單獨或者混合注射,皮下注射或者肌肉注射,等等。得到的結果並不理想:雖然沒有發生嚴重的副作用,但是隻有Ⅱ型病毒疫苗誘發了脊灰抗體的產生,Ⅰ型和Ⅲ型疫苗完全沒有引起抗體反應。
為了增強疫苗激起免疫反應、誘導抗體產生的能力(即疫苗的“免疫原性”),薩爾克將疫苗與礦物油混合後再作肌肉注射。接種後的兒童對三株病毒疫苗都產生了高水平的抗體。礦物油的作用是延長疫苗在注射部位的肌肉中停留的時間,使免疫系統受到更充分的刺激。類似礦物油的疫苗輔助成分稱為疫苗的“佐劑”。目前臨牀使用的各種疫苗中,就有一些含有不同的佐劑。
礦物油佐劑的作用令薩爾克激動不已,覺得已經大功告成。1953年1月23日,薩爾克在一次會議上報告了他的結果。與會者對薩爾克取得的進展極為興奮,紛紛敦促他儘快開展大規模臨牀試驗。可是短暫的興奮很快就被失望取代。基金會內部有人認為,礦物油佐劑有可能造成難以癒合的膿腫和疼痛,用於兒童不夠安全,否決了使用佐劑的方案。儘管薩爾克對含礦物油脊灰疫苗的安全性深信不疑,在當年春季給他本人、他妻子和9歲、6歲、3歲的三個孩子都接種了這種疫苗,最後還是被迫放棄了佐劑,再尋求其它途徑來增強疫苗的免疫原性。
令薩爾克始料不及的是,嗅覺靈敏的媒體得悉他的疫苗初步試驗結果後,當即大肆宣告脊灰疫苗已經誕生。在飽受脊灰蹂躪,每日每時眼見兒童淪為脊灰犧牲品的公眾看來,發明疫苗的薩爾克就是拯救世界的英雄。薩爾克不得不在來自脊灰基金會和公眾輿論的雙重壓力下,設法儘快解決滅活脊灰疫苗免疫原性不足的問題。
1953年的3月到10月,薩爾克帶領他的團隊探索了一系列無先例可循的方案。他將用來滅活脊灰病毒的甲醛濃度從1/250降低到1/4000,處理的温度從0℃提高到37℃。為了掌握甲醛處理的時間長短,他通過反覆試驗,總結出殘餘活病毒量的對數與滅活時間二者之間存在線性關係。
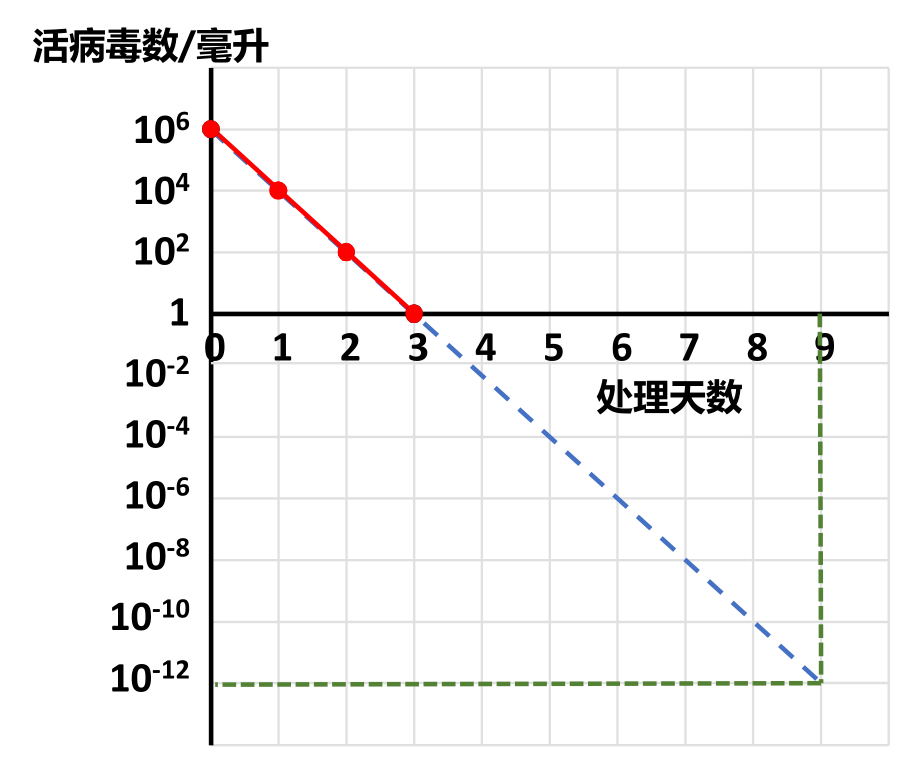 活病毒數量的對數與滅活時間的線性關係(作者作圖)
活病毒數量的對數與滅活時間的線性關係(作者作圖)
如上圖所示,假定造成感染所需的最低活病毒數為1(實際所需的數量可能遠遠大於1,但這不影響以下的分析),每一劑疫苗的體積為1毫升,其中所用的原料活病毒是100萬(106)個,經過甲醛處理24小時後,活病毒減少到1萬個,即原來的百分之一;48小時後,減少到100個,即萬分之一;處理72小時,即3天后,每毫升疫苗中就只剩下一個活病毒,是原來的一百萬分之一,其它病毒都被甲醛殺死了。此時將1毫升疫苗注射到猴腦或者加入培養的猴腎細胞,仍然會使猴子癱瘓,細胞死亡。在座標紙上以處理時間為橫軸,活病毒量的對數為縱軸,所標出的四個點形成一條直線[11]。
薩爾克推斷,在殘餘活病毒量的對數與滅活時間的線性關係保持不變的情況下,再處理3天后,每100萬毫升(100萬劑)疫苗中才會有一個活病毒。如果總的處理時間達到9天,那麼每1萬億(1012)劑疫苗中才能有一個活病毒,1萬億劑疫苗足夠給當年地球上的全人類每人接種400次,無論如何都應該算是絕對安全了。
到了1953年秋季,根據薩爾克所取得的進展,全美脊灰基金會認定大規模臨牀試驗的時機已經成熟。此前的1952年是美國有史以來脊灰疫情最嚴重的一年,全美國一共有58000人癱瘓,可是按人口比例來説則只佔0.03%。這就意味着,為了可靠地判斷疫苗究竟是否能有效地防止兒童患病,至少必須用幾十萬人來做接種試驗。薩爾克的實驗室可以生產足夠的疫苗供應幾百人的初步試驗,卻絕對應付不了幾十萬人的臨牀試驗所需。基金會只能依靠擁有足夠疫苗生產設備和能力的大藥廠。
基金會一共找到五家有意生產脊灰疫苗的美國公司,薩爾克的任務是將他的疫苗生產技術轉移到這些公司,協助公司實現量產。公司要求他提供大規模生產滅活脊灰疫苗的詳細工藝流程,包括專用設備的規格型號等等,可是薩爾克無法提供這些細節。在他看來,自己所能做的,就是儘可能清楚地解釋每一個步驟所涉及的原理,以及所要達到的目標。為此他準備了一份55頁的文件,其中包括有關殘餘活病毒量與甲醛處理時間線性關係的詳細説明;至於怎樣達到這些目標,則應由各家公司根據自身情況,制定出實施細則。但在公司看來,這無異於讓他們從零開始摸索,“每個批次的投產都像是一個研究課題。”
技術轉移的過程進行得很不順利。不止一家公司在擴大規模後生產的疫苗中含有活病毒。為了確保疫苗的安全,脊灰基金會規定,每家廠商生產的每一批次的疫苗都必須通過三次質量檢查,分別由生產廠家、薩爾克的實驗室、以及負責監管全美疫苗生產使用的國立衞生研究院(NIH)生物製品實驗室進行。除此之外,只有連續生產了11個批次的合格疫苗的廠家,才有資格為臨牀試驗提供疫苗產品。相互競爭的五家公司中,率先達到這條標準的,是生產疫苗經驗最豐富的派德( Parke-Davis)公司和禮來(Eli Lilly)公司。
06 “謝謝您,薩爾克醫生!”
1954年4月16日,舉國矚目的脊灰滅活疫苗臨牀試驗正式開始。當時的一項蓋洛普民意測驗表明,知道這次疫苗試驗的美國人數目,比能夠正確説出現任美國總統艾森豪威爾全名“Dwight David Eisenhower”的人還多。試驗設計為隨機雙盲法對照試驗, 42萬名兒童作為試驗組,接種派德或者禮來公司生產的疫苗;20萬名兒童作為對照組,注射安慰劑;另有120萬名兒童不接受任何注射,僅作為觀察對象。上午九時,弗吉尼亞州一名6歲的男孩第一個接受了注射。小朋友本人、他的父母、以及給他注射的護士,都不知道打進他上臂肌肉的是疫苗還是安慰劑。
參加這次試驗的是小學一至三年級學生,總數為182萬,是有史以來美國所進行過的所有醫藥產品臨牀試驗中規模最大的一次。試驗一共動用了美國48個州的2萬名醫生和衞生官員,4萬名註冊護士,1萬4千名小學校長,5萬名教師,以及20萬名義工。疫苗試驗組和安慰劑對照組的孩子每人在左臂三頭肌接受三次注射,前後歷時5周;作為獎勵,每個孩子得到一支棒棒糖,一個印着“脊灰先鋒”的紀念章,外加一次避免脊灰癱瘓的機會。
試驗的結果清楚地表明疫苗的保護作用:182萬受試者中當年共有16人死於脊灰,無一接種過疫苗;36人因患嚴重脊灰髮生呼吸衰竭,其中僅2人接種過疫苗;此外,未接種疫苗的兒童發生脊灰癱瘓的比例是接種了疫苗的孩子的3.3倍。
那麼疫苗的安全性如何?臨牀試驗中設置的注射安慰劑以及不接受任何注射的兩個對照組,有助於研究人員判斷接種疫苗引起的副作用。雖然在疫苗試驗組中也有少數脊灰病例,但都發生在社區中已有脊灰廣泛流行之後,癱瘓的部位不在接種的手臂,癱瘓發生的時間與接種的時間無關,説明癱瘓不是由接種疫苗引起的。這一結果令參加試驗的所有人員如釋重負。
臨牀試驗的總負責人就是當年薩爾克從事博士後研究時的導師弗蘭西斯。1955年4月12日上午,試驗開始的一年以後,弗蘭西斯在密西根州安娜堡的一座會議廳裏走上講台,報告試驗結果。台下的500名聽眾裏包括150家報社、電台、電視台的記者,聽眾席後面架着16台電視攝像機和電影攝影機,全美國有5萬多名醫生聚集在各地的電影院裏,通過閉路電視觀看會議實況。人們紛紛打開收音機,商場裏設置了大喇叭,法庭上法官暫時停止審判,人人屏聲息氣地聆聽弗蘭西斯的報告。
弗蘭西斯的報告歷時1小時38分。他用一台投影儀,逐一展示了一大堆枯燥無味的數據和圖表,最後終於迎來激動人心的結論:疫苗是安全有效的!當他結束報告,走下講台時,會場裏響起的掌聲多少還有幾分節制,會場外卻已是教堂鐘聲齊鳴,學校老師和學生家長喜極而泣,一家商店老闆在櫥窗中打起一條橫幅,上面寫着“謝謝您,薩爾克醫生!”
 薩爾克(1914-1995)
薩爾克(1914-1995)
弗蘭西斯之後的幾個發言人都表達了對疫苗簡短但熱情的讚譽。輪到薩爾克上台時,全場起立鼓掌,向他致敬。
但薩爾克對臨牀試驗的結果其實有幾分失望。他覺得疫苗還有改進的餘地,而且如果對接種的時間間隔做一些修改,產生的抗體水平也許會更高,維持時間更長,保護效果更好。於是他在發言中一五一十地説出了自己的不同觀點。但他沒有意識到,自己的發言與會場內外的氣氛格格不入,可以説是大煞風景,不合時宜。下台之後,連弗蘭西斯都惱怒地對他説,“你搞的什麼鬼,為什麼説那些話?難道你還想要百分之百的保護效率?”
第二天,《紐約時報》以“薩爾克脊灰疫苗的成功”為題,報道了安娜堡的這場新聞發佈會:“薩爾克疫苗試驗的正式結論……在一個更像好萊塢首映儀式、而不是醫學會議的場合,大張旗鼓地公佈了。”
出乎所有人的意料之外,僅僅過了半個月,薩爾克在安娜堡被戴上的桂冠,瞬間轉變為沉重的枷鎖。
(未完待續)
參考文獻
[1] Norrby E. Yellow fever and Max Theiler: the only Nobel Prize for a virus vaccine. J Exp Med. 2007; 204: 2779-84.
[2] Eggers HJ. Milestones in early poliomyelitis research (1840 to 1949). J Virol. 1999; 73: 4533–5.
[3] Enders JF et al. Cultivation of the Lansing strain of poliomyelitis virus in cultures of various human embyronic tissues. Science. 1949; 109: 85-7.
[4] Robbins FC et al. Cytopathogenic effect of poliomyelitis viruses in vitro on human embryonic tissues. Proc Soc Exp BioI Med. 1950; 75: 370-4.
[5] Burnet FM & Macnamara J. Immunological differences between strains of poliomyelitic virus. Br J Exp Pathol. 1931; 12: 57–61.
[6] Horstmann DM. The poliomyelitis story: a scientific hegira. Yale J Biol Med. 1985; 58: 79-90.
[7] Horstmann DM. Poliomyelitis virus in blood of orally infected monkeys and chimpanzees. Proc Soc Exp Biol Med. 1952; 79: 417-9.
[8] Bodian D et al. Differentiation of types of poliomyelitis viruses; the grouping of 14 strains into three basic immunological types. Am J Hyg. 1949; 49: 234-45.
[9] Brodie M. Active Immunization in Monkeys Against Poliomyelitis with Germicidally Inactivated Virus. J Immunol. 1935; 28: 1-18.
[10] Morgan IM. Immunization of monkeys with formalin-inactivated poliomyelitis viruses. Am J Hyg. 1948; 48: 394-406.
[11] Offit PA. The Cutter Incident: How America’s first polio vaccine led to the growing vaccine crisis. New Haven and London: Yale University Press, 2005.
注:本文所使用的圖片均屬於公有領域。