全球首款抗新冠病毒口服藥莫那匹韋,是天使,還是魔鬼?_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-11-17 11:56

如今,繼瑞德西韋之後,另一款抗新冠病毒口服藥莫那匹韋(Molnupiravir)已在英國獲批上市。同時,一款名為Paxlovid的口服新冠蛋白酶抑制劑也已在臨牀試驗中取得更為積極的結果。現在,人類治療新冠的醫藥武器庫中,又多出了兩件應對新冠病毒的有力武器。
新藥研發是人類最為複雜的科技活動之一。歷史上,一款新藥的誕生往往歷時十幾甚至數十年,花費數十億美元。那麼,這兩款新藥如何是在兩年之內就橫空出世的呢?
今天的文章將介紹全球首款抗新冠病毒口服藥莫那匹韋的誕生歷程。此後,“返樸”還將繼續詳細介紹另一款有望獲批的抗新冠病毒藥Paxlovid,敬請期待。
撰文 | 志言
2021年10月12日,美國製藥巨頭默沙東(Merck)與合作伙伴Ridgeback Biotherapeutics 公司正式向FDA提交了治療新冠肺炎COVID19 的口服抗病毒藥物莫那匹韋(Molnupiravir)在緊急狀況下使用的新藥申請[1]。當月早些時候,莫那匹韋的三期臨牀試驗中期結果公佈,顯示莫那匹韋在輕度至中度COVID19病人羣體中可以顯著降低住院風險與死亡率[2]。與服用安慰劑相比,服用莫那匹韋的病人住院或者死亡風險下降了50%;更令人印象深刻的是,服用莫那匹韋的病人組沒有死亡報告,而安慰劑組有8例死亡。在副作用方面,兩組沒有差異。
一個月後,當地時間11月4日,英國藥品和健康產品管理局(MHRA)已宣佈批准默沙東與Ridgeback公司合作研發的口服抗病毒藥莫那匹韋上市,用於治療輕至中度COVID-19成人患者。莫那匹韋成為全球首個獲批的口服治療COVID-19的抗病毒藥物。
毋需多言,COVID-19這場新型瘟疫在全球範圍內的大流行給全世界帶來了巨大的災難。截至發文(11/06/2021),全球感染總人數已達約2.5億,死亡人數超過了5百萬[3],因為各種防疫措施帶來的間接生命財產與經濟損失更是不可估量。可以講,我們每一個人都受到了其影響。
當人們從最初的慌亂中鎮定下來後,即開始運用科學的手段防禦自身,反擊疫情。近兩年來,從藥物治療到疫苗研發都取得了巨大的進步與勝利。在藥物治療方面,首先是去年(2020)開發出了抗新冠病毒藥物瑞德西韋(Remdesivir)。其次是以單克隆抗體為基礎的治療藥物也有多個產品證實了安全有效[4]。更為重要的是,以mRNA技術、重組失活DNA腺病毒、或者滅活病毒為基礎的新型新冠疫苗在不到一年的時間內橫空出世,在預防新冠感染(特別是重症與死亡)方面顯示了優良的安全性與有效性,這些疫苗也相繼得到了美國FDA或者其他多個國家或者地區監管機構的緊急授權或者正式批准[5]。
儘管如此,出於各種原因(如部分人羣抵制疫苗接種,藥物產能或療效不足,給藥途徑不便等等),新冠疫情仍在肆虐。在治療藥物方面,瑞德西韋以及單克隆抗體藥物雖然被證明安全有效,但是它們都有一個致命的缺點,就是需要靜脈或者注射給藥,大大限制了病人在醫院以外的應用,特別是在發病早期的使用。而我們知道,在病毒感染早期,當病毒處於大量複製繁殖的暴發期時,是抗病毒——特別是抗急性病毒感染的關鍵。因此,人們迫切需要一種安全有效的口服抗病毒藥物。這樣,在感染病毒的早期,就可以在醫院之外由病人自己服用。
莫那匹韋就是一款這樣可以口服的廣譜抗病毒藥物,可以抵抗引起COVID19的新型冠狀病毒。與瑞德西韋一樣,莫那匹韋也不是為新冠而生的,其誕生可以追溯到數十年以前。
發源之地
埃默裏大學(Emory University )是坐落在美國喬治亞州亞特蘭大市的一所久負盛譽的私立大學,在美國與世界新聞報導(US news and World Report) 的大學排行榜裏,2020年排名第21位,有南方哈佛之稱。自上世紀七十年代以來,Raymond Schinazi 與Dennis Liotta 教授一直在該校任教,從事藥物化學以及抗病毒藥物的研究。他們一系列的工作為現在廣泛應用的一系列口服抗病毒藥物(初期主要是抗艾滋病藥物)奠定了基石,他們也是十幾種FDA批准的抗病毒藥物的主要發明者,其中就有乙肝抗病毒藥物拉米夫定(lamivudine,中文商品名“賀普丁”),以及HIV緊急阻斷藥物舒發泰(Truvada)的主要成分之一恩曲他濱(Emtricitabine) 。
正是這些藥物的廣泛應用,將HIV感染引起的艾滋病由致死性疾病變成了可以控制的慢性傳染病,讓人們不再談“艾”色變。另外,由Schinazi和Liotta作為主要創始人而成立的法莫賽特公司(Pharmasset Inc.),開發出了能夠將HCV引起的丙型肝炎功能性治癒的索非布韋(sofosbuvir) [7],創造出了現代藥物發現史上的一段傳奇。2011年,吉利德科學(Gilead Sciences)以110億美元的價格收購了法莫賽特。除此之外, Schinazi 與 Liotta或合作、或獨立創建了Triangle Pharmaceuticals, Idenix, RFS Pharma 等公司,其中Triangle 也於2003年被吉利德科學以約5億美元收購, Idenix 則於2014年被默沙東(Merck)以40億美元收購。當然,這些藥物的成功及商業併購也為這兩位教授以及埃默裏大學帶來了巨大的聲譽與財富[8]。
上述這些抗病毒藥物都有一個共同點:它們都是核苷類似物,它們的作用靶點都是病毒合成必須的、以RNA為模版的、 病毒基因組編碼的RNA或者DNA聚合酶。其作用原理是:與內源性的核糖核苷酸或者脱氧核糖核苷酸競爭,抑制或者破壞病毒的複製,達到消滅病毒、治療疾病的目的。
深厚的底藴與研究經驗以及商業轉化上的成功,一方面讓這兩位教授與其他同事在埃默裏大學的實驗室積累了大量的、與核苷類似物相關的化合物庫以及篩選手段和工具;另一方面,也促使埃默裏大學成立了兩個下屬新藥研發部門——埃默裏藥物開發研究所(Emory Institute of Drug Development, EIDD) 與埃默裏藥物創新企業(Drug Innovation Venture at Emory, DRIVE)。這兩個機構的現任領導除了Dennis Liotta 教授,還有另外一位與埃默裏大學頗有淵源的George Painter 博士 , Painter 博士也是一位藥物化學家,他的本科與博士學位都是在埃默裏大學獲得,也是一位成果斐然,廣受尊重的學者型領導者[9, 10]。
因緣際會
委內瑞拉馬腦炎病毒(Venezuelan equine encephalitis virus, VEER)是曾經在南美委內瑞拉、哥倫比亞等國家暴發的一種主要由蚊子傳播的RNA病毒,可以感染馬類與其它哺乳動物(包括人類)。在上世紀冷戰時期,它甚至被當作是一種由空氣傳播的候選生物武器[11]。
人類感染VEER後,雖然大部分為無症狀感染且可以自愈,但是一旦病毒侵入大腦與神經系統,往往是致命的。因此,需要開發一種針對VEER的強效抗病毒藥物,可以口服,並且易於通過血腦屏障。由於RNA病毒需要RNA依賴性的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)進行繁殖與複製,而哺乳動物沒有這種酶,所以這種酶自然而然就成為篩選抗RNA病毒藥物的靶點——因為它比較容易達到藥物開發中的選擇性,從而避開影響體內正常蛋白帶來的副作用。歷史上,人們也篩選出了許多成功的RdRp抑制劑,包括上面提到的抗丙肝病毒的索非布韋,而這些藥物都是核苷類似物或者其前體藥物。
鑑於VEER的潛在威脅性,Painter博士在2013年成立了一個課題組,致力於尋找抗VEER的抗病毒口服藥。通過篩選積累的核苷類化合物庫,他們很快就發現一種名為“N4-hydroxycytidine ”的核苷類化合物,編號EIDD-1931。雖然EIDD-1931顯示出良好的體外體內抗RNA病毒活性,但是在靈長類動物中口服吸收不佳,主要是在腸細胞內可以被迅速代謝。為了改善這一點,EIDD-1931的前藥形式被設計出來,這就是EIDD-2801,也就是Molnupiravir ,中文名“莫那匹韋”(圖1)。進入血液循環後,莫那匹韋首先被代謝為其活性形式EIDD-1931,後者在細胞內被激酶進一步轉化為三磷酸的形式,從而發揮作用[12]。
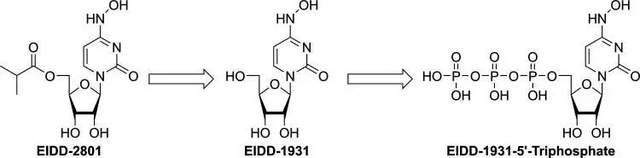
由於自然界的RdRP具有同源性,因此莫那匹韋最初是被作為一種廣譜的抗RNA病毒藥物來開發的。自2013年以來,人們相繼證明了它對流感病毒(influenza)、冠狀病毒(Coronavirus)、呼吸道合胞病毒(RSV)及埃博拉(Ebola) 病毒的優良抗病毒活性[12]。
也許是出於商業與應用的考慮,埃默裏大學下屬的兩家新藥研發部門EIDD和DRIVE逐漸將莫那匹韋作為一種抗流感病毒的候選藥物來開發。2020年1月初, J.P.摩根健康產業投資者大會在美國加州舊金山召開,彼時COVID19尚未在全球流行開來,Painter博士是帶着莫那匹韋抗流感的計劃書參會的。
會議中,Painter遇到了Ridgeback Biotherapeutics 公司的CEO,Wendy Holman女士。Ridgeback的宗旨與目標是開發藥物來治療目前缺乏有效治療手段的嚴重疾病,其最為人們熟知的壯舉就是開發了治療埃博拉病毒感染的藥物Ebanga。因此,當Wendy從Painter處瞭解到莫那匹韋的廣譜抗病毒活性時,兩人一拍即合,約定會後繼續商談。
J.P.摩根大會結束後不久,COVID19危機逐漸顯現,Wendy 與Painter博士立即意識到了莫那匹韋的重要性與面臨的機會,開始全力以赴,轉向將莫那匹韋開發為治療Covid-19的口服藥物。
初戰告捷
前文講到,莫那匹韋的作用靶點是RNA依賴性的RNA聚合酶(RdRP),因為新冠病毒(SARS-CoV2)也是RNA 病毒,其複製與繁殖也是依賴於RdRp,而自然界中的RdRp有同源性與相似性。因此,不出意外,莫那匹韋很快就被證明對新冠病毒有優良的體外與體內抗病毒活性[13-15]。與瑞德西韋等核苷類似物相似,莫那匹韋在體內的代謝活性物質EIDD-1931也是以假亂真,假冒核苷酸被RdRp接入到被合成的病毒RNA長鏈中。(關於瑞德西韋的作用機制,詳見《吉利德傳奇:“人民的希望”如何面對歷史的考驗》)
但是,與瑞德西韋假冒腺苷酸(ATP)不同,莫那匹韋假冒的是胞苷酸 (CTP)被摻入到病毒RNA基因組中(圖2)。更為重要的不同點是,瑞德西韋接下來可以與RdRp結合,“卡住”裝配線,導致RNA長鏈合成立即終止。而莫那匹韋則可以讓合成與複製繼續下去,但是在下一輪的RNA合成與複製中它比較馬虎,不負責任,不但與應該配對的GTP配對,也能與不該般配的ATP配對,這樣首輪複製在病毒基因組會產生G到A突變。另外由於C到G,G到M,M到A,A到U的轉換,經過兩輪複製後在病毒基因組也會產生C到U的突變(圖2)。這樣,在病毒的複製過程中,就會在病毒RNA基因組內產生大量的突變,導致其“癱瘓”,產生不了有功能的蛋白質,複製功能喪失,從而達到抗病毒的目的。
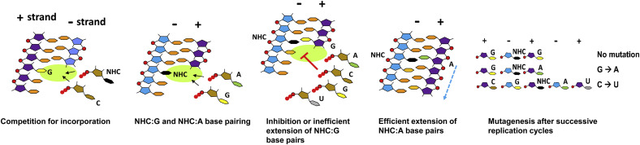
作為一個已經被廣泛研究的前體藥物,莫那匹韋的作用原理、生物利用度以及體內代謝已經在之前的抗流感與馬腦炎病毒等適應症上得到闡明,因此,其臨牀前藥理學毒理學數據在COVID19暴發之前已經相對完善。
為了獲取足夠的研究經費,埃默裏大學下屬的DRIVE/EIDD兩家機構在2020年初向美國生物醫學高級研究與發展局(BARDA)等聯邦政府機構提請對莫那匹韋進一步研發的資助。同時,由於疫情蔓延,全世界也迫切需要能對抗新冠病毒的治療藥物與疫苗,因此各聯邦政府機構廣開言路,邀請科研機構與生物製藥公司提交抗病毒方案與申請書。但是,BARDA當時的負責人Rick Bright對莫那匹韋的安全性有所保留(下文會講到),因此並未立即資助,而是要求DRIVE/EIDD提供進一步的毒理資料,特別是關於其致畸性的資料(後來,Bright 博士自認因此被特朗普政府解除在BARDA的領導職位,並提交了申訴信,包括《科學》雜誌在內的各大媒體也曾廣泛報道[17]) 。
不過,FDA很快也注意到了莫那匹韋,在2020年2月時要求EIDD/DRIVE提供所有關於該藥抗新冠病毒的資料。經過與FDA的溝通與討論,DRIVE/EIDD在3月份決定遞交已經備好的抗流感的新藥臨牀試驗申請(IND),目的是為了儘快開展臨牀試驗,以考察莫那匹韋在人體的藥代動力學、安全性與耐受性。同時,EIDD/DIRVE決定與Ridgeback公司合作進行臨牀開發。
2020年4月份正是COVID19在美國第一波疫情呈燎原之勢的時候,那時人類對付這個疾病的武器實在是乏善可陳,寄予厚望的瑞德西韋在中國的臨牀試驗也是折戟沉沙,沒有達成預期的療效。另一邊,吉利德公司與NIH合作在美國的臨牀試驗正在緊鑼密鼓地進行(4月底,Gilead宣佈了Remdesivir的初步陽性結果,在5月1日就得到了美國FDA的緊急授權)。與此同時,Ridgeback與EIDD/DRIVE也在光速啓動莫那匹韋的Ⅰ期臨牀試驗,4月中旬開始,9周後的6月份即完成,初步測試了莫那匹韋在人體中的安全性、耐受性與藥代動力學參數[18]。5月26日, 在新冠疫情之戰中寸功未立的美國老牌製藥公司默沙東與RIDGEBACK簽署合作協議,共同開發莫那匹韋[19]。
默沙東的入局,不僅帶來了資金,也帶來了各種資源,包括遍佈各地的臨牀試驗點與經驗豐富、訓練有素的臨牀研發人員。證明莫那匹韋臨牀療效的Ⅱ期臨牀試驗很快啓動。到今年三月,默沙東與RIDGEBACK共同宣佈了積極結果,證明莫那匹韋可以顯著降低感染者的病毒載量[20]。在接下來的Ⅲ期臨牀試驗中期分析中,雖然默沙東認為在住院病人中成功的希望較低,決定停止開發,但試驗在發病早期的非住院病人中繼續進行[21]。隨着入組病人的增加,在今年九月的另外一次由獨立委員會進行的中期分析中,發現莫那匹韋可以顯著降低輕至中度COVID19病人羣體的住院風險與死亡率(與安慰劑對照組相比)。至此,默沙東與RIDGEBACK決定提前終止臨牀試驗,向FDA遞交了緊急情況下新藥申請(EUA)。
莫那匹韋可以口服,小分子化合物也容易大規模生產,加上療效顯著,因此它滿足了一種理想的抗新冠藥物的必要條件。在發病早期服用莫那匹韋,就像服用感冒藥退燒藥一樣,在家裏就可以控制住新冠病情,顯著降低重症與死亡風險。因此,在默沙東與RIDGEBACK公佈莫那匹韋臨牀有效的當天(10月1日),市場反響強烈,道瓊斯工業指數大漲近800點,而各大疫苗股與Covid19抗體股則全線下跌(其中莫德納公司的股票MRNA下跌近20%,市值損失近300億美元)。
但是,評價一款藥物,除了有效性,更重要的是安全性。
安全隱患
莫那匹韋是有安全隱患的,這個隱患是與生俱來的, 與其作用機理密切相關的。
如上所述,莫那匹韋的作用機理是“以假亂真”,摻“沙子”,在RNA病毒基因組內引入致死性突變從而阻斷病毒複製與繁殖。那麼問題來了,這個沙子是否會摻入細胞的DNA,或者是基因組DNA,從而在人體細胞引入突變,甚至是有害性突變(導致致畸或者癌變)?
測試一個藥物或者化學品是否引起突變,人們普遍採用的一個方法是Ames試驗。這個試驗是對所有的研究藥物進行普遍篩選,找出藥物致突變性的一種方法,也是受到FDA認可的。其基本原理是:採用一種突變的細菌株,它不能在組氨酸(histidine)缺乏的培養基上生長;如果受試品可以引起突變,就有可能令該菌株能夠繞過組氨酸的代謝途徑,在缺乏組氨酸的培養基上生長。莫那匹韋的活性代謝物N4-hydroxycytidine在Ames試驗中測試結果是陽性的,顯示出其可以引起細菌DNA基因組突變。不過,Ames試驗畢竟是體外在細菌上的試驗,存在假陽性與假陰性的可能,不能完全代表哺乳動物細胞或者是多細胞生物體內的問題。
因此,默沙東採用了兩個不同的動物模型測試了莫那匹韋在體內的致突變活性[22]。
第一種叫做“Pig-a 突變測試”,檢測藥物對pig-a基因的影響。有一種叫做“GPI anchor”的多肽,可以將許多細胞表面的蛋白抓在細胞膜上。比如在紅細胞上,可以將一種細胞表面分子CD59連接在細胞表面。而Pig-a基因對生成這種多肽至關重要。如果Pig-a基因有破壞性突變,會產生“GPI anchor”合成缺陷,CD59就會脱落。這樣就可以用一種流式細胞儀來連續監視受試動物紅細胞表面CD59的表達,如果CD59表達出現異常下降,就意味着受測藥物可能會影響Pig-a基因突變。
第二種方法稱為“Big Blue”,利用轉基因小鼠或者大鼠來進行檢測。這些轉基因動物攜帶有LacZ基因,在轉入細菌後,其編碼蛋白可以抑制beta-galactosidase的生成,在細菌培養基上就不可以催化X-Gal生成藍色的代謝物。如果受試物導致LacZ基因突變,就會生成beta-galactosidase,從而在細菌培養基上催化X-Gal生成藍色的代謝物,顯示出藍色的細菌克隆或者斑塊。
Merck的測試結論是:莫那匹韋在這兩個模型中沒有顯示出致突變的活性。
但是,美國北卡羅萊納大學的一個研究小組在今年早些時候發表了一篇論文,揭示出莫那匹韋的體內活性代謝物NHC在哺乳動物細胞顯示出了較強的致突變活性[23]。作者採用的是一種叫做HPRT的測試方法。在正常的中國倉鼠細胞卵巢細胞(CHOK1) 中,表達具有正常功能的HPRT蛋白,可以代謝6-TG為細胞毒性物質,從而殺死細胞。但是,如果受試物引起HPRT突變,導致這種蛋白失去功能,細胞就會在6-TG存在的情況下存活。這樣,細胞存活數量的多少就是受試物引起突變的活性指示。
這篇文章的結論是,NHC可以在低於3μM(微摩爾)的濃度下,劑量依賴性地誘導HPRT基因突變。原理上的可能性就是,這個NHC可以在細胞內轉化為脱氧形式的NHC (deoxy-NHC),這樣會成為DNA 合成的底物,而被摻入基因組DNA中,雖然人類基因組DNA合成有糾錯能力,但是這種潛在的致突變活性不可忽視,因為它確實引起了HPRT基因的突變。而且早些時候的研究顯示其有致畸作用,而這也是上文所提到的BARDA的負責人Rick Bright所擔心的。
現在,莫那匹韋在FDA待批,相信FDA專家委員會將會綜合考慮,權衡利弊後作出推薦。默沙東在提請新藥申請的時候也謹慎地將適用人羣限制在高風險人羣中,例如年齡在65歲以上,或患有感染Covid 19後預後不好的某種疾病,如肺部疾病或者糖尿病等。考慮到用藥時間限制在短短的5天,莫那匹韋的副作用的風險可能相對較小。但是仍然不可輕視,特別是對於複製活躍的組織細胞如腸細胞或者骨髓細胞,不能因為在有些測試中(如上述的Pig-a與Big_Blue)中陰性就認為其是安全的,因為這些測試都有其侷限性,特別是靈敏性與代表性的問題。
另外,本月初(11月5日),輝瑞公司(Pfizer) 宣佈其口服新冠蛋白酶抑制劑在臨牀試驗中取得積極結果,也會向 FDA報批緊急狀況下使用的新藥申請。現在,人類對付新冠的彈藥庫中又多了兩款待選新式裝備。從最初的瑞德西韋,到單克隆抗體,再到有效新冠疫苗的出現,到如今的抗新冠病毒口服藥物的問世,人們在科學抗疫的道路上節節勝利。可謂“兩岸猿聲啼不住,輕舟已過萬重山”。但是,“試玉要燒三日滿” “成書還待十年閒”,到底這些新式武器在實戰中的效果如何 (特別是在殺滅敵人的時候是否會誤傷自身),是天使還是有魔鬼的一面,我們仍然要保持冷靜,謹慎對待。
(以上為作者個人觀點)
參考文獻
[1] https://www.merck.com/news/merck-and-ridgeback-announce-submission-of-emergency-use-authorization-application-to-the-u-s-fda-for-molnupiravir-an-investigational-oral-antiviral-medicine-for-the-treatment-of-mild-to-moderate-c/
[2] https://www.merck.com/news/merck-and-ridgebacks-investigational-oral-antiviral-molnupiravir-reduced-the-risk-of-hospitalization-or-death-by-approximately-50-percent-compared-to-placebo-for-patients-with-mild-or-moderat/
[3] Ref. Center for system science and engineering, John Hopkins University
[4] https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-monoclonal-antibodies-treatment-covid-19
[5] https://www.reuters.com/business/healthcare-pharmaceuticals/us-fda-gives-emergency-use-approval-gsk-vir-covid-19-antibody-drug-2021-05-26/ ; Regeneron and Gsk/Vir news release
[6] https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines
[7] https://en.wikipedia.org/wiki/Sofosbuvir#Mechanism_of_action
[8] https://www.reuters.com/article/us-pharmasset-founder/corrected-gilead-could-have-had-pharmasset-cheap-idUKTRE7AM29U20111123
[9] http://driveinnovations.org/about/team/founders/?doing_wp_cron=1634241454.3483688831329345703125
[10] http://eidd.emory.edu//people/index.html
[11] Reichert et al, Alphavirus antiviral drug development: scientific gap analysis and prospective research areas. Biosecur Bioterro 2009, 7:413-427
[12] Painter WP et al. Antimicrobial Agents and Chemotherapy 65 (5): e02428-20
[13] Wahl et al SARS-Cov2 infection is effectively treated and prevented by EIDD-2801. Nature 2021, 591: 451-457;
[14] CoX RM et al, Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV2 transmission in ferrets. Nature Microbiol 2021, 6: 11-18;
[15] Sheehan TP et al, An orally bioavailable broad-spectrum Antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple corona viruses in mice. Sci Transl Med 2020, 12: eabb5883
[16] https://www.jbc.org/article/S0021-9258(21)00667-0/fulltext
[17] https://www.science.org/content/article/emails-offer-look-whistleblower-charges-cronyism-behind-potential-covid-19-drug
[18] Painter WP et al, Human safety, tolerability, and pharmacokinetics of molnupiravir, a novel broad-spectrum oral antiviral agent with activity against SARS-CoV-2, Antimicrobial Agents and Chemotherapy 2021, 65(5): e02428
[19] https://www.merck.com/news/merck-and-ridgeback-bio-collaborate-to-advance-development-of-novel-antiviral-candidate-eidd-2801/
[20] https://www.businesswire.com/news/home/20210305005610/en/
[21] https://www.merck.com/news/merck-and-ridgeback-biotherapeutics-provide-update-on-progress-of-clinical-development-program-for-molnupiravir-an-investigational-oral-therapeutic-for-the-treatment-of-mild-to-moderate-covid-19/
[22] https://academic.oup.com/jid/article/224/8/1442/6319402
[23] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8136050/