無路難開路更難:綠色熒光蛋白的傳奇發現之旅_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-12-11 09:55

撰文 | 徐亦迅
生命科學史的發展脈絡是從容易觀測的宏觀層面(比如物種分類和大體解剖學)進入需要儀器才能觀測的微觀層面(比如顯微解剖學研究的組織和細胞)。十七世紀荷蘭科學家列文虎克 (Antonie van Leeuwenhoek) 用他改進的光學顯微鏡首先觀察並描述了單細胞生物,就是生物學歷史上的一個分水嶺。在顯微鏡的幫助下,生物學家們逐漸觀察到了以前都不知其存在的細菌、細胞、細胞器等微觀研究對象。這樣的還原論研究一旦達到分子水平,就連電子顯微鏡也很難讓我們直接觀測蛋白質等生物大分子在活體細胞中的表達和定位。從維多利亞多管發光水母 (Aequorea victoria,下文簡稱發光水母或水母) 中分離的綠色熒光蛋白 (Green Fluorescent Protein, GFP),讓曾經不可見的蛋白質成為可見,在過去的二十多年裏成為生物學家和醫學科學家研究細胞內各類生物化學過程的指路星。本文要講述的就是幾位科學家的故事,他們為GFP引發的生物學革命做出了重要貢獻。
生物發光現象的早期研究
GFP發現的緣起與生物發光現象(bioluminescence)密不可分,因此我們首先要介紹一下不同類型的低温發光(luminescence)。

火是人類歷史上最重要的發明,與它相聯的白熾發光(incandescence)通常定義為物體被加熱到高温時發出的可見光。低温發光則是一種由不與環境處於熱平衡的激發態化學組分自發放射的可見光。兩千五百多年前的古希臘科學家亞里士多德,就在《論顏色》一書中寫道:“有些不是火而且與火的產生無關的物體似乎可以自然發光”。這意味着人類很早就意識到白熾發光和低温發光的重要區別:白熾燈泡在照明時效率不高,只能把一小部分電能轉化為光能,而其餘能量以熱的形式被耗散;而生物發光則是一種高效的化學反應,在將化學能轉化為光能的過程中幾乎不產生熱,因此也稱為“冷光”。
按照不同的激發模式,我們可以把低温發光分為光致發光 (photoluminescence)、電致發光 (electroluminescence)、化學發光 (chemiluminescence,生物發光是一種特殊的化學發光) 等很多種類 (圖1)。最為常見的光致發光是熒光 (fluorescence) 和磷光 (phosphorescence) ,請讀者們特別注意熒光與生物發光的區別。
自然界中最為常見的一種生物發光現象就是螢火蟲。每到夏日的夜晚,螢火蟲在草叢裏點點飛舞,構築成奇幻的美景。唐代大詩人李白曾作《詠螢火》一詩:“雨打燈難滅,風吹色更明。若飛天上去,定作月邊星”。

除了螢火蟲,自然界還有很多物種有低温發光的能力,其中包括細菌、原生動物、真菌、水母、烏賊等。科學家們很早就對生物發光現象有深入研究的好奇之心,但一直缺乏有效的科研手段。直到1667年,英國化學家波義耳 (Robert Boyle) 用氣泵將鐘罩內的空氣抽去,發現裏面的真菌不再發光。當他再將空氣導入時,真菌的生物發光能力恢復。在十七世紀的化學界,人們對空氣的成分還一無所知。只有等到1770年代,瑞典化學家舍勒 (Carl Wilhelm Scheele) 和英國化學家普利斯特里 (Joseph Priestley) 獨立發現了最終由法國化學家拉瓦錫 (Antoine Lavoisier) 闡明的氧氣,生物發光對氧氣的依賴性終於浮出水面。
又經歷了一個多世紀的徘徊不前,生物發光的化學機理探索由法國生理學教授杜勃瓦 (Raphael Dubois) 帶來新的轉折點。在1885年的一個實驗中,杜勃瓦先用冷水將叩頭蟲 (Pyrophorus) 的發光組織在試管裏勻漿,發現抽提物在短暫發光後變暗。他用沸水取得的組織抽提物則完全不發光,令他驚訝的是,當冷卻的熱水抽提物被加入已經停止發光的冷水抽提物時,混合物居然再度發光 (圖3) 。若想讓冷水抽提物持續發光,杜勃瓦就需要不斷補加冷卻的熱水抽提物。
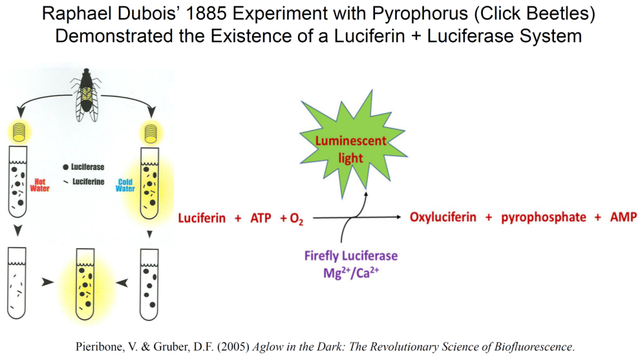
杜勃瓦隨後在其它包括螢火蟲在內的發光生物中得到了相似的實驗結果,於是他得出了兩個重要結論:(1) 生物發光的反應除了氧氣之外,至少還需要兩個化學組分;(2) 發光反應中的“燃料”組分可以耐受沸水的高温,而“點燃劑”或催化劑不耐熱。杜勃瓦決定借用來自羅馬神話的拉丁詞Lucifer (字面意思是“光之使者”) 來命名這兩個組分:不耐熱的催化劑名為螢光素酶 (luciferase),而耐熱的小分子則名為螢光素 (法語:luciferine,英語:luciferin)。
很多生物學家的後續研究表明:對於很多發光物種而言,螢光素酶有不同的蛋白序列,而螢光素也呈現多樣化的有機小分子結構,但“螢光素-螢光素酶”的生物發光原理都是成立的。生物發光研究者的目標也就可以具體化,選擇一個感興趣的發光物種,用生物化學手段來分離純化不同的螢光素和螢光素酶。通過對螢火蟲發光系統的深入研究,科學家們很快又發現在氧氣、螢光素、螢光素酶之外,ATP和Mg2+離子也是必要條件 (圖3)。
生物發光對於陸生物種而言並不常見,而在深海里卻有超過90%的海洋生物能夠發光。從海平面每往下75米,陽光的強度就要減弱10倍。在陽光無法到達的深度以下,會發光的動物在尋找食物、逃避敵害和吸引配偶上擁有明顯的優勢。在大致闡明螢火蟲的發光機理之後,很多科學家就把目光轉向海洋發光生物,其中最有名的就是美國普林斯頓大學開宗立派的哈維教授 (E. Newton Harvey)。
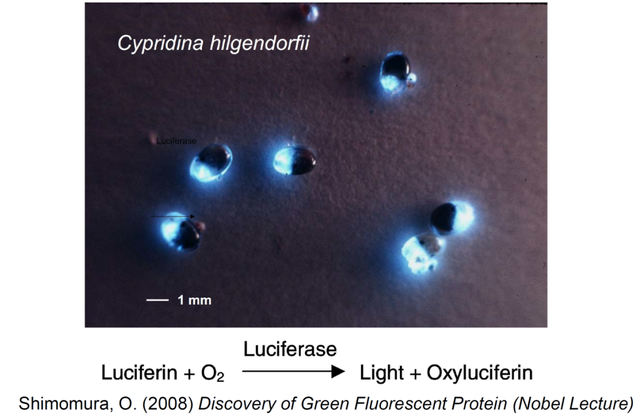
1916年,時年28歲的哈維攜夫人前往日本蜜月旅行。三崎臨海實驗所附近的海域適合兩人在夜間游泳,哈維在暢遊之餘迷上了一種叫做希氏彎喉海螢 (Vargula hilgendorfii, 曾用屬名Cypridina) 的發光海洋生物。海螢在採集和抽乾後可以長期保存,用水濡濕後又能發光,因此被哈維視為用生物化學手段研究生物發光的最佳實驗材料。哈維實驗室發現海螢的發光系統比螢火蟲要簡單,只需螢光素、螢光素酶、氧氣,而無需ATP和Mg2+離子 (圖4)。但哈維團隊在部分純化了海螢的螢光素之後,努力鑽研了二十多年也無法獲得其結晶。而沒有高純度的螢光素,他們就無法通過確定其分子結構來深入研究海螢發光的化學機理。
下村修結晶純化海螢的螢光素
海螢的螢光素難以被完全純化,為GFP故事的第一位主角下村修 (Osamu Shimomura) 登上歷史舞台提供了契機。下村修“人生的起跑線”和同樣出生於1928年的沃森 (James Watson) 相比,簡直就是後者的“陰性對照” (negative control) ,充滿了崎嶇與坎坷。由於父親是軍人,下村修主要由居住在長崎縣諫早市的祖母撫養長大。1941年4月,剛升入諫早中學初一的下村修,和他的同學們都要遵照日本政府在當年3月修訂的《國家總動員法》參加軍訓。1944年秋季升入初三後,學校又開始經常性取消課程,要求學生們去大村市的一家軍用飛機修理廠義務勞動。美軍很快盯上了這家軍工廠,出動了二十多架B-29轟炸機將其徹底摧毀,下村修有好幾位跑得不夠快的同學不幸遇難。
正所謂“福無雙至,禍不單行”。1945年8月9日早上10點57分,長崎市又不幸迎來了美軍的第二顆原子彈。當時下村修和幾位同學正在長崎市中心15公里外的另一家軍工廠裏工作,熟悉的空襲警報剛拉響時,他們還處變不驚地走出廠房爬上附近一個小山丘觀望。下村修看到一架B-29轟炸機飛往南邊市中心方向,空投下三個載物降落傘。事後才知道,這是在他們沒看到的原子彈投放與最後爆炸的間隔期內,“大藝術家”號飛機投放的三個無線電高空測候器。此時大家還誤以為這次轟炸可能威脅不大,於是決定回到廠房試圖繼續工作。剛一坐下,窗外襲來的強烈閃光就讓同學們暫時失明半分鐘,隨後是一聲巨響和氣壓的驟變 …… 軍工廠和長崎之間的距離顯然是下村修和小夥伴們能夠劫後餘生的關鍵。
第二次世界大戰雖然隨着日本投降而宣告結束,年僅17歲的下村修依然看不到任何未來的曙光。諫早中學很多師生在原子彈爆炸時罹難,所有的學生檔案都被炸燬,因此近幾屆的初中生都不能正常畢業。下村修連續兩年報考高中 (日語:高等學校) 或技術高校 (日語:高等工業學校),都因沒法提供初中成績而失利。直到1948年4月,長崎醫學院的師生由於在原子彈爆炸時傷亡慘重,重建的迫切需要才使下村修被他並不感興趣的藥學院錄取 (圖5),這也是他當時接受高等教育的唯一機會。

剛剛在一片廢墟上重建的長崎醫學院教學資源極度匱乏,原先的20名教授中有12位在原子彈爆炸時遇難,4位受了重傷。藥學院課程的教學任務大都只能由經驗不足的講師們來擔當。由於教學經費的限制,下村修在三年本科期間以分析化學和物理化學方面的訓練為主,只有少數機會學習有機化學知識或進行有機合成實驗。下村修的分析化學課老師安永峻五 (Shungo Yasunaga) 很快發現這位學生出眾的動手能力,特別准許他把一些試劑帶回家去鑽研利用毛細管色譜的分離純化。這項研究最終讓下村修在1953年與安永教授聯名用日語發表了他學術生涯的第一篇論文。
1951年3月,下村修以總成績全班第一從長崎藥學院畢業,並向武田藥品公司遞交了入職申請,但一位面試官坦率地指出他的個性不適合在公司環境裏發展。安永教授對下村修及時伸以援手,邀請他留校擔任分析化學課助教。下村修對自己將來的人生並沒有刻意規劃,只要有一份工作就專心去做,也從未想過報考研究生院以獲得更高的學位。安永教授在下村修工作四年之後,為他爭取到了一個帶薪去其他院校學術訪問一年的機會。
作為下村修職業生涯裏的第一位貴人,安永教授還主動幫助他尋找合適的訪學實驗室。安永在日本化學界的人脈主要在名古屋大學,他認為專攻生物化學的江上不二夫教授 (Fujio Egami) 是開闊下村修科研視野的最佳人選。日本的電話通訊系統在戰後多年也未能全面恢復,安永教授只能親自帶着下村修,從長崎坐十幾個小時的火車來到名古屋,沒想到江上教授那幾天外出參加學術會議而未得一見。偶然事件改變歷史發展軌跡的例子比比皆是,如果當天下村修見到了江上教授而順利進入他的實驗室,那麼讀者朋友們此刻恐怕就不會讀到這個有趣的故事。兩人轉而去拜訪有機化學家平田義正教授 (Yoshimasa Hirata),簡短談話幾分鐘後,平田教授就歡迎下村修隨時到他實驗室來做訪問學生。
1955年4月,平田教授指着一個真空乾燥器對剛來實驗室報到的下村修説:“這裏面有大量已被抽乾的希氏彎喉海螢,這種海洋動物通過螢光素和螢光素酶的相互作用而發光。海螢的螢光素很不穩定,一遇到氧氣就會降解。你是否願意嘗試一下這個螢光素的純化和結晶?”下村修深知這個高難度的課題不適合平田教授的研究生們,而身為訪問學生的他沒有攻讀學位的負擔,決心以一種“初生牛犢”的放鬆心態大膽嘗試。早在1935年,哈維實驗室的安德森 (Rubert Anderson) 發明了兩步抽提法,可以將這個很不穩定的螢光素部分純化2000倍左右,並通過吸收光譜推測出其分子結構中有氨基酸的組分。下村修在此基礎上推算,想要得到結晶純度的螢光素至少需要500克抽乾海螢作為起始原料,這是哈維實驗室用量的10倍,也就需要他搭建一個巨大的索氏提取器 (圖6左)。
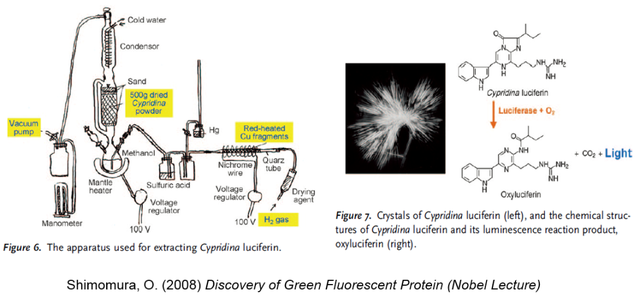
下村修在艱辛的科研探索過程中發現,用氮氣或者惰性氣體都不足以消除抽提系統中痕量氧氣對螢光素的消耗。他必須往系統中通入氫氣,這樣痕量氧氣就會被轉化為液態水而被硫酸吸收。化學工作者無人不知對氫氣操作不當就會引發爆炸事故,因此平田實驗室其他成員在下村修緊張實驗時都會與他保持相當的距離。氫氣的使用雖然為下村修帶來了突破性進展,但用各種方法試圖結晶總是失敗。每次嘗試結晶前的抽提物製備,都需要他在極少睡眠的狀態下連續工作一週,失敗後的抽提物在報廢前只能做一些簡單的組分分析。不離不棄的下村修平均每個月要這樣辛苦一週,直到1956年2月的一個晚上,看來又要面臨一次失敗。他在回家前決定在將要報廢的抽提物中加入等體積的濃鹽酸,等黃色的溶液變為暗紅色後放在實驗台上過夜,準備第二天再嘗試檢測其中有哪幾個氨基酸。
下村修早上回到實驗室卻發現溶液由暗紅色變為無色,第一感以為是鹽酸導致螢光素水解後的結果。隨後他在試管底部發現了少量黑色沉澱物,通過顯微鏡細看,居然是紅色的針狀晶體 (圖6右)!這些晶體通過與海螢的螢光素酶提取液混合後可以發光,正式宣告螢光素結晶取得成功。事後回看,濃鹽酸促成螢光素的結晶在其結構未知時只能來自意外發現,並且當晚平田實驗室的煤氣爐關閉,溶液在室温持續下降時過夜對結晶過程的幫助也不容忽視。
“苦心人,天不負”,下村修十個月的科研拼搏取得了出乎意料的突破,他在名古屋大學的學術訪問也被平田教授延期一年,確保其第一篇英語學術論文在1957年順利發表。哈維教授的衣缽傳人約翰遜 (Frank Johnson) 此時已是美國普林斯頓大學的正教授,他在讀到這篇論文後不由驚歎一個困擾了哈維學派二十多年的難題,居然被一位只有本科學歷的年輕日本學者解決!這次難得的成功為下村修帶來了職業生涯的一個重要機遇:1959年春天,他回到長崎藥學院不久就收到約翰遜教授的邀請信,定於下一年秋季前往普林斯頓大學擔任為期三年的訪問學者。
下村修與發光水母和星期五港的不解之緣
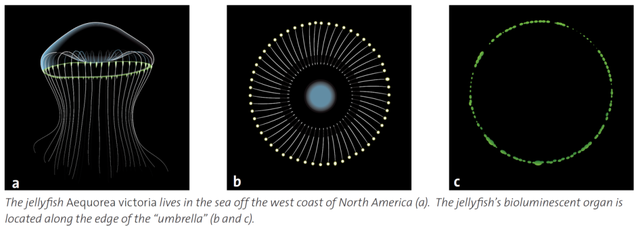
下村修於1960年9月抵達普林斯頓大學。約翰遜教授告訴他,本實驗室現在最感興趣的研究對象是發光水母,希望他藉着研究海螢發光的成功勢頭,在水母發光的機理研究上取得突破 (圖7)。想要獲得足夠的實驗材料,當時全美只有華盛頓州聖胡安羣島 (San Juan Islands) 上的星期五港 (Friday Harbor) 海域,每年夏天會有大量的水母可以捕撈。

從1961年開始,約翰遜幾乎每年夏天都要與研究組骨幹成員自帶儀器,從普林斯頓長途開車七天來到星期五港採集水母。為了用生化手段研究水母發光,他們先要手工切割大量打撈上來的水母傘膜 (圖8),利用當地華盛頓大學分校的實驗室條件,把傘膜邊緣發光器官的擠出液 (squeezates) 冷凍保存。
下村修和約翰遜首次上島的第一週研究很不順利,他們沿着杜勃瓦的“螢光素-螢光素酶”思路總是無法分離出耐熱和不耐熱的兩個組分。此時年輕的下村修覺得不必拘泥於杜勃瓦理論,可以在沒有任何假設的前提下分離水母的發光物質。但約翰遜基於多年來杜勃瓦理論在多個發光物種被毫無例外地反覆驗證,不願輕易放棄它而改換思路。師生二人由於堅持己見不讓步而只能在一個實驗桌的兩端各自為陣,氣氛相當緊張而尷尬。
下村修每當研究受阻時喜歡暫停手中的實驗,尋找安靜之處冥思新的想法。在星期五港可以通過小船前往那些無人的僻靜水域,下村修連續幾天划船出海,然後獨自一人躺在船裏閉目思考,他有好幾次在小船隨着風浪漂移時進入夢鄉。某天下午當下村修在船中小睡醒來後突然有了靈感:就算水母的生物發光與螢光素和螢光素酶無關,但很可能還是會需要蛋白質。而蛋白質的活性對pH值敏感,能否通過調控溶液的pH值來可逆抑制水母的發光?下村修此時非常激動,趕快用力划船返回實驗室,製備了幾種不同pH值的緩衝液。當pH值分別是7,6,5的時候,水母抽提液都還能發出弱光;而當pH值被調到4的時候,溶液的弱光消失,提示酸性可以抑制發光物質!當他用碳酸氫鈉把pH值調回中性時,弱光再次出現,説明酸性的抑制作用果然可逆 (圖9)。

這個進展讓下村修無比振奮,但他還是對抽提液為何只發弱光感到困惑。此時難以捉摸的機遇在下村修職業生涯中第二次光顧了他這個“有準備的頭腦”。1961年的一個仲夏之夜,獨自工作到很晚的下村修身心疲憊,覺得中和了酸性的水母抽提液已沒有多大用處,就將其倒入水槽後收工。關燈出門前他下意識回望了一眼,驚訝地看到剛倒入抽提液不久的水槽中發出閃亮的藍光!善於思考的下村修開始分析這一現象背後的原因,在第二天他注意到旁邊一個養魚缸的海水也流入同一個水槽,於是假設海水中的某種物質把水母抽提液的弱光激發成了強光。沿着這個思路,下村修用“加減法”逐個排查海水中濃度較高的離子組分,很快發現鈣離子可以在瞬間激發水母抽提液中的發光蛋白。約翰遜教授在見證了下村修發現鈣離子作用的突破之後,開始對他的科研能力徹底放心。
瞭解鈣離子的發光引發劑作用後,下村修不再需要調控酸鹼度,而只需在抽提液中先加入著名的鈣離子螯合劑EDTA,就能更加有效地可逆抑制發光蛋白,保證在進一步的分離純化過程中,目標蛋白不會因為發光而被損耗。1961年8月底之前,約翰遜團隊總共採集了1萬多隻水母,製成含有EDTA的粗提液後用乾冰冷凍,全部帶回普林斯頓後再開始系統的蛋白純化工作 (圖9)。幾個月後,他們就純化得到兩個蛋白:其中濃度較高的蛋白產量約為5毫克,被命名為水母素 (Aequorin),這就是能被鈣離子激活的發光蛋白;先於水母素從液相色譜柱上洗脱的另一個“副產品”,在陽光下顯出暗綠色,被命名為綠色蛋白( Green Protein, GP;後來改名為GFP)。沒想到這個彼時不起眼的“副產品”,卻最終成為生物科學史上的一個重量級角色。
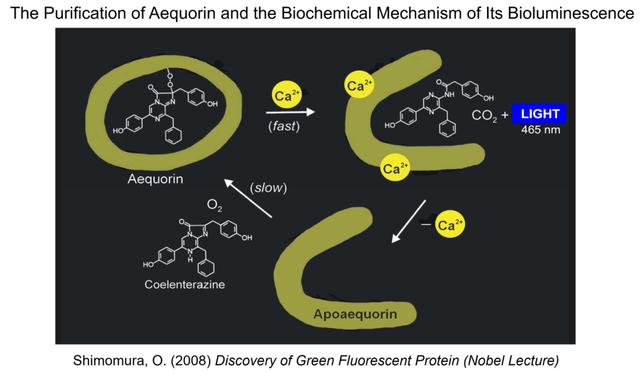
隨着下村修純化水母發光蛋白的幾篇論文先後發表,他在約翰遜實驗室的三年訪學可謂成果頗豐。1963年,回到日本的下村修被名古屋大學聘為水科學的助理教授,但他在兩年後意識到,自己還是更願意回到約翰遜實驗室進一步研究水母的發光機理。經過幾年的不懈努力,下村修徹底闡明瞭水母素在鈣離子調控下的發光機理 (圖10)。脱輔水母素 (Apoaequorin) 需要在有氧條件下與腔腸素 (Coelenterazine) 這個小分子輔因子共價結合,形成具有生物發光能力的水母素穩定中間體。而這個共價鍵居然是過氧化橋,一種“內藴的氧氣” (intrinsic oxygen)!這個過氧化鍵在鈣離子的激發下可以快速斷裂,在形成二氧化碳的同時發出閃亮的藍光 (圖10)。
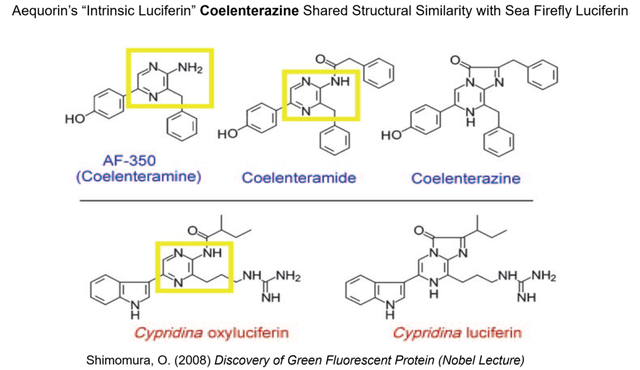
更為引人入勝的是,腔腸素在化學結構上與海螢的螢光素 (下村修的成名之作) 有顯見的相似性,它其實是一種“內藴的螢光素” (圖11)。下村修此時恍然大悟,終於明白為何1961年夏天沿着傳統的杜勃瓦理論思路研究水母會碰壁,這真是“終點又回到起點,到現在我才發覺”。我們在研究這段有趣的科學史時,不由想起了著名遺傳學家杜布贊斯基 (Theodosius Dobzhansky) 的名言:“沒有演化論之光,生物學的一切都將無法理解” (Nothing in Biology Makes Sense Except in the Light of Evolution)。從螢火蟲發光需要五個組分 (螢光素,螢光素酶,氧氣,ATP和Mg2+離子),到海螢發光只需三個組分 (螢光素,螢光素酶,氧氣),再到水母素這個發光蛋白把內藴的螢光素和氧氣像充電電池那樣隱藏在分子當中,自然選擇下的生物演化真是“八仙過海,各顯神通”!
在探明水母素髮光的生物化學機理後,下村修並沒有忘記那個綠色蛋白副產品GFP。只是GFP在水母中的含量偏低,根據他的初步估算,大概需要打撈幾十萬個水母才能有足夠的原材料來純化並結晶GFP。下村修對科研的執着讓他天生具有愚公移山的精神,為了進一步研究GFP,他不惜每年夏天長途跋涉去一次星期五港,年復一年直到採集了足夠的原材料為止。
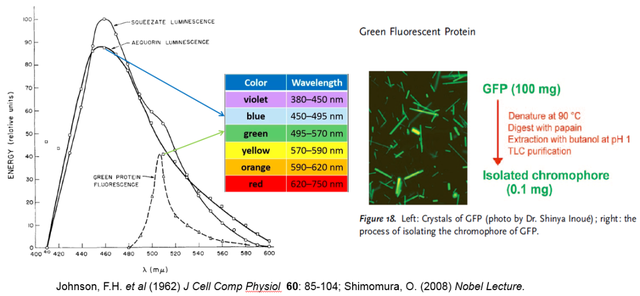
從1962年到1974年,十二年光陰彈指一揮間,下村修在約翰遜實驗室終於純化了足夠量併成功獲得GFP的綠色結晶 (圖12)。而想要進一步研究GFP的發光機理,下村修預計需要消耗100毫克的純GFP蛋白,而每年夏天打撈4萬多隻水母也只能獲得20毫克GFP。於是他又通過連續五年的積累,直到1979年才初步鑑定了GFP的熒光生色團 (圖12和圖13)。1977年,年近70歲的約翰遜教授決定退休,而普林斯頓大學無意挽留獨立獲得科研經費能力有限的下村修。約翰遜只能説服生物系領導給下村修足夠的時間找工作,並提供一個在主校園幾英里外的臨時實驗室,GFP生色團的研究工作就由他在職業前途未卜的情況下獨自完成。
約翰遜實驗室一直沒有掌握蛋白片段測序技術,他們也沒有去主動尋找這方面的合作者。在蛋白序列未知的情況下,下村修對GFP生色團的推斷比較粗略 (圖13),而且他也無法對生色團是否只來自GFP的氨基酸側鏈 (而不需要輔因子) 給出確定性結論。圖13中GFP包含內藴的熒光生色團這一改變歷史的突破性認識,需要等到十幾年後的1990年代中期。
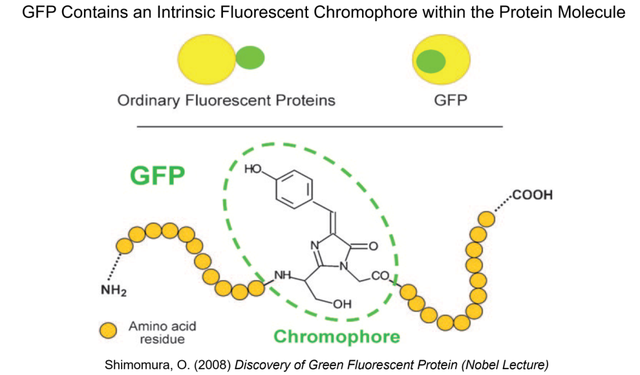
1981年,在多位學術界朋友的幫助下,下村修終於在約翰遜教授退休四年後被美國麻州伍茲霍爾的海洋生物學實驗室 (Marine Biological Laboratory, MBL) 聘為資深研究員。自此他的研究工作開始轉向其它發光生物,不再涉及水母的GFP。我們在此借用多年後的知識體系來總結下村修研究水母發光的幾個重要發現:在鈣離子的激發下,水母傘膜邊緣發光器官中的水母素通過其螢光素酶活性,利用與之共價結合的腔腸素和過氧化鍵這一“內藴的氧氣”實現生物發光。而水母素產生的光能馬上通過生物發光共振能量轉移 (Bioluminescence Resonance Energy Transfer, BRET) 傳遞給鄰近的GFP,最終發出肉眼可見的GFP綠色熒光 (圖14)。
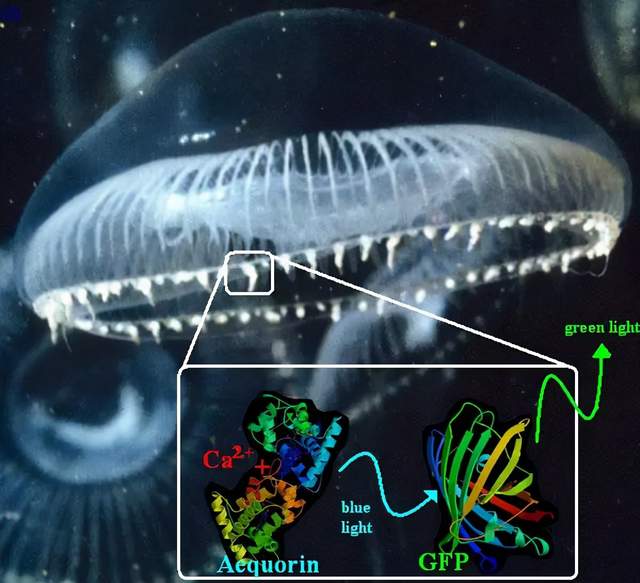
普瑞舍對水母發光蛋白的分子克隆
在下村修和約翰遜發現水母素和GFP的1960年代,分子生物學尚在孕育過程中,生物學家若想要研究某個蛋白的功能,只能走傳統的“華山一條路”:製備大量的目標物種抽提物樣品,然後用生化手段來進行蛋白純化。對於那些可以人工大量培養的生物或者細胞株而言,蛋白純化所需的原材料可以取之不盡。但是水母這樣的海洋生物至今無法人工養殖,實驗用的純蛋白需要靠勞動力密集的不斷打撈和製備才能保障供給。目標物種一旦由於生態環境的改變而不再出現在固定水域,蛋白功能的研究也會陷入止步的境地。幸運的是,隨着遺傳密碼的解讀與分子生物學中心法則的確立,重組DNA技術在1970年代末應運而生,而來自病毒的反轉錄酶又催生了威力巨大的cDNA分子克隆技術。生物學家一旦能將編碼目標蛋白的cDNA克隆到大腸桿菌的質粒中,就能通過培養細菌而輕易獲得大量純蛋白,不但對功能的基礎研究不再有後顧之憂,而且在開發應用上也將事半功倍。
美國佐治亞大學的科米爾教授 (Milton Cormier) 從1950年代起就研究生物發光,早年主要研究海堇 (Renilla, sea pansy)。在下村修和約翰遜的突破性工作發表後,科米爾實驗室也開始把一部分研究精力轉向了水母。GFP故事的第二位主角普瑞舍 (Douglas Prasher) 於1983年來到科米爾實驗室,開始他的第二輪博士後訓練。普瑞舍在上一個博士後實驗室主攻細菌遺傳學,成功掌握了新興的分子克隆技術,這在當時並非易事。1982年,著名實驗手冊《Molecular Cloning: A Laboratory Manual》的出版 (圖15) 有力推動了基因克隆技術的普及,但包括聚合酶鏈式反應 (PCR) 在內的很多技術手段還沒有被髮明。

科米爾希望新來的普瑞舍能接受克隆水母素基因的挑戰,一旦成功,該實驗室一個晚上通過大腸桿菌產生的水母素蛋白量,就能超過他們整個夏天能在星期五港通過打撈水母純化的總和。能夠從單個水母中製備的總mRNA量並不高,普瑞舍也需要像下村修那樣前往星期五港採集大量的水母樣品。1985年,普瑞舍經過連續兩個夏天的積累,抽提出足夠的mRNA來構建cDNA文庫。隨後根據已知蛋白序列設計的分子探針,篩選cDNA文庫後成功分離出6個編碼水母素的cDNA克隆,對應了5種蛋白異構體 (isoforms)。普瑞舍把這些基因克隆在大腸桿菌中表達後,卻連續幾周無法在蛋白凝膠電泳上檢測到水母素對應的條帶。科米爾的科研直覺告訴他電泳檢測的靈敏度不夠,馬上請技術員麥卡恩 (Richard McCann) 幫助普瑞舍設計了水母素的生物發光檢測,終於確認了基因克隆的成功!通過在大腸桿菌中的超量表達,作為鈣離子染料的水母素價格很快大幅度降低,成為一種常用的實驗試劑。
藉着成功克隆水母素基因的勢頭,普瑞舍終於完成了漫長的兩輪博士後訓練,於1987年10月被美國麻州的伍茲霍爾海洋研究所 (Woods Hole Oceanographic Institution, WHOI) 聘為獨立的助理研究員。在正式離開科米爾實驗室之前,普瑞舍很自然地設定了下一個基因克隆目標:GFP。考慮到GFP的蛋白和mRNA丰度遠低於水母素,普瑞舍需要每年再去星期五港採集將近7萬隻水母,才為將來的GFP克隆積累了足量的總mRNA。
普瑞舍在WHOI雖然獨立,但由於啓動經費有限而無法招募研究生、博士後、或者技術員,只能單槍匹馬投入克隆水母GFP基因的戰鬥。同時他對下村修提出的GFP蛋白髮熒光需要一個輔因子的假説持懷疑態度,設想一旦拿到了 GFP基因並在大腸桿菌中表達,如果能直接觀測到綠色熒光,那麼通過重組DNA技術將GFP基因與任何物種的一個基因融合,就能用熒光來定位蛋白產物在細胞中的表達。普瑞舍根據這個令人激動的想法,遞交了多份科研基金申請書,但大多都遭到了評審委員會的否決,只有美國癌症協會 (American Cancer Society) 同意提供20萬美元的經費。
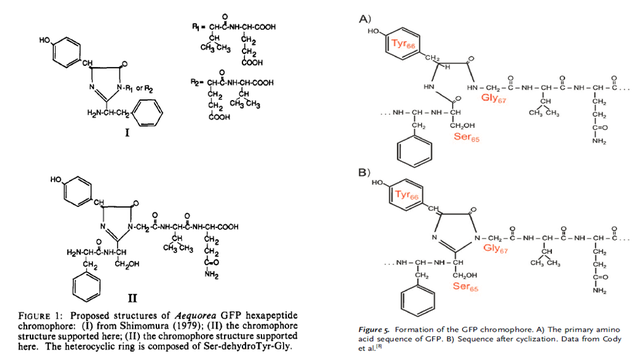
1989年初,普瑞舍經過了近兩年的苦戰,在水母基因文庫中篩選到了一個他命名為pGFP1的cDNA克隆,該質粒包含了編碼168個氨基酸的序列。已知GFP蛋白的全長是238個氨基酸,普瑞舍注意到這個cDNA的5’端和3’端都不完整。這個168個氨基酸的蛋白序列對與他合作的沃德實驗室 (William W. Ward) 幫助巨大,讓他們大幅度完善了下村修1979年的GFP生色團工作,確定GFP內部的三個相連的氨基酸側鏈 (Ser65-Tyr66-Gly67) 就是產生綠色熒光的分子基礎 (圖16)。但普瑞舍若想把GFP的熒光應用為分子定位的工具,就必須克隆GFP的全長cDNA,這意味着他要回頭去構建新的水母cDNA文庫。
查爾菲和錢永健創立GFP標記技術
就在普瑞舍開始為構建新的cDNA文庫而重新採集水母的同時,GFP故事的第三位主角查爾菲 (Martin Chalfie) 以一種出人意料的方式登場。查爾菲在美國哥倫比亞大學的實驗室致力於研究秀麗線蟲的觸覺神經生物學,1989年4月25日,他照例參加了系裏每週二中午的講座。來自塔夫茨大學的布萊姆 (Paul Brehm) 介紹了多種生物的發光蛋白,查爾菲對用作鈣染料的水母素早有耳聞,而對發綠光的水母GFP則是首次聽説。被紫外線或者藍光激發的單體GFP蛋白,很可能不需要輔因子就能發出熒光,這個特性讓查爾菲這個有心人激動不已。
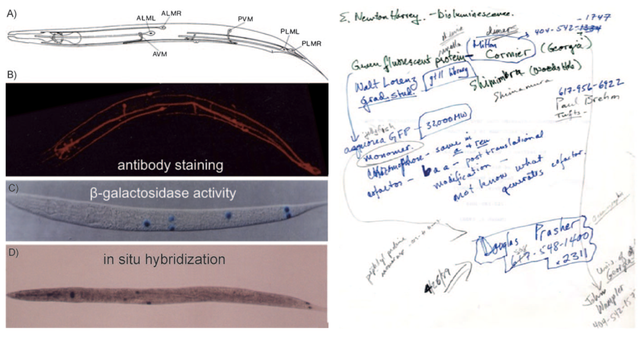
秀麗線蟲固然有全身透明這一天然優勢,但當時常用的幾種基因和蛋白表達定位技術都需要冗長的樣品製備步驟,而且由於染色試劑需要滲透進入線蟲體內,因此無法用於直接觀測活體動物 (圖17左)。只有238個氨基酸的GFP若真能發光,研究者可以用分子生物學手段將其與感興趣的線蟲基因融合,通過融合蛋白上的GFP熒光標記就能直接在顯微鏡中觀測該基因在哪些細胞中表達。查爾菲在第二天通過輾轉的電話諮詢,四處打聽是否已有科學家成功克隆了水母GFP的基因,最後發現只有WHOI的普瑞舍可能給他想要的答案 (圖17右)。
查爾菲與普瑞舍在電話中談得很投機,兩人對GFP的應用前景想法相似,但他們的合作必須要等普瑞舍拿到GFP完整的cDNA克隆之後才能開始。考慮到之前用細菌質粒構建的水母基因文庫平均片段不夠大,普瑞舍決定改用λ噬菌體來構建新的cDNA文庫,兩年後篩選得到包含了編碼238個氨基酸完整序列的λGFP10克隆 (圖18)。可惜此時的普瑞舍已經沒有心情來慶祝這個階段性成功:(1) 美國癌症協會提供的科研經費已經用完,他最新遞交的基金申請屢屢被拒;(2) 他把λGFP10轉到大腸桿菌中表達,得到的GFP蛋白卻沒能在顯微鏡下發熒光,這動搖了他之前認為GFP無需輔因子或者轉化酶就能發光的想法;(3) WHOI的同事們對他克隆基因工作缺乏興趣,拿不到新經費的他已看不到通過終身教職評審的希望。普瑞舍決定先公佈GFP的cDNA序列,但論文從投稿開始也不太順利,用了近一年的時間才於1992年2月正式發表。

普瑞舍在論文發表前後試圖通過電話與查爾菲聯繫,很不湊巧的是,查爾菲由於新婚而正在他夫人所在的猶他大學實驗室學術休假。就在普瑞舍由於聯繫不上查爾菲而無法展開合作計劃的時候,GFP故事的最後一位主角錢永健教授 (Roger Tsien) 在1992年5月讀到了普瑞舍的新論文。錢教授從研究生時代開始就希望通過熒光共振能量轉移 (Fluorescence Resonance Energy Transfer, FRET) 來研究蛋白之間的相互作用,幾年來他一直想獲得編碼熒光蛋白的基因。將標記基因導入要研究的細胞要比標記蛋白容易許多,同樣是有心人的錢教授一眼就能看出普瑞舍手上這個cDNA克隆的價值。普瑞舍在電話裏告訴錢教授:由於申請經費的困難,他將很快離開WHOI而前往美國農業部就職,並從此告別GFP的研究。普瑞舍願意馬上分享GFP基因的克隆,可惜錢教授的實驗室裏雖然化學高手眾多,但還無人掌握分子生物學的技術,他需要等1992年10月新招的博士後海姆 (Roger Heim) 報到之後才能接收處理普瑞舍寄來的樣品。這五個月的延遲反轉了查爾菲幾乎與GFP擦肩而過的“劇情”。
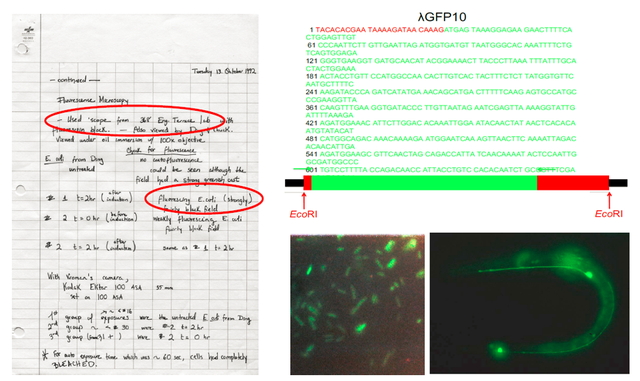
查爾菲在1992年秋季開學前回到哥倫比亞大學。9月初,一年級博士生吉婭 (Ghia Euskirchen) 希望來查爾菲的實驗室做第一個輪轉。查爾菲聽説吉婭剛在本校工程學院完成的碩士論文與熒光有關,不由感嘆普瑞舍三年來一直沒有音訊,只能和她通過電腦文獻檢索尋找與GFP有關的課題設計思路。查爾菲看到普瑞舍年初發表的完整GFP基因序列後喜出望外,立刻通過電話聯繫重啓計劃中的合作。拿到普瑞舍的GFP克隆後,查爾菲注意到由於分子克隆過程中只用限制性內切酶而未用PCR技術 (1992年前後,包括WHOI在內的很多美國科研院校都還沒有PCR儀器。即使在哈佛等常春藤院校,也需要同一樓層的多家實驗室共用一台),λGFP10在GFP編碼序列的兩端都有來自水母基因組的多餘非編碼DNA序列,其中5’端起始密碼子的上游多了25個鹼基對 (圖19右上,紅色標註)。查爾菲的分子生物學直覺告訴他,兩端多餘的序列可能會干擾GFP在大腸桿菌中的表達,於是他指導首次上手分子克隆實驗的吉婭在高年級博士生薛定的幫助下,利用PCR只把GFP編碼序列轉到表達質粒中。
幾周後,吉婭獲得了許多包含GFP表達質粒的菌落。她想既然查爾菲認為GFP的蛋白產物可能直接發出熒光,不妨拿着培養皿回到熟悉的工程學院,直接用那裏的熒光顯微鏡碰碰運氣。1992年10月13日,吉婭的實驗筆記本 (圖19左) 完整記錄了這一出乎意料的“尤里卡時刻” (Eureka moment):多個大腸桿菌菌落在顯微鏡下發出漂亮的綠色熒光!查爾菲看到後自然激動不已,他連續幾天拿着吉婭拍攝的顯微鏡照片四處炫耀 (圖19右下)。實驗結果清楚證明:GFP蛋白無需來自水母的任何輔因子或者轉化酶就能自發在另外一個物種的細胞中發出綠色熒光。
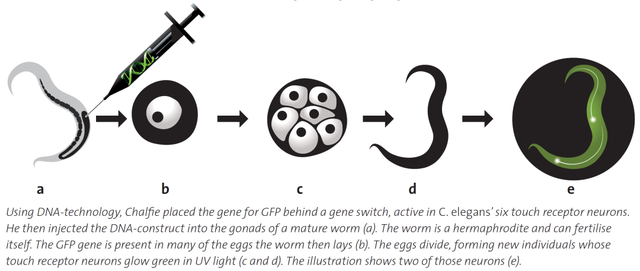
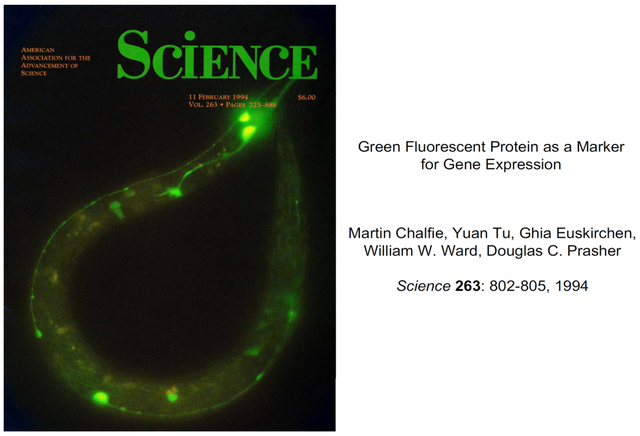
吉婭在完成這一實驗後很快去另一個實驗室輪轉,查爾菲讓技術員嘗試一個新的實驗:先將GFP基因與秀麗線蟲觸覺感受神經元的特異啓動子 (promoter) 相連,然後用顯微注射把新構建的質粒轉入成熟線蟲的性腺。只要GFP的表達成功,雌雄同體的線蟲產生的下一代幼蟲中的觸覺感受神經元就會被綠色熒光在顯微鏡下點亮 (圖20)。這一成功的突破性實驗最終以Science雜誌封面論文的形式載入科學史冊 (圖21)。