我們為什麼研究G蛋白偶聯受體?_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2021-12-16 17:38

GPCR簡介
想象一個美好的週五傍晚,你終於完成了一週辛苦的工作,看了一眼窗外華燈初上,推開窗聞到了一陣食物的芬芳,你覺得餓了。你出門想找點吃的,路上一輛摩托車貼着你開過,嚇得你心跳快了半拍。終於到了飯店,你點了烤串和啤酒,咬一口滋滋作響的羊肉,油脂香混合着幸福感直衝大腦,你感到一陣快樂……
在這個事件中,G蛋白偶聯受體(簡稱GPCR)介導幾乎每一步反應。視紫紅質的激活讓你看到東西,嗅覺受體的激活讓你聞到香味,飢餓素受體的激活讓你想攝入食物,腎上腺素受體的激活讓你心跳加快,味覺受體的激活讓你感知食物的美味,多巴胺受體的激活讓你感到快樂。

GPCR是一類具有七次跨膜螺旋的膜蛋白受體,在人體裏面有超過800個家族成員,它們參與調節人類生命活動的方方面面(圖1)。如果人類是由化學反應調控的機器的話,GPCR就是機器裏面的調節按鈕。如果我們通過藥物來調控這些按鈕GPCR的活性,就可以調節人的生理病理狀態,從而起到治療疾病的目的。因為這個原因,GPCR是非常重要的藥物靶點,目前FDA批准的藥物約三分之一通過靶向GPCR來發揮藥效[1]。在我開始GPCR研究之後,我就養成了仔細閲讀藥品説明書的習慣。有一次我因為咽炎咳嗽,大夫給我開了“開瑞坦”和“孟魯斯特納”,我一讀説明書發現前者是組胺(H1)受體拮抗劑,後者是白三烯受體(CysLR1)拮抗劑,越發讓我堅信研究GPCR大有可為。此外還有很多GPCR藥物用於治療多種威脅生命的重大疾病,如β腎上腺素受體阻滯劑美替洛爾(Metipranolol)用於治療心律不齊和高血壓;而β2腎上腺素受體激動劑福莫特羅(Formoterol)和沙美特羅(Salmeterol)用於治療慢阻肺和哮喘;5-羥色胺受體1A的激動劑阿立哌唑(Aripiprazole)和維拉唑酮(Vilazodone)用於治療精神分裂症和中重度抑鬱症等。眾多GPCR靶向的藥物及其龐大的市場份額(約佔全部治療藥物市場份額的27%)也反映了GPCR作為藥物靶點的潛能與重大意義。
GPCR結構解析歷史
由於GPCR重要的生理和藥理功能,解析其結構成為了許多結構生物學家的目標。在這個過程中不少科學家採用不同的方法做出了傑出的工作,其中尤為突出的是一個半路出家進入結構領域的醫學博士——斯坦福大學的Brian Kobilka教授。我將主要介紹Brian的工作,一方面因為Brian在這個方向做的工作尤其出色,另一方面因為Brian是我的博士後導師,我對他的工作比較熟悉。
在人的GPCR結構被解析之前,兩類七次跨膜的膜蛋白結構被解析。一類是來自鹽沼鹽桿菌(Halobacterium salinarium)的細菌視紫紅質(Bacteriorhodopsin)[2-5],一類是牛眼睛裏面提出來的視紫紅質(Rhodopsin) [6]。其中細菌視紫紅質雖然是七次跨膜蛋白,但它是一類感光的離子通道,工作機理不同於G蛋白偶聯受體,結構上也和GPCR略有差異。牛眼睛裏提出的視紫紅質結構是第一個G蛋白偶聯受體結構[6]。視紫紅質的結構工作對於後續其他GPCR的結構解析提供了指導。
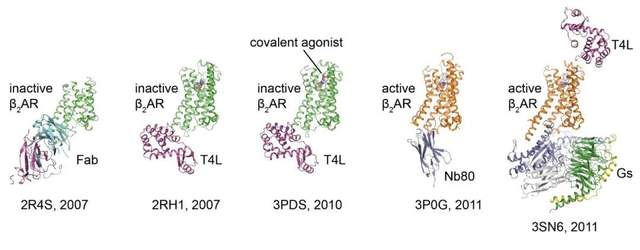
GPCR結構如何指導藥物開發
隨着受體表達純化條件的成熟以及電鏡技術的革命性突破,目前已經有許多不同GPCR結合不同配體的激活態或非激活態結構被報道出來。這些結構大大增進了我們對藥物與GPCR相互作用和GPCR與下游G蛋白或者arrestin信號傳遞分子機理的理解。GPCR一直備受關注的主要原因是因為它們是重要的藥物靶點。在獲得了這麼多的結構信息之後,這些信息如何能夠指導我們設計更好的藥物呢?我將利用下面三個例子加以介紹。
第一個例子是利用結構指導藥物的改造。這是由我博士後時的實驗室(清華大學Kobilka實驗室)和合作者們一起完成的一個課題。在這個工作裏我們試圖開發一種對M3乙酰膽鹼受體具有選擇性的抑制劑,這樣的化合物可能對如慢阻肺等呼吸道疾病具有治療效果。而我們想減少對M2乙酰膽鹼受體的抑制活性,以儘量減少對心臟的潛在副作用。這個工作的難點在於M2受體和M3受體的正構配體結合口袋非常相似,幾乎一模一樣。只有一個氨基酸不同。這個氨基酸在M2受體中是比較大的苯丙氨酸(Phe),在M3受體中是比較小的亮氨酸(Leu)。針對這單個氨基酸的區別,我們通過結構分析、分子對接、動態模擬、化學合成等手段,改造了一個本來對M3受體沒有選擇性的藥物。改造過程中,在化合物的一個特定位置引入一個氟原子。按照基於結構的設計,這個氟原子可以和M3受體中比較小的亮氨酸共存,但是卻會和M2受體中比較大的苯丙氨酸在位置上有衝突。通過這種方式,我們得到了具有M3受體選擇性(體外實驗105倍、體內實驗>1000倍)的小分子化合物並利用結構生物學驗證了其選擇性的分子基礎[16]。這個工作證明了基於結構精準改造藥物的可行性。

第二個例子是利用結構進行分子對接,虛擬篩選目的GPCR的藥物分子。這是來自UCSF大學的Brian Schoichet教授和John Irwin教授與北卡羅來納州大學教堂山分校Bryan Roth教授的合作成果。在這個工作裏,研究者們針對D4多巴胺受體(精神分裂症和帕金森症的藥物靶標)進行了一個大規模的虛擬篩選。他們一共對D4多巴胺受體的正構配體結合口袋虛擬對接了1.38億種不同的化合物。由於每種化合物有不同的對接模式,他們一共需要計算70萬億(70,000,000,000,000)種不同的結合方式。這個數字聽起來特別龐大,但是利用強大的計算資源,在這個課題中他們只花了不到一天半就算完了。注意這是2019年發表的工作,隨着計算能力的進一步提升,將來需要的時間會更短。在他們虛擬篩選出的化合物中,有一個化合物(ZINC621433143)表現出2.3 nM的高親和力。這個化合物是多個手性異構體的混合物。它的其中一個手性異構體(ZINC621433144)表現出對D4多巴胺受體0.18 nM的親和力,以及相比於其他亞型的多巴胺受體超過2500倍的選擇性。這樣,他們通過虛擬篩選直接找到了目前對D4多巴胺受體親和力最高,選擇性最強的激動劑。這樣的化合物可能具有治療精神類疾病的潛力。
第三個例子整合了第一個和第二個故事裏面用的兩種方法。這是來自格拉斯哥大學的Andrew Tobin教授和Sosei-Heptares公司Malcolm Weir博士團隊以及多個團隊的合作。在這個工作中他們基於結構開發了一個M1乙酰膽鹼受體的特異性激動劑,這個化合物具有治療老年痴呆症(AD)的潛力。因為人的記憶和大腦內的膽鹼能系統有關,提升腦內的乙酰膽鹼水平可能改善老年痴呆症患者的認知能力。臨牀用於治療AD患者的藥物中有一類是乙酰膽鹼酶抑制劑,如多奈哌齊(donepezil)。這類藥物通過抑制乙酰膽鹼的水解,提升體內整體乙酰膽鹼的水平,在早期AD患者中有一定療效。但是乙酰膽鹼酶抑制劑藥物在使用中存在明顯的劑量依賴的副作用,尤其是胃腸系統副作用。這些副作用限制了它們的臨牀應用。這是因為這類藥物通過提升體內整體乙酰膽鹼水平,同時激活人體所有的乙酰膽鹼受體,而有些受體的激活會引起副作用。人體內一共有5類乙酰膽鹼受體:M1,M2,M3,M4和M5。其中M1受體是治療老年痴呆的主要靶點,而M2和M3受體是主要的副作用靶點。因此研究人員希望開發特異性激活M1受體的激動劑。在這個工作中,研究人員基於M1受體的結構模型,通過分子對接虛擬篩選了具有新骨架的M1受體激動劑,並基於結構對其進行了優化,最終得到一個具有良好藥理性質的M1激動劑HLT9936。這個化合物可以順利穿過血腦屏障,在老鼠和比格犬等動物模型上表現出改善認知的療效,並且在健康老年志願者身上展示出激活學習和記憶中心的效果[17]。進一步的臨牀實驗正在進行中。
來自學術論文的基於結構指導藥物設計的例子還有很多,很多公司也在嘗試利用結構指導GPCR藥物的優化。Christ Tate教授2020年在Cell雜誌發表綜述總結GPCR結構對藥物設計的影響[18]。如他在文章中所説:通常一個藥物從研發立項到獲批上市需要10-15年的時間。Rhodopsin之外第一個高分辨率的GPCR結構的出現只是14年前的事情(2007年)。因此現在評估GPCR結構對於指導藥物研發直至藥物成功上市的影響還為時尚早。但從階段性進展來看,GPCR的結構信息對於設計更好的藥物具有重要的指導價值。值得一提的是雖然目前小分子藥物約有三分之一靶向GPCR,這些所有靶向GPCR的臨牀藥物只涵蓋了約100多個GPCR靶點。人體內有800多個GPCR,除去其中一半是負責嗅覺,剩下的400個裏面,還有300個左右GPCR屬於潛在的藥物開發靶點。針對這些GPCR的結構研究和藥物篩選很有可能在將來某一天為人類帶來更好的靶向藥物。這也是為什麼我們持續對研究GPCR的結構和功能感興趣的原因。
作者貢獻:
本文由劉翔宇執筆,任引航和張翔協助參與文章中部分內容的背景檢索。圖1由張欣手畫。
參考文獻
[1] Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B. & Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov 16, 829-842, doi:10.1038/nrd.2017.178 (2017).
[2] Henderson, R. et al. Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy. J Mol Biol 213, 899-929, doi:10.1016/S0022-2836(05)80271-2 (1990).
[3] Grigorieff, N., Ceska, T. A., Downing, K. H., Baldwin, J. M. & Henderson, R. Electron-crystallographic refinement of the structure of bacteriorhodopsin. J Mol Biol 259, 393-421, doi:10.1006/jmbi.1996.0328 (1996).
[4] Kimura, Y. et al. Surface of bacteriorhodopsin revealed by high-resolution electron crystallography. Nature 389, 206-211, doi:10.1038/38323 (1997).
[5] Pebay-Peyroula, E., Rummel, G., Rosenbusch, J. P. & Landau, E. M. X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases. Science 277, 1676-1681, doi:10.1126/science.277.5332.1676 (1997).
[6] Palczewski, K. et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science 289, 739-745, doi:10.1126/science.289.5480.739 (2000).
[7] Lefkowitz, R. J. & Hall, R. A funny thing happened on the way to Stockholm. (Pegasus Books, Ltd., 2021).
[8] Kobilka, B. K. Amino and carboxyl terminal modifications to facilitate the production and purification of a G protein-coupled receptor. Anal Biochem 231, 269-271, doi:10.1006/abio.1995.1533 (1995).
[9] Serrano-Vega, M. J., Magnani, F., Shibata, Y. & Tate, C. G. Conformational thermostabilization of the beta1-adrenergic receptor in a detergent-resistant form. Proc Natl Acad Sci U S A 105, 877-882, doi:10.1073/pnas.0711253105 (2008).
[10] Warne, T. et al. Structure of a beta1-adrenergic G-protein-coupled receptor. Nature 454, 486-491, doi:10.1038/nature07101 (2008).
[11] Rasmussen, S. G. et al. Crystal structure of the human beta2 adrenergic G-protein-coupled receptor. Nature 450, 383-387, doi:10.1038/nature06325 (2007).
[12] Rosenbaum, D. M. et al. GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function. Science 318, 1266-1273, doi:10.1126/science.1150609 (2007).
[13] Cherezov, V. et al. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science 318, 1258-1265, doi:10.1126/science.1150577 (2007).
[14] Rasmussen, S. G. et al. Crystal structure of the beta2 adrenergic receptor-Gs protein complex. Nature 477, 549-555, doi:10.1038/nature10361 (2011).
[15] Kang, Y. et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature 523, 561-567, doi:10.1038/nature14656 (2015).
[16] Liu, H. et al. Structure-guided development of selective M3 muscarinic acetylcholine receptor antagonists. Proc Natl Acad Sci U S A 115, 12046-12050, doi:10.1073/pnas.1813988115 (2018).
[17] Brown, A. J. H. et al. From structure to clinic: Design of a muscarinic M1 receptor agonist with potential to treatment of Alzheimer’s disease. Cell 184, 5886-5901 e5822, doi:10.1016/j.cell.2021.11.001 (2021).
[18] Congreve, M., de Graaf, C., Swain, N. A. & Tate, C. G. Impact of GPCR Structures on Drug Discovery. Cell 181, 81-91, doi:10.1016/j.cell.2020.03.003 (2020).

劉翔宇,分別於2004年和2011年獲得北京大學學士學位和博士學位,後加入諾獎得主Brian K. Kobilka 教授實驗室(清華)從事博士後研究,現為清華大學藥學院助理教授、清華大學結構生物學高精尖創新中心研究員。2012-2013年榮獲清華北大生命科學聯合中心博士後基金,2013-2017年獲得安進中國博士後獎學金,2021年獲得國家自然科學基金委員會優秀青年基金支持。他的主要研究領域為與疾病相關的G 蛋白偶聯受體(簡稱:GPCR)的結構生物學研究,以及基於結構的藥物設計。GPCR作為人類基因組編碼的最大類別膜蛋白超家族,有800多個家族成員,與人體生理代謝幾乎各個方面密切相關。
本文經授權轉載自微信公眾號“結構生物學高精尖創新中心”。



