美國食藥監局:強生疫苗已達緊急使用授權要求,即將決定是否批准
龙玥
(觀察者網 訊)據美國有線電視新聞網(CNN)2月24日報道,美國食品藥品監督管理局(FDA)當天發佈的一份報告顯示,該機構已審查相關數據,確定美國強生公司(Johnson & Johnson)的新冠疫苗符合緊急使用授權的要求。
美國FDA計劃在26日就是否批准強生疫苗召開諮詢會議,若最終通過,這將是美國第三個獲批的新冠疫苗。
強生疫苗的最大特點在於只需注射一劑,而當前已投入使用的新冠疫苗均須兩劑注射。美國FDA報告顯示,三期臨牀試驗中,在所有國家與地區,強生疫苗在接種至少14天后對中重度新冠肺炎症狀的保護效率為66.9%,在至少28天后為66.1%。
雖然強生疫苗整體有效性不及競爭對手輝瑞與莫德納,但強生疫苗對重症的預防效果是其主要賣點之一。
在美國,強生疫苗對新冠重症的保護效力近86%,在南非為近82%,在巴西為近88%。強生公司旨在預防中重度新冠肺炎症狀的三期試驗中有近4.4萬名受試者,分別來自美國、拉丁美洲、南非。
美國FDA顧問委員會成員及費城兒童醫院疫苗專家奧菲特(Paul Offit)24日對美聯社稱,強生疫苗能有效防止住院與死亡病例,該疫苗對患病死亡的預防水平可以與輝瑞及莫德納疫苗媲美。
在運輸存儲方面,強生疫苗的門檻也比輝瑞與莫德納疫苗低得多,該疫苗可在常規冷藏温度(2-8°C)中保存3個月。
強生疫苗 圖自強生公司官網
CNN指出,強生疫苗似乎還能應對在南非發現的變異病毒。這種變異病毒具有更強的傳染性,大多數病例出現在南非,在其他國家也有出現。美國FDA報告顯示,強生疫苗在南非的有效率為64%。
美國FDA報告顯示,對於無症狀感染的預防效率,強生公司發現,在臨牀試驗志願者接種疫苗後的第1天到第29天,疫苗對無症狀感染有“適度”的保護作用。同時,CNN説,當志願者在接種強生疫苗71天后接受新冠病毒抗體檢測時,該疫苗對抗無症狀感染的有效性似乎達到約74%。
數據顯示,輝瑞與莫德納疫苗在預防有症狀的新冠肺炎均有95%的保護作用。不過,近期包括在科學期刊《自然》上發表的一些初步研究表明,美國輝瑞與莫德納疫苗對變異新冠病毒防護效力較弱。2月17日,輝瑞公司在《新英格蘭醫學雜誌》上發表的研究顯示,他們的疫苗對在南非發現的變異毒株中和效力降低了三分之二。
本週,美國新冠肺炎累計死亡病例已經來到50萬例的高峯。由於疫苗管理混亂及冬季風暴席捲全美等原因,美國疫苗接種工作持續遭受拖累、進度不及預期。
美國疾控中心(CDC)數據顯示,截至當地時間24日,美國約有4523萬人接種了由輝瑞及莫德納公司生產的第一劑疫苗,但接種第二劑疫苗的人數不到首劑的一半,約為2060萬人。
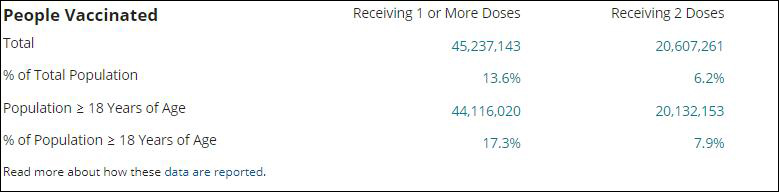
美國疫苗接種數據 圖自CDC
如此看來,強生公司單劑注射的接種方式將會有一定優勢。不過,強生公司也在研究自己的兩劑式疫苗,不過還得等幾個月才能出來結果。
同時,如果美國FDA批准了強生疫苗的緊急使用授權,該公司並不會在短時間內顯著提升美國的疫苗供應。美聯社表示,強生公司預計將在獲批後的第一週提供幾百萬劑疫苗。但該公司表示,預計到3月底其將提供2000萬劑疫苗,到6月底能向美國提供1億劑疫苗,到年底可向全球提供10億劑疫苗。
美國約翰斯·霍普金斯大學統計的疫情數據顯示,當前,美國新冠肺炎累計確診病例2832萬例,累計死亡病例50.4萬例。
本文系觀察者網獨家稿件,未經授權,不得轉載。