巴西拒絕引進“衞星V”,俄方:有另一個國家施壓
赵挪亚
【文/觀察者網 趙挪亞】由於變異毒株P.1的流行,再加上政府早期應對疫情不利,巴西進入2021年後,確診數一直在攀升,疫苗接種迫在眉睫。但在這樣的背景下,巴衞生監管部門(Anvisa)近期拒絕多州州長要求引進俄羅斯“衞星V”疫苗的請求。
當地時間4月26日晚,巴西國家衞生監督局當晚發表聲明稱,由於缺乏“持續有效”的數據,委員會匿名投票後決定,拒絕14個州州長引入“衞星V”疫苗的請求。
但“衞星V”推特隨後稱,巴衞生監督局的這一決定,背後有“政治因素”,美國曾施壓巴西不要使用俄疫苗。克里姆林宮發言人佩斯科夫(Dmitry Peskov)也表示,“我們反對將疫苗用作政治工具。”

巴衞生監督局拒絕引進“衞星V”疫苗的聲明
這份聲明稱,此前巴西最高法院法官裏卡多·萊萬多夫斯基(Ricardo Lewandowski)裁定,要在30天內決定是否通過“衞星V”疫苗,但局內技術部門收集資料並評估後發現,這種疫苗缺乏“持續有效”的數據,因此拒絕了州長引入疫苗的請求。
多名巴西衞生官員和專家也對這一決定發表了看法。衞生監督局負責人安東尼奧·託雷斯(Antonio Barra Torres)説:“我們絕不會允許數百萬巴西人接觸沒有經過質量、安全和有效性適當驗證的產品。至少在我們目前面臨的嚴峻形勢下,這利大於弊。”
衞生監督局藥品和生物製品部門負責人古斯塔沃·桑托斯(Gustavo Lima Santos)也解釋説,有關疫苗功效的數據是“不確定的”。同時,還有一些“關鍵問題”尚未得到解答,包括凝血等潛在的不良反應事件。
另一名局內的衞生監測專家安娜·阿勞霍(Ana Araujo)也表示,考慮到提交的所有文件、親自檢查時獲得的數據,以及其他監管機構提供的信息,俄羅斯疫苗的“固有風險”太大了。
俄羅斯“衞星V”疫苗 IC圖
但法新社在報道中提到,從上個月開始,巴衞生監督局就收到了“衞星V”疫苗的申請,隨後14個州的州長也在疫情形勢嚴峻的背景下發出請求,引入超3000萬劑的俄羅斯疫苗,巴西聯邦政府也訂購了約1000萬劑。
但是在這30天內,衞生監督局並沒有公佈調查結果,也沒有提到它認為缺乏的具體信息。
實際上,雖然“衞星V”在研製和剛推出之際遭到西方專家和媒體的質疑,但隨後在醫學權威雜誌《柳葉刀》上發表的研究結果還是顯示,這種疫苗不僅安全,還有超過90%的有效性。
但是,桑托斯告訴法新社,《柳葉刀》研究採用了與巴衞生監督局不同的審查程序。
巴衞生監督局發表聲明後,“衞星V”官方推特也發表聲明反駁稱:“我們與巴衞生監督局分享的必要和有效信息,超過批准(我們)疫苗的61個國家。我們希望決策是因為科學,而不是來自另一個國家的壓力。”
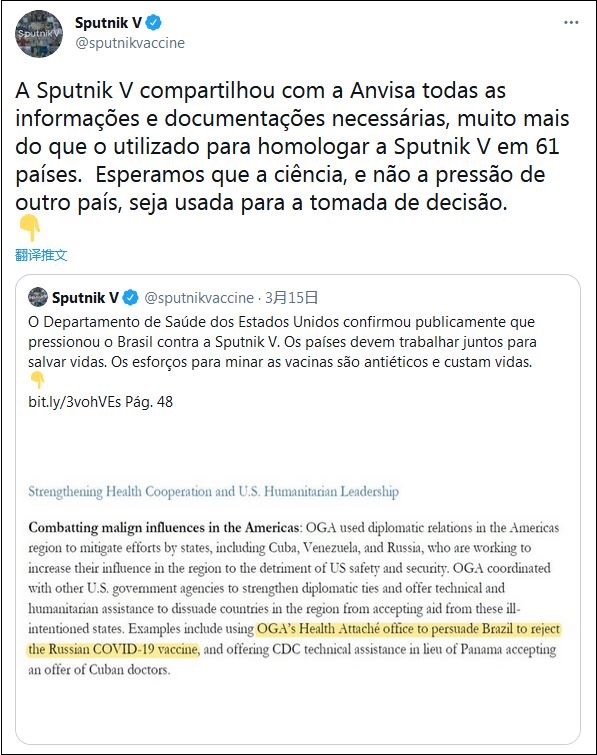
此外,它還援引美國衞生部2020年的年度報告稱,為削弱俄羅斯的影響力,美國衞生部下的全球事務辦公室(OGA)曾在去年説服巴西,“不要使用俄羅斯的疫苗”。
“不幸的是,巴衞生監督局推遲批准‘衞星V’是出於政治原因,與獲取信息或科學無關。”
俄羅斯政府發言人佩斯科夫27日表示,在發表評論之前,需要更多關於巴西決定的信息,並補充説,俄方沒有就此事與巴西政府局接觸。但他也表示:“我們反對將疫苗用作政治工具。”
法新社也提到,一些西方國家一直“衞星V”保持警惕,擔心俄羅斯方面會把它作為一種軟實力工具來推進自己的利益。
截至目前,已經至少有60個國家批准使用“衞星V”疫苗,其中包括10多個拉丁美洲和中美洲國家。阿根廷本月早些時候與俄羅斯簽署了一項協議,成為第一個生產“衞星V”的拉美國家,並將於6月開始全面生產。
俄官方發佈的批准“衞星V”疫苗的國家
“衞星V”疫苗由俄羅斯加馬列亞流行病與微生物學國家研究中心開發,採用的是腺病毒載體技術路線。據開發方面透露,這種疫苗不良反應有“注射部位疼痛、發燒、虛弱和頭痛”等。
另一方面,同樣採用腺病毒載體技術的強生和阿斯利康疫苗,都報告了接種後出現血栓的病例。
目前,巴西的疫情形勢並不樂觀,疫苗接種進度也相對緩慢。巴西衞生部26日傍晚公佈的最新數據顯示,巴西新增新冠確診病例28636例,累計確診14369423例;新增死亡1139例,累計死亡391936例。進入2021年來,巴西的新冠病例數一再攀升。
巴西主流媒體根據各州衞生廳公佈的數據聯合統計得出,截至26日20時,巴西全國已有超過2955萬人接種了第一劑新冠疫苗,約佔總人口的13.96%,大約1313萬人接種了第二劑疫苗,約佔總人口的6.2%。
目前,巴西國內使用的三種疫苗分別是輝瑞、阿斯利康以及來自中國的科興疫苗。
巴西衞生部長帕祖埃洛(Eduardo Pazuello)24日曾表示,巴西本打算在今年前4個月接受約1.03億劑疫苗,但最新數據顯示,巴西只接受了7300萬劑,相對於原定目標減少了約30%,博索納羅政府也因緩慢的疫苗接種進度而受到國內輿論批評。
本文系觀察者網獨家稿件,未經授權,不得轉載。
