免疫治療新藥發表兩篇《柳葉刀-腫瘤學》!_風聞
推医汇-汇聚健康行业资讯,推动学术交流。2022-01-18 18:16
當地時間1月14日,臨牀腫瘤研究領域全球頂尖期刊《柳葉刀-腫瘤學》(The Lancet Oncology)同日在線發表PD-L1抑制劑舒格利單抗(sugemalimab)治療非小細胞肺癌(NSCLC)的兩項多中心、隨機、雙盲3期臨牀研究結果。
其中,GEMSTONE-301研究由廣東省人民醫院吳一龍教授牽頭,在中國50家中心開展,研究表明,在同步或序貫放化療後未發生疾病進展的、不可切除的III期非小細胞肺癌患者中,舒格利單抗作為鞏固治療可以顯著延長無進展生存期(PFS)。值得關注的是,除入組同步放化療患者外,這項研究還開拓性地入組了序貫放化療患者,更符合真實世界臨牀實踐,覆蓋更多患者。序貫放化療在III期NSCLC患者的臨牀治療中被廣泛應用,但PD-1抑制劑或PD-L1抑制劑對這部分患者預後的影響此前一直缺乏證據。
GEMSTONE-302研究由上海市肺科醫院腫瘤科主任周彩存教授領銜,在中國35家中心開展。研究表明,在未經一線治療的IV期NSCLC患者中,在化療基礎上聯用舒格利單抗可顯著延長PFS,無論PD-L1水平如何。論文指出,GEMSTONE-302研究是“全球首個PD-L1抑制劑聯合化療作為一線治療同時為IV期鱗狀和非鱗狀NSCLC患者帶來PFS獲益的隨機雙盲3期臨牀試驗”。

圖片來源:123RF
GEMSTONE-301:III期NSCLC同步或序貫放化療,舒格利單抗均可有效鞏固治療
約30%的NSCLC患者在確診時為IIIA-IIIC,大多數都不可切除。儘管近10年來同步放化療都是III期不可切除NSCLC患者的標準療法,但實際上其中相當大比例的患者因耐受性或醫療條件限制無法接受同步放化療治療,因此序貫放化療在臨牀實踐中被廣泛應用。
2018年,PACIFIC試驗結果推動了新的治療標準,度伐利尤單抗(durvalumab)被用於治療同步放化療後未發生疾病進展的、不可切除的III期NSCLC患者。但PACIFIC試驗僅評估了接受同步放化療的患者。
此次來自GEMSTONE-301的療效和安全性數據不僅支持將舒格利單抗作為有效的鞏固療法用於III期NSCLC患者,而且同時適用於序貫或同步放化療的患者。

截圖來源:The Lancet Oncology
2018年8月30日至2020年12月30日期間,GEMSTONE-301研究在中國50家中心共入組了381例III期NSCLC患者。患者2:1隨機分組接受舒格利單抗(1200mg,n=255)或安慰劑(n=126),每3週一次靜脈輸注給藥,最長持續24個月。
入組標準:18歲或以上;ECOG體能狀態評分為0或1;既往接受同步或序貫放化療後未發生疾病進展。
所有被隨機分組的患者均接受了研究藥物治療。至數據截止日期(2021年3月8日),舒格利單抗組患者的中位隨訪時間為14.3個月(四分位距6.4–19.4),安慰劑組為13.7個月(四分位距7.1–18.4)。
主要研究終點為意向治療人羣中基於盲態獨立中心審閲評估的PFS。盲態獨立中心審閲結果顯示,相較於安慰劑,舒格利單抗顯著延長患者的PFS(9.0個月[95%CI 8.1–14.1] vs 5.8個月[95%CI 4.2–6.6]),疾病進展或死亡風險顯著降低36%(分層風險比[HR] 0.64 [95%CI 0.48-0.85];p=0.0026)。
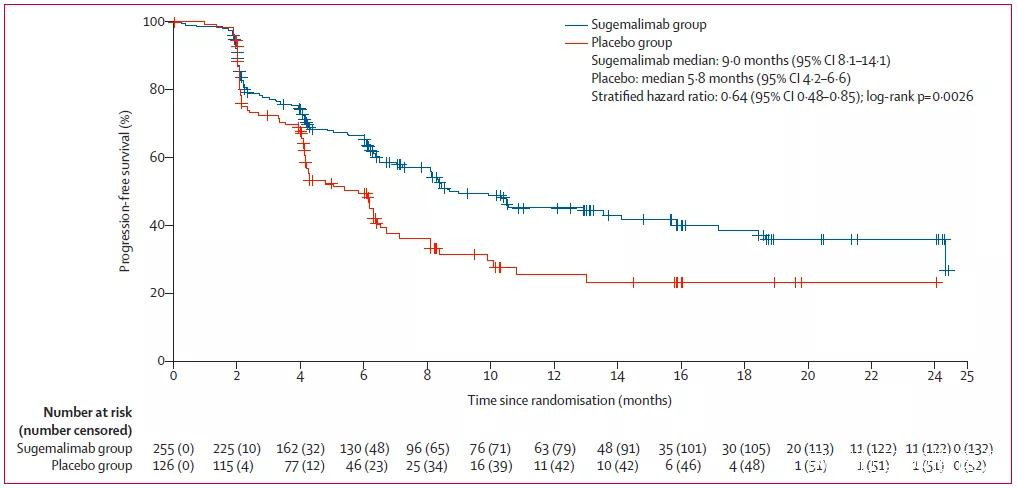
圖片來源:參考資料[1]
盲態獨立中心審閲的PFS結果
研究者評估的PFS結果與主要研究終點一致。亞組分析顯示,無論同步放化療(風險降低34%)還是序貫放化療(風險降低41%),患者均顯示出PFS的臨牀獲益。
盲態獨立中心審閲和研究者評估的兩組客觀緩解率(ORR)相似。在數據截止時,總生存期(OS)分析數據仍不成熟,初步分析結果提示舒格利單抗鞏固治療可將死亡風險降低56%。
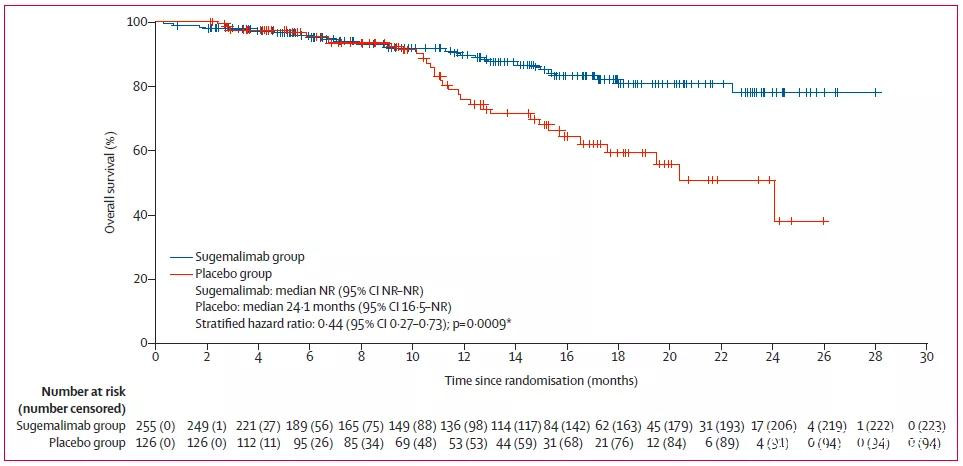
圖片來源:參考資料[1]
兩組患者的初步OS結果,數據尚不成熟
對所有至少接受一劑研究藥物的患者進行安全性評估。舒格利單抗的安全性良好,未發現新的安全性信號。
舒格利單抗組的255例患者和安慰劑組的126例患者中分別有22例(9%)和7例(6%)發生與研究藥物相關的治療期3級或4級不良事件。舒格利單抗組中最常見的與研究藥物相關的治療期3級或4級不良事件為肺炎或免疫介導性肺炎(7例[3%]患者),安慰劑組中為1例(<1%)患者。
舒格利單抗組的38例(15%)患者和安慰劑組的12例(10%)患者報告了與研究藥物相關的嚴重不良反應。
舒格利單抗組4例(2%)患者發生了研究藥物治療相關的死亡(2例感染性肺炎,1例感染性肺炎合併免疫介導性肺炎,1例急性肝衰竭),安慰劑組未報告藥物治療相關的死亡。
GEMSTONE-302:III期NSCLC同步或序貫放化療,舒格利單抗均可有效鞏固治療
PD-1抑制劑聯合化療一線治療轉移性鱗狀或非鱗狀NSCLC患者的有效性已經得到證實。然而,暫無有力證據顯示PD-L1抑制劑聯合化療可使晚期NSCLC患者獲益,值得進一步評估和驗證。
在IMpower131試驗中,PD-L1抑制劑阿替利珠單抗(atezolizumab)聯合化療一線治療鱗狀NSCLC,達到了一個共同主要終點(PFS),但OS沒有改善。在IMpower132試驗中,阿替利珠單抗聯合化療一線治療非鱗狀NSCLC未提高OS。
POSEIDON試驗顯示,度伐利尤單抗聯合化療相較於單獨化療顯著延長PFS,但同樣未顯著改善OS。
GEMSTONE-302研究數據支持了,無論PD-L1表達水平如何,PD-L1舒格利單抗聯合化療可安全有效地作為一線治療,用於轉移性鱗狀(聯合卡鉑+紫杉醇)或非鱗狀(聯合卡鉑+培美曲塞)NSCLC患者。

截圖來源:The Lancet Oncology
2018年12月13日至2020年5月15日期間,GEMSTONE-302研究在中國35家中心共入組479例患者,並2:1隨機分至舒格利單抗聯合鉑類化療組(n=320)或安慰劑聯合鉑類化療組(n=159)。
入組標準:年齡18-75歲,具有組織學或細胞學確診的IV期鱗狀或非鱗狀NSCLC,且無已知的EGFR敏感性突變、ALK融合、ROS1融合或RET融合,既往未接受過針對轉移性疾病的全身系統性治療,且ECOG體能狀態評分為0或1。
治療方案:舒格利單抗(1200 mg,每3週一次)聯合鉑類化療(鱗癌:卡鉑+紫杉醇,非鱗癌:卡鉑+培美曲塞)或安慰劑聯合鉑類化療(化療方案同上)。治療4個週期後,鱗狀NSCLC患者接受舒格利單抗或安慰劑維持治療,非鱗狀NSCLC患者接受舒格利單抗或安慰劑聯合培美曲塞維持治療,直至疾病進展,不可耐受不良反應或至35個週期。
主要研究終點為意向治療集中由研究者評估的PFS。中位隨訪時間為8.6個月(四分位距6.1-11.4]時的預設期中分析中,GEMSTONE-302研究達到主要終點,舒格利單抗聯合化療相較於僅化療顯著延長PFS(中位數7.8個月[95%CI:6.9-9.0] vs 4.9個月[95%CI:4.7-5.0]),疾病進展或死亡分線顯著降低50%(分層HR 0.50,95%CI:0.39-0.64,p<0.0001)。
在中位隨訪17.8個月(四分位距15.1-20.9)時進行的最終分析結果表明,舒格利單抗聯合化療可持續改善PFS(中位數9.0個月[95%CI:7.4-10.8] vs 4.9個月[95%CI:4.8-5.1]),疾病進展或死亡分線顯著降低52%(分層HR為0.48,95% CI:0.39-0.60)。
PFS亞組分析顯示,鱗癌(風險降低66%)與非鱗癌(風險降低41%)、PD-L1表達≥1%(風險降低54%)與PD-L1表達<1%(風險降低44%)的患者均顯示出臨牀獲益。
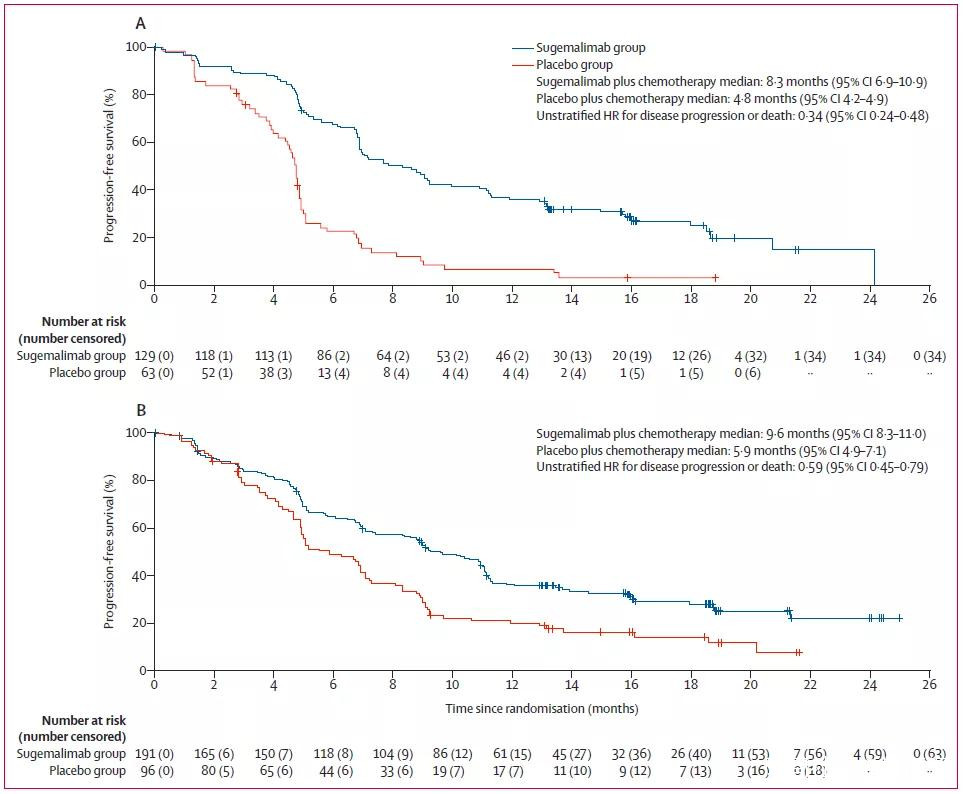
圖片來源:參考資料[2]
無論鱗狀(A)還是非鱗狀(B)NSCLC患者,舒格利單抗組的PFS都更長
舒格利單抗聯合化療在初步分析中顯示出OS獲益的趨勢。舒格利單抗組的OS更長(22.8個月 vs 17.7個月),死亡風險降低33%(分層HR 0.67[95%CI 0.50–0.90],p=0.0064)。舒格利單抗組和安慰劑組的12個月生存率分別為72.4%和62.0%,24個月生存率分別為47.1%和38.1%。目前,該研究正在繼續並將正式評估OS。

圖片來源:參考資料[2]
舒格利單抗組和安慰劑組的初步OS結果
此外,舒格利單抗組的客觀緩解率更高(63.4% vs 40.3%)、緩解持續時間更長(9.8個月vs 4.4個月)。在不同NSCLC亞型、不同腫瘤細胞PD-L1表達水平的亞組中,舒格利單抗組的緩解率和緩解持續時間都更有優勢。
安全性分析在所有接受過至少一次研究治療的患者中進行。結果顯示舒格利單抗聯合化療的安全性良好,未發現新的安全性信號。
最常見的與任一治療藥物相關的3-4級不良事件為中性粒細胞計數降低(舒格利單抗組104例[32.5%] vs安慰劑組52例[32.7%])、白細胞計數降低(45例[14.1%] vs 27例[17.0%])、貧血(43例[13.4%] vs 18例[11.3%])、血小板計數降低(33例[10.3%] vs 15例[9.4%])和中性粒細胞減少症(12例[3.8%] vs 7例[4.4%])。
舒格利單抗組和安慰劑組分別有22.8%和19.5%發生與任一治療藥物相關的嚴重不良事件。
舒格利單抗組中有10例(3.1%)報告了與任一治療藥物相關死亡(2例患者發生感染性肺炎,1例患者發生感染性肺炎合併呼吸衰竭,1例患者發生骨髓抑制合併感染性休克,各有1例患者發生呼吸衰竭、腹痛、心力衰竭和免疫介導性肺炎;另2例死因不明)。安慰劑組有2例(1.3%)報告了與任一治療藥物相關死亡(感染性肺炎和多器官功能不全綜合徵)。
舒格利單抗(擇捷美)由基石藥業開發。目前,舒格利單抗針對III期NSCLC的新藥上市申請正在接受中國國家藥品監督管理局審評。基於GEMSTONE-302研究結果,近日,舒格利單抗已在中國獲批聯合化療用於轉移性NSCLC的一線治療。
參考資料
[1] Caicun Zhou, et al., (2022). Sugemalimab versus placebo, in combination with platinum-based chemotherapy, as first-line treatment of metastatic non-small-cell lung cancer (GEMSTONE-302): interim and final analyses of a double-blind, randomised, phase 3 clinical trial. The Lancet Oncology, DOI: https://doi.org/10.1016/S1470-2045(21)00650-1
[2] Qing Zhou, et al., (2022). Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage III non-small-cell lung cancer in China (GEMSTONE-301): interim results of a randomised, double-blind, multicentre, phase 3 trial. The Lancet Oncology, DOI: https://doi.org/10.1016/S1470-2045(21)00630-6
[3] 基石藥業宣佈《柳葉刀-腫瘤學》重磅發表擇捷美®(舒格利單抗注射液)治療III期非小細胞肺癌註冊臨牀研究. Retrieved January 17, 2022 from https://www.cstonepharma.com/html/news/3053.html
[4] 基石藥業宣佈擇捷美®(舒格利單抗注射液)IV期非小細胞肺癌註冊臨牀研究成果在《柳葉刀-腫瘤學》特邀發表. Retrieved January 17, 2022 from https://www.cstonepharma.com/html/news/3054.html