中國mRNA疫苗處子秀,有哪些看點?_風聞
疫苗与科学-疫苗与科学官方账号-2022-02-18 10:18
2022年1月24日,《柳葉刀·微生物》在線發表中國首個mRNA技術COVID-19疫苗的Ⅰ期臨牀試驗論文,這是中國mRNA疫苗的重要里程碑。論文發表的同時,該疫苗的海外Ⅲ期臨牀試驗也至少進行了4個月。陶醫生覺得,該mRNA疫苗很可能今年在中國獲得緊急使用批准。那樣的話,2022年就是中國mRNA疫苗的元年。COVID-19疫情爆發後幾個月內,一場與病毒賽跑的疫苗研發競賽也在全球拉開帷幕,主要選手有中國、美國、英國、俄羅斯、印度等。中國率先宣佈用5條技術路線研發疫苗,成為研發路線最多的國家,可謂前無古人後無來者,志在必得。2年後的今天,全球已經接種COVID-19疫苗超100億劑。其中大規模使用的疫苗,中國實現了3條技術路線,分別是滅活疫苗、腺病毒載體疫苗、重組蛋白疫苗;美國2條,分別是mRNA疫苗和腺病毒載體疫苗;英國和俄羅斯都只有腺病毒載體疫苗;印度只有滅活疫苗。中國5條技術路線實現了3條,只剩下核酸疫苗和流感病毒載體疫苗路線尚未實現大規模應用。 陶醫生認為,流感病毒載體疫苗在技術上或許可以實現,但由於錯過了最佳時機,即便成功了也無法在與現役疫苗的競爭中獲勝,商業風險巨大,所以沒有公司會冒險,只是不排除繼續做基礎研究。中國的核酸疫苗,則一定可以成功,因為有美國兩款mRNA疫苗成功的先例,時機上也不算太晚。關於原子彈的研製,最難的是不知道能不能成功,如果有成功的先例,則後來者一定可以做出來,核酸疫苗裏的mRNA疫苗也是如此。雖然這次疫情前,治療性mRNA疫苗已經在臨牀領域有不少應用,但作為人用預防性疫苗,這還是第一次。美國人第一個吃mRNA疫苗這隻螃蟹,很幸運賭贏了。現在,全球接種mRNA技術的COVID-19疫苗估計不少於30億劑,這幾乎是在2021年一年內實現的,這在科學和商業上都是空前巨大的成功,且涉及兩款mRNA疫苗,並非偶然。中國的生物科技領跑全球或許還需時日,但緊盯美國,亦步亦趨,成功是必然,還能伺機超越。
陶醫生認為,流感病毒載體疫苗在技術上或許可以實現,但由於錯過了最佳時機,即便成功了也無法在與現役疫苗的競爭中獲勝,商業風險巨大,所以沒有公司會冒險,只是不排除繼續做基礎研究。中國的核酸疫苗,則一定可以成功,因為有美國兩款mRNA疫苗成功的先例,時機上也不算太晚。關於原子彈的研製,最難的是不知道能不能成功,如果有成功的先例,則後來者一定可以做出來,核酸疫苗裏的mRNA疫苗也是如此。雖然這次疫情前,治療性mRNA疫苗已經在臨牀領域有不少應用,但作為人用預防性疫苗,這還是第一次。美國人第一個吃mRNA疫苗這隻螃蟹,很幸運賭贏了。現在,全球接種mRNA技術的COVID-19疫苗估計不少於30億劑,這幾乎是在2021年一年內實現的,這在科學和商業上都是空前巨大的成功,且涉及兩款mRNA疫苗,並非偶然。中國的生物科技領跑全球或許還需時日,但緊盯美國,亦步亦趨,成功是必然,還能伺機超越。 雲南沃森生物的mRNA疫苗(ARCoV),是中國核酸疫苗的第一步。COVID-19疫情發生以來,沃森生物積極投入研發,先後佈局mRNA、腺病毒載體、重組蛋白3條新型技術路線。眾所周知,疫苗產業具有高投入、慢產出、高風險的特點,同時推進3條技術路線的創新型COVID-19疫苗顯示出了沃森生物強大的研發實力和產業化能力。 作為一家專業從事人用疫苗等生物技術藥並集研發、生產、銷售於一體的高科技生物製藥企業,成立20年來,沃森生物先後承擔5項國家“863”計劃和13項國家“重大新藥創制專項”,“十二五”期間獲得藥品批件11個,“十三五”期間獲得藥品批件9個。在沃森生物已上市的疫苗中,肺炎球菌13價多糖結合疫苗(PCV13)是我國自主研發、採用國際最高標準的對照設計、並完全擁有自主知識產權的首個國產疫苗產品,打破國外在肺炎結合疫苗領域長達十餘年的壟斷。陶醫生多次介紹過這款中國第一、全球第二的肺炎結合疫苗,詳見以下兩個鏈接。
雲南沃森生物的mRNA疫苗(ARCoV),是中國核酸疫苗的第一步。COVID-19疫情發生以來,沃森生物積極投入研發,先後佈局mRNA、腺病毒載體、重組蛋白3條新型技術路線。眾所周知,疫苗產業具有高投入、慢產出、高風險的特點,同時推進3條技術路線的創新型COVID-19疫苗顯示出了沃森生物強大的研發實力和產業化能力。 作為一家專業從事人用疫苗等生物技術藥並集研發、生產、銷售於一體的高科技生物製藥企業,成立20年來,沃森生物先後承擔5項國家“863”計劃和13項國家“重大新藥創制專項”,“十二五”期間獲得藥品批件11個,“十三五”期間獲得藥品批件9個。在沃森生物已上市的疫苗中,肺炎球菌13價多糖結合疫苗(PCV13)是我國自主研發、採用國際最高標準的對照設計、並完全擁有自主知識產權的首個國產疫苗產品,打破國外在肺炎結合疫苗領域長達十餘年的壟斷。陶醫生多次介紹過這款中國第一、全球第二的肺炎結合疫苗,詳見以下兩個鏈接。 重磅:國產肺炎13價結合疫苗亮相啦,世界第二!
重磅:國產肺炎13價結合疫苗亮相啦,世界第二! 技術分析與接種之道:國產肺炎13價結合疫苗正在研發階段的疫苗中,沃森生物還有宮頸癌疫苗、流腦4價結合疫苗、流感4價疫苗、重組手足口疫苗,分別處於臨牀研究的不同階段。如今,沃森生物已是國內唯一佈局四大疫苗技術平台的自主研發生物科技公司。ARCoV實際是三家中國機構的合作結晶,分別是軍事醫學研究院、艾博生物和沃森生物。其中,軍事醫學研究院提供檢測和評價技術、艾博生物提供mRNA技術和包裹保護mRNA的脂質體技術、沃森生物負責臨牀試驗和產業化。目前ARCoV成為我國首個、全球第四個進入臨牀試驗的mRNA技術COVID-19疫苗項目,並開展了國際多中心臨牀試驗,目前正在進行海外三期臨牀試驗,有望實現我國創新技術路線COVID-19疫苗“零”的突破。
技術分析與接種之道:國產肺炎13價結合疫苗正在研發階段的疫苗中,沃森生物還有宮頸癌疫苗、流腦4價結合疫苗、流感4價疫苗、重組手足口疫苗,分別處於臨牀研究的不同階段。如今,沃森生物已是國內唯一佈局四大疫苗技術平台的自主研發生物科技公司。ARCoV實際是三家中國機構的合作結晶,分別是軍事醫學研究院、艾博生物和沃森生物。其中,軍事醫學研究院提供檢測和評價技術、艾博生物提供mRNA技術和包裹保護mRNA的脂質體技術、沃森生物負責臨牀試驗和產業化。目前ARCoV成為我國首個、全球第四個進入臨牀試驗的mRNA技術COVID-19疫苗項目,並開展了國際多中心臨牀試驗,目前正在進行海外三期臨牀試驗,有望實現我國創新技術路線COVID-19疫苗“零”的突破。 沃森生物的ARCoV目前,ARCoV具有明確優越性的是冷鏈友好:ARCoV只需在常規的疫苗冷鏈温度(2~8度)下運輸和儲存,而美國的兩款mRNA疫苗都需要零下20度或更低的冷凍温度。常規冷鏈疫苗的全球適應性更強,儲運成本也更低。據陶醫生了解,ARCoV實現冷鏈優越性的主要原因是:艾博生物的專利脂質體對mRNA的保護更佳;此外ARCoV裏的mRNA編碼RBD蛋白,友商的mRNA編碼S蛋白,前者比後者更短,更穩定些。
沃森生物的ARCoV目前,ARCoV具有明確優越性的是冷鏈友好:ARCoV只需在常規的疫苗冷鏈温度(2~8度)下運輸和儲存,而美國的兩款mRNA疫苗都需要零下20度或更低的冷凍温度。常規冷鏈疫苗的全球適應性更強,儲運成本也更低。據陶醫生了解,ARCoV實現冷鏈優越性的主要原因是:艾博生物的專利脂質體對mRNA的保護更佳;此外ARCoV裏的mRNA編碼RBD蛋白,友商的mRNA編碼S蛋白,前者比後者更短,更穩定些。 艾博生物根據全球這一年來的疫苗使用經驗,mRNA疫苗在保護效果上具有明顯優勢,超過滅活疫苗和腺病毒載體疫苗20個百分點,但不良反應也最多(超過1/2),還發現了一種罕見但不嚴重的不良反應:心肌炎(16~39歲人羣發生率約1.6例/10萬劑)。那麼,中國的mRNA疫苗會怎樣呢?數據來了。《柳葉刀·微生物》在線發表的ARCoV疫苗Ⅰ期臨牀試驗結果顯示:ARCoV安全且有良好的耐受性,並能誘導產生強烈的免疫反應。
艾博生物根據全球這一年來的疫苗使用經驗,mRNA疫苗在保護效果上具有明顯優勢,超過滅活疫苗和腺病毒載體疫苗20個百分點,但不良反應也最多(超過1/2),還發現了一種罕見但不嚴重的不良反應:心肌炎(16~39歲人羣發生率約1.6例/10萬劑)。那麼,中國的mRNA疫苗會怎樣呢?數據來了。《柳葉刀·微生物》在線發表的ARCoV疫苗Ⅰ期臨牀試驗結果顯示:ARCoV安全且有良好的耐受性,並能誘導產生強烈的免疫反應。 http://t.cn/A6JkiIRF有一件事要特別提醒各位讀者:這是Ⅰ期臨牀試驗結果,ARCoV也已經完成了Ⅱ期臨牀試驗,去年7月和9月分別開始在國內和境外開展Ⅲ期臨牀試驗,這説明其臨牀試驗進展順利。疫苗Ⅰ期臨牀試驗主要是探索合適的劑量/接種程序、觀察安全性和免疫原性。ARCoV的志願者為18~59歲的120名成人。人數不是很多,但這是疫苗Ⅰ期臨牀試驗的常規操作,友商疫苗也是這個數量級的志願者人數。一、關於劑量和接種程序作為中國首個上臨牀試驗的mRNA疫苗,ARCoV的劑量分為5組,分別是5/10/15/20/25微克。120名志願者平均分為6組,5個劑量各一組(25微克組有4人退出),還有20人接種安慰劑作為對照組。美國的mRNA疫苗Ⅰ期臨牀試驗劑量分組情況是:輝瑞mRNA疫苗10/30/100微克(最終確定30微克),莫德納mRNA疫苗25/100/250微克(最終確定100微克)。可以看到,ARCoV有5個劑量組,多於友商的3個劑量組,但最高劑量只是友商最高劑量的1/4或1/10。據陶醫生了解,ARCoV最終確定上Ⅱ期和Ⅲ期臨牀的劑量為15微克,只是友商的1/2或3/10。由於友商mRNA疫苗的接種程序都是接種2劑(間隔4周),所以ARCoV也直接這樣安排,沒有接種1劑或更多劑。二、關於免疫原性疫苗的免疫原性和保護效果有關係,但不是一回事。免疫原性,就是疫苗刺激人體產生免疫力的能力,通常用抗體免疫水平的高低來衡量。免疫原性還包括疫苗刺激細胞免疫的能力,但相關指標複雜,比較起來困難,所以不同疫苗免疫原性的比較,還是以抗體為主。保護效果,是指疫苗保護人體免於感染/重症/死亡的能力,是希望疫苗最終能夠達到的效果。一般來説,免疫原性越好,保護效果也越好,但兩者並非直接等同。疫苗的Ⅰ期和Ⅱ期臨牀試驗,只能觀察免疫原性,只有Ⅲ期臨牀試驗才能觀察保護效果。ARCoV的Ⅰ期臨牀試驗,就是以觀察抗體為主,同時也觀察了細胞免疫。研究發現一個現象:不管是抗體免疫還是細胞免疫,ARCoV的免疫原性在5~25微克之間,都呈現兩邊低中間高的情況,也就是15微克組的免疫原性最好,25微克雖然劑量更高,但免疫原性反而下降了。A 抗體免疫情況下圖是ARCoV的RBD蛋白特異性IgG抗體水平。
http://t.cn/A6JkiIRF有一件事要特別提醒各位讀者:這是Ⅰ期臨牀試驗結果,ARCoV也已經完成了Ⅱ期臨牀試驗,去年7月和9月分別開始在國內和境外開展Ⅲ期臨牀試驗,這説明其臨牀試驗進展順利。疫苗Ⅰ期臨牀試驗主要是探索合適的劑量/接種程序、觀察安全性和免疫原性。ARCoV的志願者為18~59歲的120名成人。人數不是很多,但這是疫苗Ⅰ期臨牀試驗的常規操作,友商疫苗也是這個數量級的志願者人數。一、關於劑量和接種程序作為中國首個上臨牀試驗的mRNA疫苗,ARCoV的劑量分為5組,分別是5/10/15/20/25微克。120名志願者平均分為6組,5個劑量各一組(25微克組有4人退出),還有20人接種安慰劑作為對照組。美國的mRNA疫苗Ⅰ期臨牀試驗劑量分組情況是:輝瑞mRNA疫苗10/30/100微克(最終確定30微克),莫德納mRNA疫苗25/100/250微克(最終確定100微克)。可以看到,ARCoV有5個劑量組,多於友商的3個劑量組,但最高劑量只是友商最高劑量的1/4或1/10。據陶醫生了解,ARCoV最終確定上Ⅱ期和Ⅲ期臨牀的劑量為15微克,只是友商的1/2或3/10。由於友商mRNA疫苗的接種程序都是接種2劑(間隔4周),所以ARCoV也直接這樣安排,沒有接種1劑或更多劑。二、關於免疫原性疫苗的免疫原性和保護效果有關係,但不是一回事。免疫原性,就是疫苗刺激人體產生免疫力的能力,通常用抗體免疫水平的高低來衡量。免疫原性還包括疫苗刺激細胞免疫的能力,但相關指標複雜,比較起來困難,所以不同疫苗免疫原性的比較,還是以抗體為主。保護效果,是指疫苗保護人體免於感染/重症/死亡的能力,是希望疫苗最終能夠達到的效果。一般來説,免疫原性越好,保護效果也越好,但兩者並非直接等同。疫苗的Ⅰ期和Ⅱ期臨牀試驗,只能觀察免疫原性,只有Ⅲ期臨牀試驗才能觀察保護效果。ARCoV的Ⅰ期臨牀試驗,就是以觀察抗體為主,同時也觀察了細胞免疫。研究發現一個現象:不管是抗體免疫還是細胞免疫,ARCoV的免疫原性在5~25微克之間,都呈現兩邊低中間高的情況,也就是15微克組的免疫原性最好,25微克雖然劑量更高,但免疫原性反而下降了。A 抗體免疫情況下圖是ARCoV的RBD蛋白特異性IgG抗體水平。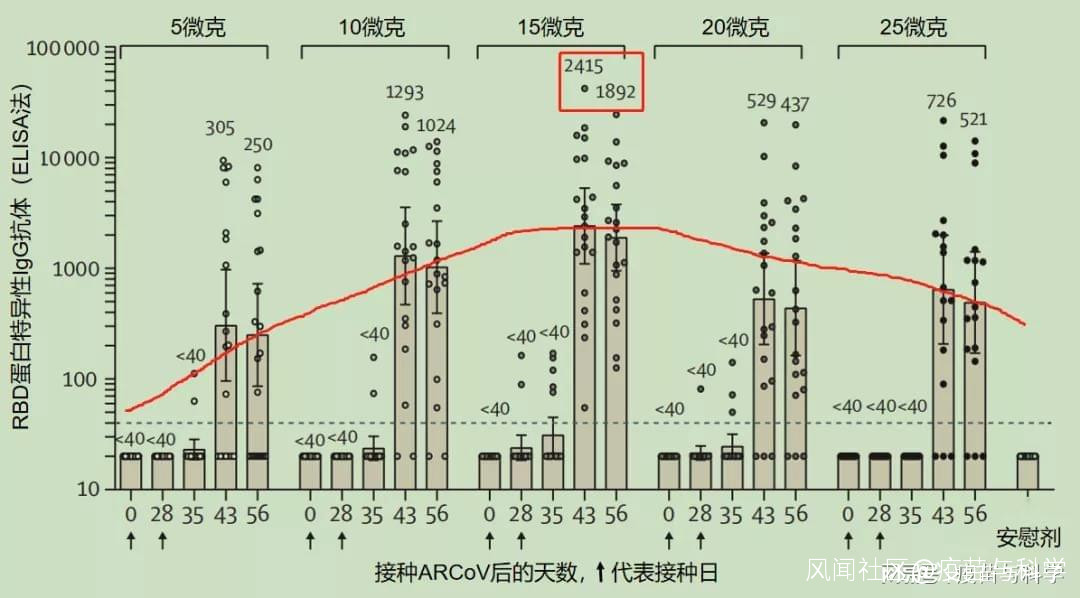 ARCoV的RBD-IgG抗體反應圖中顯示:15微克組在第1劑疫苗接種後第43天的抗體水平達到2415,是5微克組的7.9倍,是25微克組的3.3倍。另外還有兩種抗體分析,針對假病毒的中和抗體和針對真病毒的中和抗體,也呈現這樣的規律。研究者在討論中提到:15微克組激發的真病毒中和抗體水平,是自然感染者的兩倍。B 細胞免疫情況下圖是ARCoV激發的細胞免疫水平——特異性γ干擾素分泌細胞數。
ARCoV的RBD-IgG抗體反應圖中顯示:15微克組在第1劑疫苗接種後第43天的抗體水平達到2415,是5微克組的7.9倍,是25微克組的3.3倍。另外還有兩種抗體分析,針對假病毒的中和抗體和針對真病毒的中和抗體,也呈現這樣的規律。研究者在討論中提到:15微克組激發的真病毒中和抗體水平,是自然感染者的兩倍。B 細胞免疫情況下圖是ARCoV激發的細胞免疫水平——特異性γ干擾素分泌細胞數。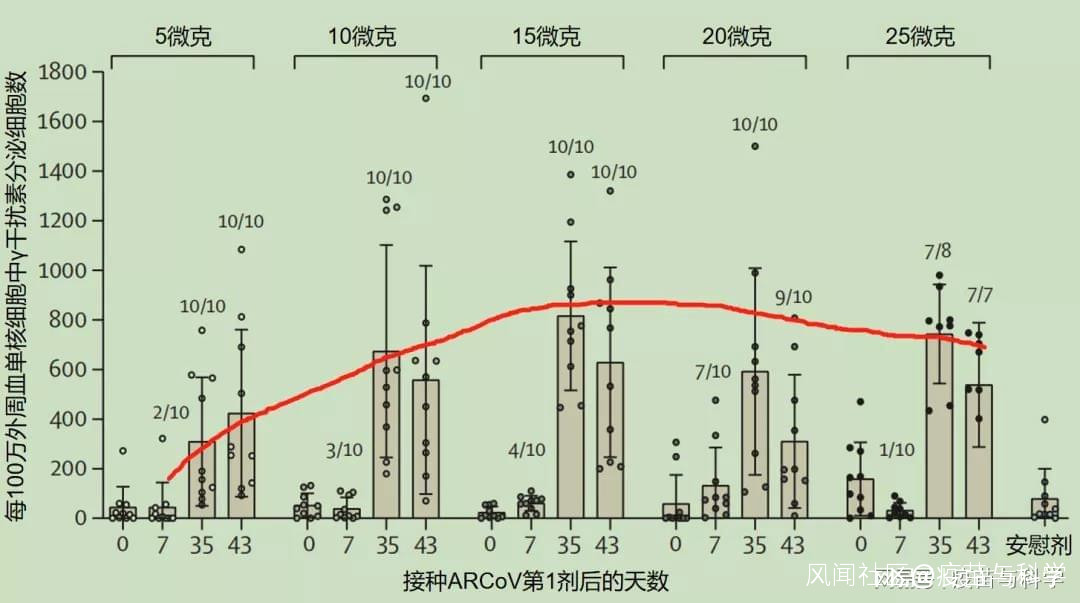 ARCoV激發的細胞免疫:特異性γ干擾素分泌細胞圖中顯示:15微克ARCoV激發的特異性γ干擾素分泌細胞100%陽性,且數量上也是最多的。另外還有一個白細胞介素2分泌細胞的定量分析,也是15微克組最高。根據以上結果,ARCoV在Ⅱ、Ⅲ期臨牀試驗中採用15微克接種2劑的接種程序,有充分的依據。從疫苗中和抗體相對自然感染者中和抗體的比值來看,15微克ARCoV達到了2,高於主流滅活疫苗和腺病毒載體疫苗,但低於友商的mRNA疫苗。陶醫生認為,這個情況可能與採用的抗原不同有關,友商採用的是穩定版病毒S蛋白,ARCoV採用的是比S蛋白分子小很多的RBD蛋白,當然也可能因為其他因素不同(比如人種差異,這在不良事件報告率中有體現),需要進一步研究。
ARCoV激發的細胞免疫:特異性γ干擾素分泌細胞圖中顯示:15微克ARCoV激發的特異性γ干擾素分泌細胞100%陽性,且數量上也是最多的。另外還有一個白細胞介素2分泌細胞的定量分析,也是15微克組最高。根據以上結果,ARCoV在Ⅱ、Ⅲ期臨牀試驗中採用15微克接種2劑的接種程序,有充分的依據。從疫苗中和抗體相對自然感染者中和抗體的比值來看,15微克ARCoV達到了2,高於主流滅活疫苗和腺病毒載體疫苗,但低於友商的mRNA疫苗。陶醫生認為,這個情況可能與採用的抗原不同有關,友商採用的是穩定版病毒S蛋白,ARCoV採用的是比S蛋白分子小很多的RBD蛋白,當然也可能因為其他因素不同(比如人種差異,這在不良事件報告率中有體現),需要進一步研究。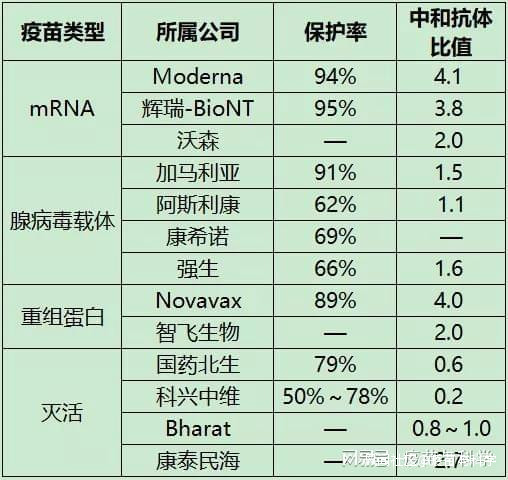 三、關於安全性5個劑量組的ARCoV,在不良事件報告率上,大致呈現劑量越大,不良事件報告率越高的趨勢。最低劑量的ARCoV,不良事件報告率也在10%以上。由於ARCoV最終決定用15微克作為後續研究的劑量,以下使用其15微克組的不良事件報告率(按美國FDA標準,以便與美國mRNA疫苗比較,和中國CFDA標準略有差異)。
三、關於安全性5個劑量組的ARCoV,在不良事件報告率上,大致呈現劑量越大,不良事件報告率越高的趨勢。最低劑量的ARCoV,不良事件報告率也在10%以上。由於ARCoV最終決定用15微克作為後續研究的劑量,以下使用其15微克組的不良事件報告率(按美國FDA標準,以便與美國mRNA疫苗比較,和中國CFDA標準略有差異)。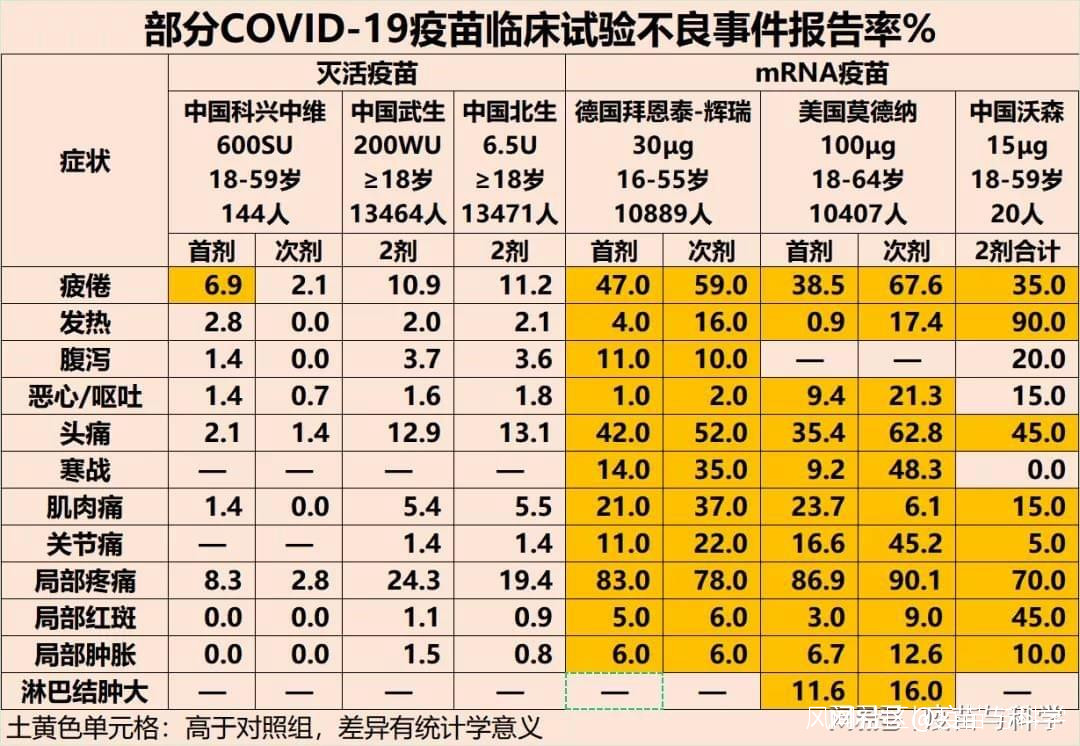 ARCoV的不良事件報告率與滅活疫苗和友商mRNA疫苗比較上圖可見,15微克ARCoV的不良事件報告率,明顯高於中國大規模使用的各個滅活疫苗,但和友商mRNA疫苗的不良反應報告率在一個級別上。土黃色單元格,是與對照組相比有差異的不良事件項目。可以看到,在疲倦、頭疼、肌肉痛、關節痛、接種局部疼痛、接種局部腫脹上,ARCoV與友商疫苗差不多甚至略低;在發熱、局部紅斑上,ARCoV高出友商疫苗不少。很多網友看到ARCoV的發熱率達到90%,就不淡定了。其實,發熱不算意外,只有高熱需要關注。研究人員在論文的討論部分,對發熱問題做了以下解釋,陶醫生認為是合理的,並且還要進一步研究。解釋1:按照美國FDA的標準,15微克ARCoV達到3級不良事件標準的高熱率為30%(6/20),輝瑞30微克mRNA疫苗BNT162b1(目前廣泛使用的是BNT162b2 )在美德中三國的Ⅰ期臨牀試驗中觀察到的高熱率分別為0%(0/12)、8%(1/12)和17%(4/24)。三國的高熱率不同,提示不同人種對mRNA疫苗的耐受性可能存在差異(陶醫生觀點:不排除是疫苗的工藝差異,導致了高熱率差異)。解釋2:莫德納和瑞輝的mRNA疫苗,在Ⅰ期(數十人)和Ⅲ期(上萬人)臨牀試驗中觀察到的不良事件報告率也有明顯差異,這提示在不同樣本量的情況下,會出現差異較大的結論。ARCoV的大樣本人羣觀察正在進行中(陶醫生觀點:大樣本的研究結論更加可靠,等ARCoV大樣本研究結果出來,屆時再分析比較更好,還需要關注mRNA疫苗已經確認的罕見心肌炎事件)。研究人員還提示,友商疫苗有第2劑不良事件報告率高於第1劑的現象,但ARCoV第1劑和第2劑的不良事件報告率接近(陶醫生觀點:現在下結論還為時尚早,大樣本研究結果是關鍵)。總體而言,志願者可以耐受ARCoV。ARCoV的常見不良事件與友商疫苗處於同一水平。總結:陶醫生認為,作為中國第一款上人體臨牀的mRNA疫苗,ARCoV的表現中規中矩,安全性可以接受,免疫原性還可以更高些,其優秀的冷鏈適應性,可以為更多發展中國家帶來便利。陶醫生期待其Ⅱ期臨牀試驗數據儘快發佈,Ⅲ期臨牀試驗順利。
ARCoV的不良事件報告率與滅活疫苗和友商mRNA疫苗比較上圖可見,15微克ARCoV的不良事件報告率,明顯高於中國大規模使用的各個滅活疫苗,但和友商mRNA疫苗的不良反應報告率在一個級別上。土黃色單元格,是與對照組相比有差異的不良事件項目。可以看到,在疲倦、頭疼、肌肉痛、關節痛、接種局部疼痛、接種局部腫脹上,ARCoV與友商疫苗差不多甚至略低;在發熱、局部紅斑上,ARCoV高出友商疫苗不少。很多網友看到ARCoV的發熱率達到90%,就不淡定了。其實,發熱不算意外,只有高熱需要關注。研究人員在論文的討論部分,對發熱問題做了以下解釋,陶醫生認為是合理的,並且還要進一步研究。解釋1:按照美國FDA的標準,15微克ARCoV達到3級不良事件標準的高熱率為30%(6/20),輝瑞30微克mRNA疫苗BNT162b1(目前廣泛使用的是BNT162b2 )在美德中三國的Ⅰ期臨牀試驗中觀察到的高熱率分別為0%(0/12)、8%(1/12)和17%(4/24)。三國的高熱率不同,提示不同人種對mRNA疫苗的耐受性可能存在差異(陶醫生觀點:不排除是疫苗的工藝差異,導致了高熱率差異)。解釋2:莫德納和瑞輝的mRNA疫苗,在Ⅰ期(數十人)和Ⅲ期(上萬人)臨牀試驗中觀察到的不良事件報告率也有明顯差異,這提示在不同樣本量的情況下,會出現差異較大的結論。ARCoV的大樣本人羣觀察正在進行中(陶醫生觀點:大樣本的研究結論更加可靠,等ARCoV大樣本研究結果出來,屆時再分析比較更好,還需要關注mRNA疫苗已經確認的罕見心肌炎事件)。研究人員還提示,友商疫苗有第2劑不良事件報告率高於第1劑的現象,但ARCoV第1劑和第2劑的不良事件報告率接近(陶醫生觀點:現在下結論還為時尚早,大樣本研究結果是關鍵)。總體而言,志願者可以耐受ARCoV。ARCoV的常見不良事件與友商疫苗處於同一水平。總結:陶醫生認為,作為中國第一款上人體臨牀的mRNA疫苗,ARCoV的表現中規中矩,安全性可以接受,免疫原性還可以更高些,其優秀的冷鏈適應性,可以為更多發展中國家帶來便利。陶醫生期待其Ⅱ期臨牀試驗數據儘快發佈,Ⅲ期臨牀試驗順利。