mRNA疫苗安全性受質疑?FDA數據真相來了!_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2022-03-14 21:33
謠言止於科學。
自從3月1日mRNA新冠疫苗BNT162b2遞交FDA的評審文件被公開披露後,各種奪人眼球的“標題黨”信息一時之間在國內社交媒體中瘋傳。這些聳人聽聞的消息讓疫情中焦慮的羣眾更加不安,但這份安全性數據究竟是否值得全網“震驚”?還需要我們來從科學的角度將它抽絲剝繭,揭示真相。



實際上這是一份BNT162b2疫苗上市後的不良事件累計分析報告,共38頁,分析了2020年12月1日至2021年2月28日之間報告的42,086例疫苗接種後的不良事件[1]。

這裏我們首先要清楚一個概念,這份報告分析的是不良事件(Adverse event,AE),而不是不良反應(Adverse Reaction,ADR)。根據ICH-E2A中的規定[2]:
不良事件指的是任何發生在患者或藥物臨牀研究受試者的不利的醫學事件。它並不一定同藥物治療有因果關係。
不良事件可以是一種不利的、與用藥目的無關的體徵(也包括異常的實驗室檢查等)、症狀或疾病,與藥物使用有時間相關性,不考慮是否同藥物有因果關係。
已上市藥品的不****良反應指在人體上使用正常劑量來預防、診斷、治療疾病或改善生理功能時出現的有害的、與用藥目的無關的藥物反應。
“藥物反應”一詞指的是藥物與不良事件至少存在合理的可能性,即因果關係無法排除。
也就是説這份累計分析中所羅列的是不良事件,不一定跟接種BNT162b2疫苗有因果關係。例如BNT162b2疫苗在進行5-11歲兒童臨牀試驗期間,一個受試者吞下了一枚硬幣[3],也屬於不良事件,但顯然不是不良反應,也不是所謂的副作用。
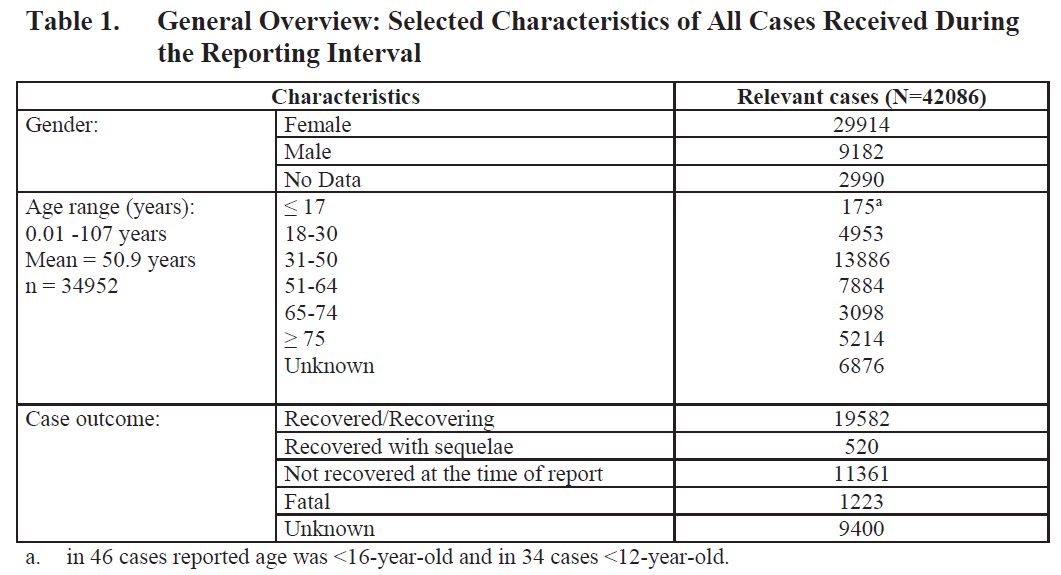
清楚這個概念後再看這份報告,就不需要“震驚”和“炸”了。第一,在報告的42,086例不良事件中有1223例為死亡,顯然那些標題中的“死亡率為2.9%”是毫無邏輯的。計算死亡率應該是死亡人數除以接種疫苗的總人數,何況這裏的死亡並不一定與疫苗接種相關。第二,所謂的“9頁副作用”實際上是在附件中列出的《特別關注的不良事件列表》。每個藥物在應用過程中都會報告很多不良事件,何況是使用數量極其龐大的新冠疫苗,9頁列表是非常正常的。

值得注意的是,報告的結論也支持了該疫苗良好的安全性:數據未顯示任何新的安全性問題或需要改變説明書的風險,並支持BNT162b2疫苗有良好的獲益和風險的平衡。

這份累計分析報告分析了該疫苗接種最初3個月的安全性,在後續的監測中它的安全性又如何呢?
2022年3月7日,美國疾控中心在The Lancet-Infectious diseases發表mRNA疫苗美國在接種6個月內的安全性研究數據[4]。本研究通過VAERS和v-safe兩種監測系統在2020年12月14日至2021年6月14日之間報告的數據,對在此段時間內美國接種的2.98億劑mRNA新冠疫苗(BNT162b2和mRNA-1273)的不良事件進行評估。
向VAERS系統報告率為每百萬劑疫苗中10492.2份非嚴重報告,每百萬劑中90.4份嚴重報告,共報告340522例不良事件,絕大部分為非嚴重不良事件(92.1%),其中最常見為頭痛(20.4%)、疲倦(16.6%)和發熱(16.3%),是由於疫苗接種後誘導機體產生免疫反應而引起的常見症狀。
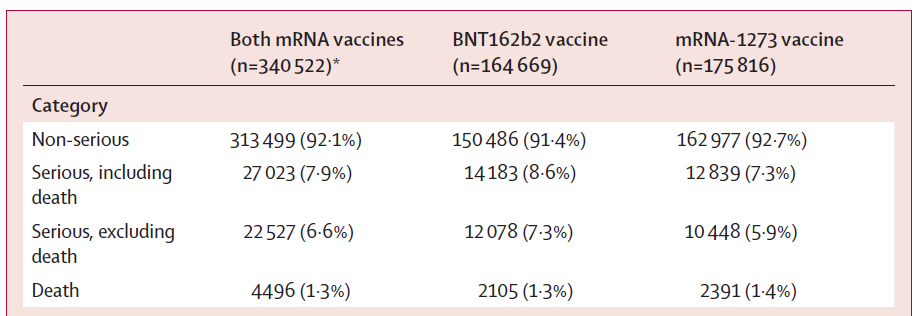
791萬mRNA疫苗接種者在接種後0-7天完成了至少一次v-safe的健康調查。第1劑接種後68.6%接種者報告了局部注射部位反應,52.7%報告了全身反應。在第2劑接種後,71.7%報告了注射部位反應,70.8%報告了全身反應。mRNA疫苗第1劑接種後最常報告的不良事件為注射部位疼痛、疲乏和頭痛,第2劑接種後的發生率高於第1劑。
研究者經過分析得出的結論為:大多數不良事件報告都是輕微且短暫的。美國mRNA疫苗接種前6個月的兩個監測系統的結果與上市前臨牀試驗和早期上市後報告一致。再次印證了mRNA疫苗良好的安全性。
mRNA新冠疫苗作為新一代的疫苗技術,科研人員關於安全性的研究一直從未間斷,已有以色列、美國、英國等多個國家的科研人員在權威雜誌上發表了大樣本的上市後安全性監測研究結果[5-9]。
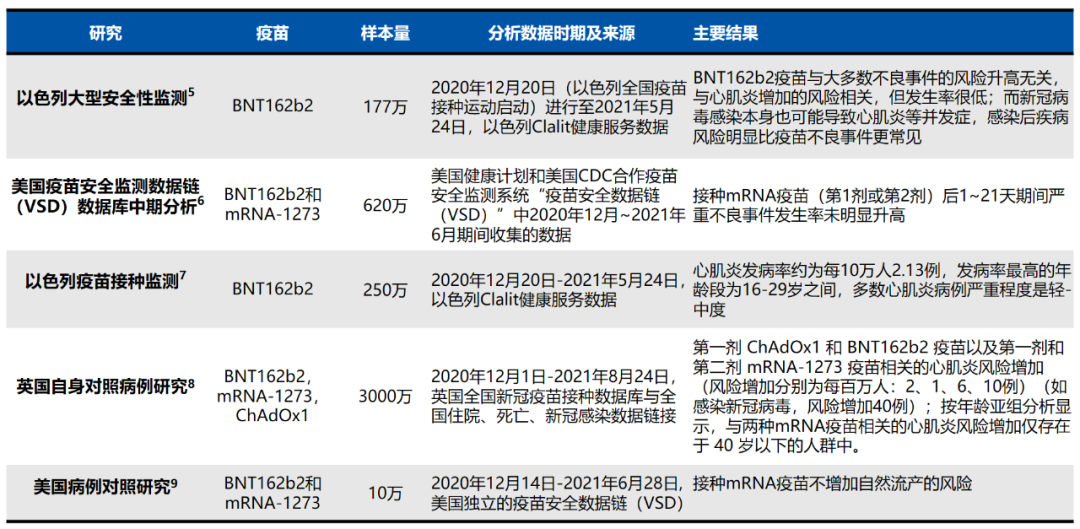
研究結果反應出在廣泛的真實世界應用中BNT162b2安全性良好,不增加大多數不良事件發生風險。對於備受關注的心肌炎風險發生率極低,約為每10萬人2.13例,並且症狀多為輕中度且預後良好。
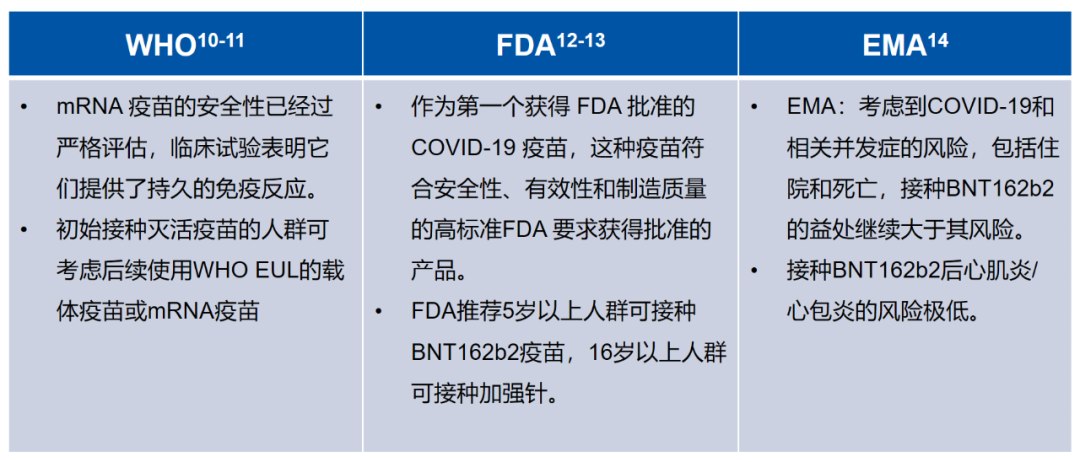
全球多家權威機構推薦接種BNT162b2新冠疫苗預防COVID-19[10-14]。WHO認為mRNA疫苗的安全性已經過嚴格評估,FDA稱BNT162b2疫苗符合FDA對獲得批准的產品安全性、有效性和製造質量的高標準的要求。EMA認為接種BNT162b2的益處大於其風險,建議接種。也正是基於眾多高質量的研究數據證明其具有良好的安全性和有效性,mRNA疫苗目前也被推薦用於加強接種。
總結:
此前廣泛傳播的BNT162b2新冠疫苗所謂“9頁副作用”、“死亡率2.9%”的信息毫無科學依據,是對上市後不良事件累計分析報告數據的錯誤解讀。該份累計分析的結論支持BNT162b2疫苗有良好的獲益和風險的平衡。疫苗上市至今,多國研究人員在持續監測其安全性,目前發表的多篇高質量研究數據證實,在廣泛真實世界的應用中BNT162b2具有良好的安全性,並且多家國際權威機構推薦接種BNT162b2新冠疫苗預防COVID-19。
謠言止於科學。
參考文獻:
[1]PHMPT.BNT162b2 5.3.6 Cumulative Analysis of Post-authorization Adverse Event Reports.2022(https://phmpt.org/wp-content/uploads/2021/11/5.3.6-postmarketing-experience.pdf)
[2]ICH指導辦公室.ICH指導原則.2022(https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/3/1)
[3]CTV News.What is an’adverse event?‘Inside the recently released report on Pfizer’s COVID-19 vaccine.2022(https://www.ctvnews.ca/health/coronavirus/what-is-an-adverse-event-inside-the-recently-released-report-on-pfizer-s-covid-19-vaccine-1.5812411)
[4]Rosenblum HG,Gee J,Liu R,Marquez PL,et al.Safety of mRNA vaccines administered during the initial 6 months of the US COVID-19 vaccination programme:an observational study of reports to the Vaccine Adverse Event Reporting System and v-safe.Lancet Infect Dis.2022 Mar 7:S1473-3099(22)00054-8.doi:10.1016/S1473-3099(22)00054-8.Epub ahead of print.
[5]Barda N,Dagan N,Ben-Shlomo Y,et al.Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting.N Engl J Med.2021 Sep 16;385(12):1078-1090.doi:10.1056/NEJMoa2110475.Epub 2021 Aug 25.
[6]Klein NP,Lewis N,Goddard K,et al.Surveillance for Adverse Events After COVID-19 mRNA Vaccination.JAMA.2021 Oct 12;326(14):1390-1399.doi:10.1001/jama.2021.15072.
[7]Witberg G,Barda N,Hoss S,et al.Myocarditis after Covid-19 Vaccination in a Large Health Care Organization.N Engl J Med.2021 Dec 2;385(23):2132-2139.doi:10.1056/NEJMoa2110737.Epub 2021 Oct 6.
[8]Patone M,Mei XW,Handunnetthi L,et al.Risks of myocarditis,pericarditis,and cardiac arrhythmias associated with COVID-19 vaccination or SARS-CoV-2 infection.Nat Med.2022 Feb;28(2):410-422.doi:10.1038/s41591-021-01630-0.Epub 2021 Dec 14.
[9]Kharbanda EO,Haapala J,DeSilva M,et al.Spontaneous Abortion Following COVID-19 Vaccination During Pregnancy.JAMA.2021 Oct 26;326(16):1629-1631.doi:10.1001/jama.2021.15494.
[10]WHO.Safety of COVID-19 Vaccines.2021(https://www.who.int/news-room/feature-stories/detail/safety-of-covid-19-vaccines)
[11]WHO.Interim recommendations for heterologous COVID-19 vaccine schedules.2021(https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE-recommendation-heterologous-schedules)
[12]FDA.FDA Approves First COVID-19 Vaccine.2021(https://www.fda.gov/news-events/press-announcements/fda-approves-first-covid-19-vaccine)
[13]Vaccines.gov.Pfizer–BioNTech COVID-19 Vaccine Now Available for Children Ages 5–11 Years.2022(https://www.vaccines.gov/)
[14]EMA.COVID-19 vaccine safety update.2021(https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-comirnaty-9-december-2021_en.pdf)
*該信息僅作醫學和科研參考,不構成對任何藥物或治療方案的推薦和推廣。本文章所含信息不應代替醫療衞生專業人士提供的醫療建議。
審核編號:NP-MA-2022-03-13-CN-FBT