人體器官為什麼左右不對稱?細胞手性也許能夠回答_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2022-03-21 09:40
 為什麼我們長得左右差不多對稱,身體裏的器官卻不對稱?
為什麼我們長得左右差不多對稱,身體裏的器官卻不對稱?
撰文 | Catherine Offord
編譯 | 繼省
驀然回“手”——意外進入細胞手性研究領域
時鐘撥回到2009年的一天。科學家萬羣(Leo Wan)正在用顯微鏡觀察他培養的小鼠細胞。看着看着,他發現這些小鼠細胞不太對勁兒,像是長“擰勁兒”了。這批細胞的名字是成肌肉細胞(myoblast),顧名思義可以生成肌肉,是肌肉細胞的前身。他所培養的數百個成肌肉細胞長在了一個微型芯片上。向芯片上接種細胞時,萬羣使用的是一種微觀圖案技術(micropatterning):經由此技術處理的細胞,會附着在培養表面上,並依照研究者事先設計的某種高度規則的模式或圖案生長。(譯註:此技術可用於探究細胞的形態控制和遷移行為等重要生理過程。)
 圖1. 腫瘤細胞在不同寬度的線性區域內生長丨圖源https://www.4dcell.com/cell-culture-systems/micropatterns/
圖1. 腫瘤細胞在不同寬度的線性區域內生長丨圖源https://www.4dcell.com/cell-culture-systems/micropatterns/
萬羣在哥倫比亞開展博士後研究期間,就有一部分精力是放在對這一技術的完善上。他原本以為,這些狹長的細胞會自己順着芯片(譯註:此處所用的芯片為矩形)的長邊排布。但他告訴TheScientist雜誌,當時這些細胞看起來像是被往左拉偏了一點兒。
據萬羣回憶,最初他以為這只是一次偶然現象。然而在那之後,這個現象反覆出現,並且細胞幾乎總是偏向同一個方向(譯註:即總是向左偏)。他和導師生物工程專家Gordana Vunjak-Novakovic討論後,一致決定,調整他的課題方向,專攻他所看到的這一特殊現象。
萬羣把成肌肉細胞接種到了兩種芯片——矩形芯片和環形芯片上,並測量細胞在兩種芯片上時的傾斜扭轉數據。細胞長在環形芯片上時,會沿着圓圈方向持續生長。他猜測他可能捕捉到了細胞的某種內在偏向,即細胞會沿着某個特定方向排列,而不是其他方向。儘管細胞偶爾會向右偏轉(即順時針),或是沒有明顯的偏向,但超過80%的時間細胞都會向左偏(逆時針)。
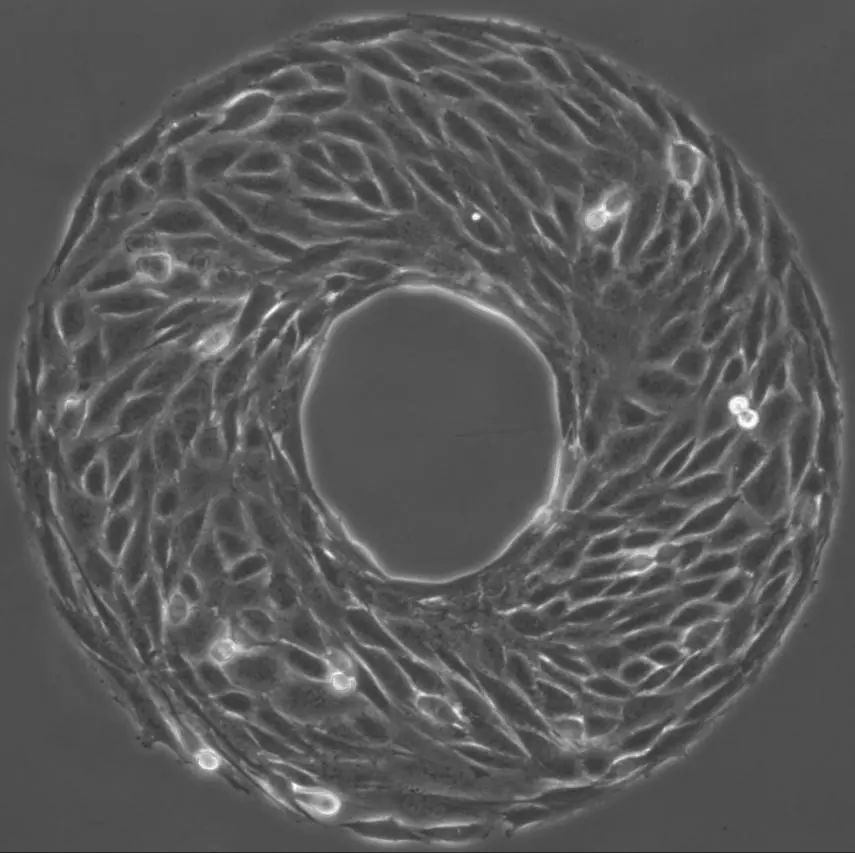 圖2. 細胞“甜甜圈”:小鼠肌肉細胞長出了一個圓環圖案,顯示了逆時針旋轉的手性(萬羣供圖)
圖2. 細胞“甜甜圈”:小鼠肌肉細胞長出了一個圓環圖案,顯示了逆時針旋轉的手性(萬羣供圖)
當他進一步研究發現,這種內在偏向似乎因細胞而異,“有些細胞順時針,而有些是逆時針的”,他對這個猜測更加篤定。比如,人類肌肉細胞與小鼠成肌肉細胞相似,存在逆時針的偏向。他所在的團隊於2011年在《美國國家科學院院刊》(PNAS)[1]上發文報道了這一現象。在這一篇文章中他們還提到,包括皮膚、心臟、骨骼細胞的很多細胞,是傾向於順時針偏轉的;皮膚癌細胞則是個例外,傾向於逆時針偏轉,與尚未癌變的正常皮膚細胞正好相反。萬羣現在在紐約的倫斯勒理工學院開展研究工作。對當時的他來説,這一發現將他引入了動物生物學的一個冷僻方向——細胞手性(cell chirality)。這是一個鮮少為人理解的現象。過去幾十年間,在各種細胞上記錄這一現象的研究者屈指可數。
手性——現象常見但原因未明
從廣義上講,手性是在空間不對稱物體的一種特性——當物體無論如何旋轉,都無法和它的鏡像完全疊加重合時,我們就稱這一物體具有手性。據此觀點,不對稱的物體就可以分為右手的或左手的,分別對應着順時針旋轉或逆時針旋轉。儘管有時候手性很難清晰描述出來,但這個特徵在生物學中極為常見——小到一個分子,大到整個生物體都可能存在手性。例如,DNA等生物聚合物形成的螺旋天然就具有手性結構(譯註:DNA螺旋主要是右手螺旋);氨基酸在組成複雜的三維結構時也可能有左右手之別。研究者現在知道,分子的手性對其功能有至關重要的決定性作用。而且,生物體在選擇手性形式時還很挑剔:儘管很多分子的左右手性形式可以同時存在,但幾乎所有生物在其合成和代謝過程中,都毫無例外地選擇左手性的氨基酸和右手性的糖類。
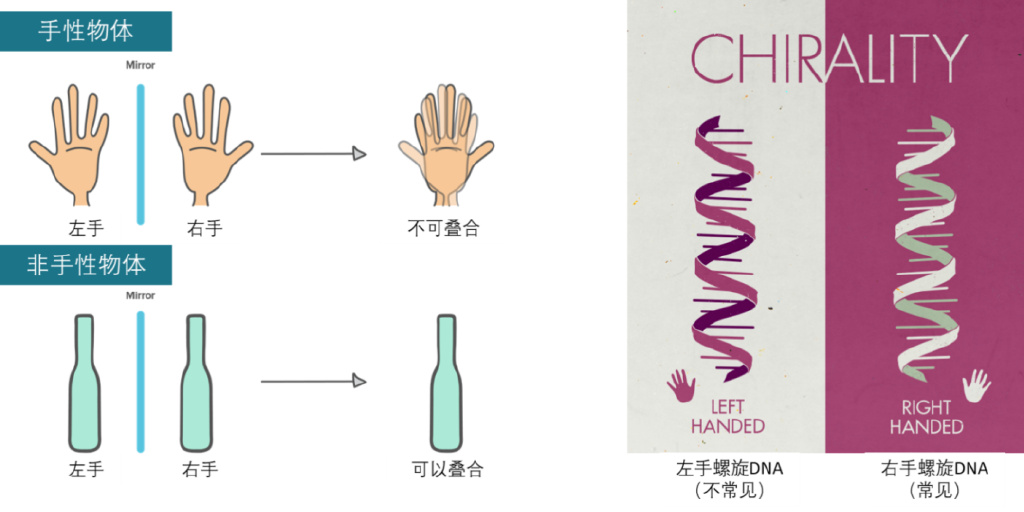 圖3. 左:手性和非手性物體示意圖(修改自可汗學院網絡課程插圖)右:DNA雙螺旋手性示意圖。
圖3. 左:手性和非手性物體示意圖(修改自可汗學院網絡課程插圖)右:DNA雙螺旋手性示意圖。
手性在宏觀尺度上也很常見。在動物的身體平面上,即使外表看起來對稱的生物也存在手性。拿人類來説,從頭到腳,從後往前,這兩個體軸方向上很明顯是不對稱的;而在第三體軸即從左到右的體軸上,人類的身體也同樣不對稱。正常人體發育中,主要臟器多數最後會定位在身體中軸線的某一側——比如肝臟在右側,胃部總在左側,心臟略微偏左。手性也可見於器官本身:例如心臟從結構上就是左右不對稱的,在另兩個體軸上也同樣不對稱。這些不對稱模式在人體發育過程中一旦發生錯誤,便會導致左右對稱異常。
例如,有一些人的臟器左右位置和正常人完全相反,正常在右側的器官會出現在左側,反之亦然。當全部器官都處在正常位置的相反一側,我們把這一現象稱為全內臟反位(situs inversus totalis)(圖4)。這種情況在人羣中出現的概率大約為萬分之一。由於器官之間的相對位置關係沒有改變,這一情況並不一定對身體有害。然而,如果只是個別器官異位,例如左位心(levocardia,除了心臟其他器官均對側異位)、右位心(dextrocardia,只有心臟出現在對側),或是內臟異位(situs ambiguus,有異位和沒有異位的器官混在一起),病人往往會出現心臟病等醫學症狀,原因便是異位器官無法與其他器官正確協作。
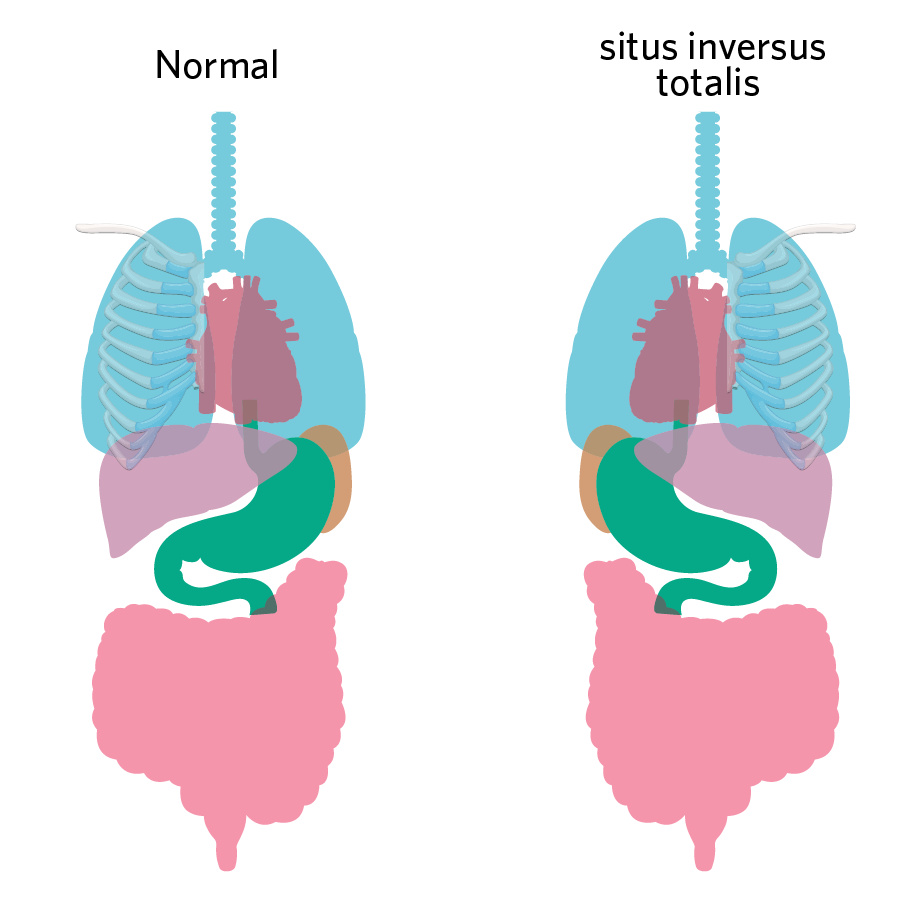 圖4. 正常器官(左)與全內臟反位(右)丨修改自圖源:https://www.istockphoto.com/vector/human-internal-organs-system-people-body-internal-organs-illustration-anatomy-organ-gm1329503303-413211534
圖4. 正常器官(左)與全內臟反位(右)丨修改自圖源:https://www.istockphoto.com/vector/human-internal-organs-system-people-body-internal-organs-illustration-anatomy-organ-gm1329503303-413211534
動物界也有類似的不對稱異常的發育情況。例如,過去幾年間,諾丁漢大學的研究者對大池塘蝸牛(Lymnaea stagnalis)的殼螺旋方向進行跟蹤記錄,他們發現,儘管大多數時候這種蝸牛的螺殼都是右手螺旋,但也能發現個別的左手螺旋。他們正在研究這一現象背後的遺傳基礎[2]。
塔夫茨大學的Michael Levin是萬羣2011年論文的編輯。Levin提到,身體層面的不對稱性如何形成,是動物發育領域由來已久的謎題,其中又以左右體軸最難以理解和研究。上下和前後兩軸都有明確的現實意義,比如要跟隨重力,或者要為動物或有極性的細胞指示運動遷移的方向;但左右軸相比之下並沒有明顯的意義。Levin説,“如果你試圖向一個外星人解釋,你説,‘好,我的左手……’;那麼問題來了, ‘左’究竟是什麼意思?這個問題委實難以回答。”
單個細胞同樣具有手性:除了表現為上下和前後的不對稱性之外,細胞在左右軸方向上也是不對稱的。對於萬羣等人來説,單個細胞層面上的手性,是解開動物身體不對稱性謎題的重要一環。如今,單細胞手性這個現象已經廣為闡釋。例如,我們熟知的一種纖毛蟲——草履蟲——在遊動時就傾向於向左螺旋;類中性粒細胞——一種用來研究免疫細胞遷移的細胞系,與中性粒細胞類似——也呈現出了運動中向左的偏向。萬羣認為,“在具有手性偏向的細胞中,存在某種共性”。他和Levin等同行認為,這一現象揭示了分子不對稱性與器官或組織不對稱性之間存在某種機制上的聯繫,而這一聯繫可能之前被忽略了。
“對我來説,從對大型生物體的單側化行為探索,比如人慣用右手,很自然地就過渡到了對單個細胞的單側化行為的探索”。從20世紀90年代起,Levin就一直在醖釀關於細胞手性和身體不對稱性的假説。他的想法經常會與發育生物學領域裏已有的一些“科學共識”相矛盾。但他認為,細胞手性和身體不對稱性,只是同一件事情發生在不同的尺度而已。
爭鳴——多家課題組探索細胞手性建立機制
在萬羣開始研究左偏細胞(譯註:即前文所提的向左偏向生長的成肌肉細胞)沒多久,在世界的另一邊,新加坡國立大學力學生物學研究所Alexander Bershadsky實驗室裏,博士後Yee Han Tee開始應用另外一種微觀圖案技術,來研究細胞形成內部結構的方式。她所研究的內部結構叫微絲蛋白骨架,是細胞生長、運動和細胞內運輸的重要媒介。Tee將單個的成纖維細胞鋪在有粘性的微型“小島”材料上,這樣可以“強行”讓本來伸長生長的細胞長成圓形。在接下來的幾個小時裏,她用顯微鏡記錄下了每個細胞內部細胞骨架形成的過程。Alexander Bershadsky回憶道,“有一天,Tee找到我,告訴我説這些細胞表現得非常有趣,具體説就是,它們的內部在旋轉”。
他們利用熒光標記技術跟蹤單個微絲纖維的運動,發現有兩組纖維似乎在細胞內建立一種逆時針渦旋的運動方式[3]。第一類是所謂的輻射纖維(radial fiber),從細胞邊緣向內生長到細胞中心,形成了類似自行車輪上輻條的圖案。另一類是橫貫纖維(traverse fiber),它們在多個點上鍊接到輻射纖維,並隨着後者向細胞中心移動,逐漸形成了同心圓結構。這些纖維最開始以輻射對稱的模式規則排列,但在鋪下細胞三個小時剛過不久,“輻條”便開始傾斜,導致整個結構開始圍繞細胞中心渦旋運動。最後,在11小時附近,纖維停止渦旋並伸展開來,或多或少看上去和細胞的直徑方向是平行的。
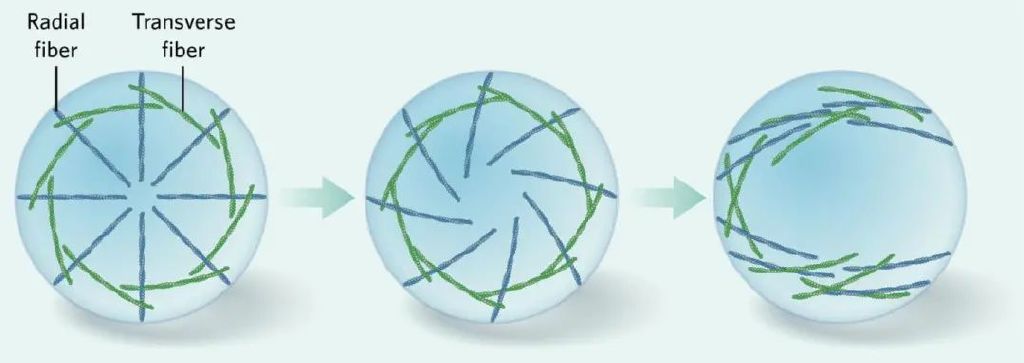 圖5. 細胞骨架形成過程中的旋轉現象。手性在細胞內得以建立,可能的方式之一便是構成細胞骨架的這些微絲纖維有自發的組織排列。在細胞骨架建立的最初幾個小時裏,這兩類纖維組成輻射對稱的模式(圖5左),但從三個小時之後,輻射纖維開始傾斜,拉拽得橫貫纖維偏離軌跡,引發渦旋模式(圖5中),11小時左右,渦旋模式打破為線性模式,纖維沿着細胞主軸排布(圖5右)。
圖5. 細胞骨架形成過程中的旋轉現象。手性在細胞內得以建立,可能的方式之一便是構成細胞骨架的這些微絲纖維有自發的組織排列。在細胞骨架建立的最初幾個小時裏,這兩類纖維組成輻射對稱的模式(圖5左),但從三個小時之後,輻射纖維開始傾斜,拉拽得橫貫纖維偏離軌跡,引發渦旋模式(圖5中),11小時左右,渦旋模式打破為線性模式,纖維沿着細胞主軸排布(圖5右)。
ILLUSTRATION BY © SCOTT LEIGHTON; DATA FROM NAT CELL BIOL, 17:445–57, 2015.
雖然細胞骨架帶有手性算不上新發現,但Bershadsky和Tee等人在2015年發表的這篇研究論文[3]裏以實驗手段提供了細胞內分子自發形成手性的早期可視化證據,還使用電腦模擬重現了細胞骨架的渦旋模式。為了深入挖掘箇中機制,他們還用小分子藥物抑制微絲相關蛋白,發現藥物處理會導致細胞骨架失去原有的手性偏向,甚至開始向反方向渦旋。其他研究組也在探究這一機制。數年前,來自日本的研究斑馬魚黑色素細胞的科學家們,報道了用微絲組裝的抑制劑可以阻斷細胞在培養條件下逆時針旋轉的趨勢[4]。
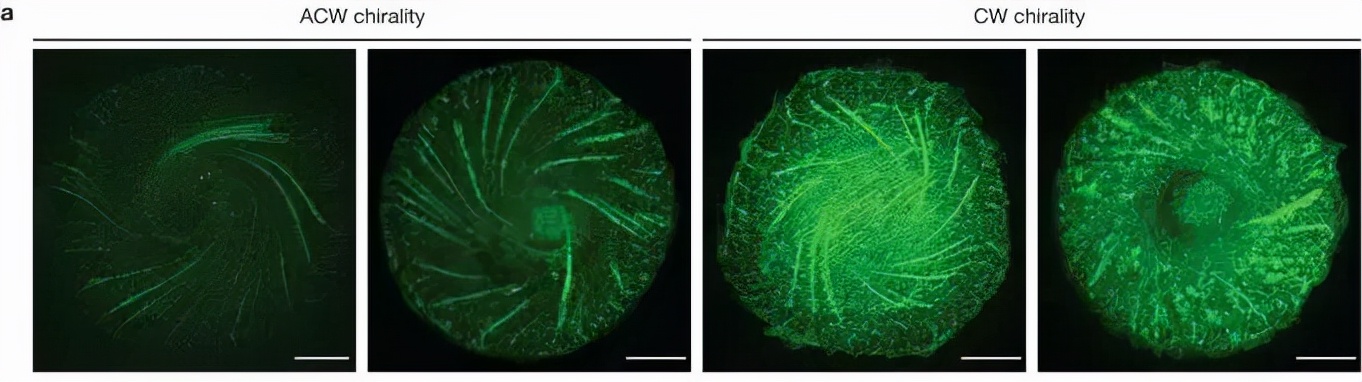 圖6 細胞骨架渦旋的兩種狀態——逆時針(左圖)和順時針(右圖)。來自參考文獻[3]
圖6 細胞骨架渦旋的兩種狀態——逆時針(左圖)和順時針(右圖)。來自參考文獻[3]
微絲本身就是具有手性的分子,它們會形成右手螺旋。Bershadsky和Levin等人因此懷疑,微絲的分子結構在細胞不對稱性的建立上有核心地位。Bershadsky説,“我們的觀點是,微絲纖維和它的螺旋不對稱性就是形成手性的因素。”他同時補充道,目前這個機制如何發揮作用仍然不清楚,有可能微絲的分子結構影響了微絲纖維對機械力的響應,以及與其他細胞內蛋白的相互作用。
實際上,微絲並不是細胞骨架的唯一成分,細胞骨架的組成部分還有微管(譯註:此外還有中間纖維)。有一些實驗室也在研究微管的作用。微管相比微絲更硬更厚,在囊泡運輸等特定細胞內過程中發揮着更大作用。在早期一項關於細胞手性的研究中,研究者使用干擾微管組裝的藥物處理類中性粒細胞,隨即發現:儘管這些細胞依然可以遷移,但不再呈現向左偏的運動模式[5]。幾年之後,Levin和同事們發現了類似現象:當敲除掉類中性粒細胞裏的微管蛋白(即組成微管的蛋白),細胞的不對稱性徹底消失了。
然而,關於微絲和微管在建立細胞手性上的重要性,也有研究者持不同意見。Bershadsky提到,他們在實驗中的確觀察到微管沿着微絲纖維渦旋,但是破壞微管功能並不能阻斷渦旋過程,也不影響渦旋方向。研究黑色素細胞的日本研究組也提到,微管抑制劑反而會讓細胞旋轉加劇。Levin的課題組除了微管之外也研究微絲相關蛋白,他則認為,微絲和微管可能都參與了細胞手性的建立,“兩者都有確鑿證據,沒有必要非得二選一”。
為了更好地瞭解不同因子在生物體宏觀尺度上如何驅動手性,研究人員嘗試了更能模擬自然條件的實驗設置來觀察細胞手性。例如,萬羣等人開發了一項三維的微型圖案技術(萬羣也是細胞手性研究領域中與微型圖案技術相關的專利的發明人之一),可以更好地復刻胚胎髮育環境,進而檢測上皮細胞所形成的微球體的旋轉行為[6]。研究團隊發現,絕大部分微球體按逆時針方向旋轉,但當有藥物阻斷微絲組裝時,大部分微球體開始順時針旋轉,就像按下了某個轉換開關一樣。
萬羣的團隊還開發出從視覺特徵上鑑定細胞手性的方法,比如分析細胞內細胞器的分佈——他們想以此為動物體內觀察實驗鋪平道路。在近期的一篇論文[7]中,他們推出了一項基於細胞核和中心體相對位置的新手段:由於在移動的細胞中,細胞核傾向留在移動方向的後端,而中心體(譯註:中心體是細胞分裂時內部活動的中心,位於細胞核外的細胞質中)常常靠近前端,他們就在細胞核和中心體之間畫一條虛擬線,然後記錄細胞的重心相對這條虛線的位置。利用這一新觀測手段,他們觀測到內皮細胞的重心傾向於出現在前後軸線的右側,而此前已知內皮細胞有向右偏轉(順時針偏轉)的傾向,説明觀測結果與已知手性吻合。這提示,他們開發的策略可以粗略地測定細胞手性。
萬羣等人還研究了多個手性細胞聚集後的行為。例如在胚胎中,一些遷移型細胞會聚成一羣或同時渦旋以形成特定的器官。這類研究可以幫助科學家確定細胞手性在動物發育中的重要性,解決相關的爭議。
由小見大——手性在動物身體不對稱性中的作用
到了21世紀早期,脊椎動物胚胎髮育中左右不對稱性謎題的重要一環被解開:在頭尾軸和背腹軸(譯註:即前文提到的上下和前後體軸)建立之後,沿着胚胎的腹部一側,一些細胞在其邊緣集結了名為纖毛(cilia)的細小絨毛結構,這些絨毛通過擺動製造了向左的液體流動。這種液體流動引發了細胞在左右軸相對位置上的不對稱性基因表達,並最終將身體分為左右兩側。基因敲除(譯註:即通過基因工程手段把基因移除)實驗表明,當敲除纖毛組裝所必需的蛋白(例如驅動蛋白kinesin,這類蛋白沿着微管運輸纖毛組裝所需要的原料)後,小鼠胚胎中的液體流動會被幹擾甚至反轉,導致動物體內器官的錯位(定位缺陷)。對具有器官對稱定位缺陷的小鼠進行基因篩查的結果顯示,有數十個纖毛相關基因發生了突變,並且這些突變與小鼠的發育缺陷顯著關聯[8]。看起來,纖毛便是打破神秘第三體軸對稱性的關鍵。
這一觀點出現至今,仍主導了研究者對動物發育的認知。但是,Levin指出,多數研究都忽略了一個關鍵事實,即敲除纖毛相關蛋白後,細胞骨架和多種胞內進程也一樣會受影響(譯註:換言之,敲除纖毛相關蛋白後所觀察到的器官對稱定位缺陷,不能簡單地歸因為依賴於纖毛的胚胎液體流動,細胞骨架組裝等過程同樣有可能參與)。此外,左右不對稱在雞、豬和蛔蟲等動物中一樣存在,而這些動物的胚胎中並沒有帶纖毛的細胞來引導液體流動[9, 10]。即便在青蛙這種有纖毛的動物中,早在纖毛完成組裝和開始擺動之前,就已經能檢測到RNA等重要的發育相關分子的不對稱分佈。敲除微管蛋白會干擾偏側性發育(譯註:即發育過程中的兩側不對稱)的現象不僅存在於動物,在植物中一樣如此。這反而提示,在建立不對稱性時可能存在某種通用的機制,它依賴於微管蛋白,但不是纖毛。
“説纖毛引發了不對稱性是完全不合理的……最公平的説法是你可以認為纖毛參與了這一通路的某個中間環節”。Levin認為,也許纖毛放大了由細胞內機制建成的左右不對稱性的差異。
儘管一系列證據提示,存在某種不依賴於纖毛的機制來建立組織和身體層面上的不對稱性,但箇中作用細節遠未明晰。研究細胞手性需要解決以下兩個問題:
第一,細胞如何提供組織水平上的方向信息?即怎樣算左,又怎樣算向右?
第二,相比第一點也更有挑戰,細胞如何編碼具體位置信息?即細胞如何知道胚胎中線在何處,又怎麼知道自己在哪一側?
科學家們現已分頭投入了對這兩個問題的解析中。
關於第一個問題,很多研究組已經在體外實驗中證實,當細胞彼此排列對齊時,細胞手性在羣體層面上控制細胞的偏轉方向。與萬羣所用的左偏型小鼠細胞類似,Tee用的成纖維細胞在排列和遷移時亦展示出羣體行為模式,而這種模式可以被微絲破壞型藥物清除或反轉,相關結果已經發在2021年4月的預印本平台BioRxiv上[11]。另有研究者報道,細胞的這類羣體行為可以在整個組織和器官的層面上產生影響。Kenji Matsuno是日本Osaka大學的果蠅研究者,他一直在研究果蠅胚胎後腸(譯註:一般稱胚胎消化系統的末端為後腸)的不對稱性。果蠅的後腸在胚胎髮育中會有90度的左轉,而組成後腸管道的上皮細胞本身就有不對稱的形狀[12]。Matsuno和他的團隊發現,干擾微絲相關蛋白後,既可以翻轉上皮細胞的手性(譯註:即左旋變右旋),也可以調轉後腸的旋轉方向(圖6)[13]。Matsuno團隊在近期的一篇論文[14]中提出,細胞層面上的手性是驅動後腸旋轉現象的充分必要條件。
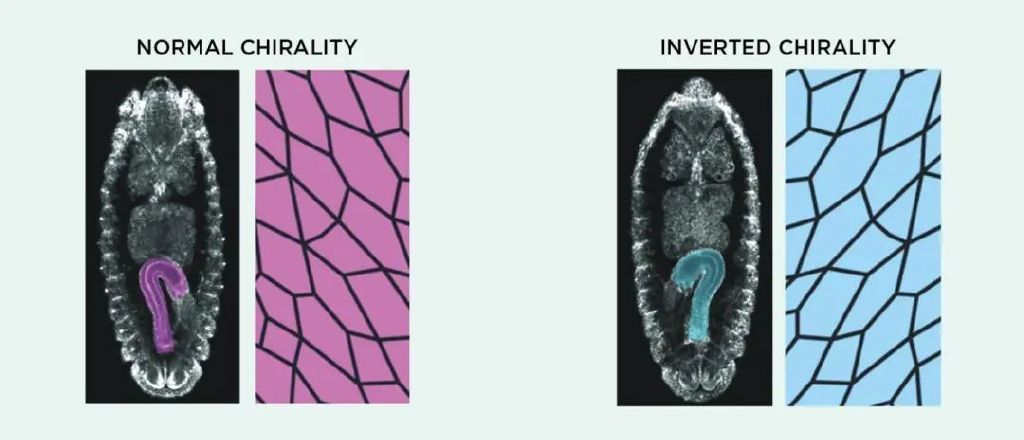 圖7. 果蠅腸胃反轉:正常果蠅發育過程中,後腸會經歷逆時針旋轉,最後向右彎曲(左)。研究者敲除掉參與細胞骨架功能的蛋白後,扭轉了後腸的旋轉方向,得到了指向左側的後腸(右)。丨來源:M. INAKI ET AL., FRONT CELL DEV BIOL, 6:34, 2018.
圖7. 果蠅腸胃反轉:正常果蠅發育過程中,後腸會經歷逆時針旋轉,最後向右彎曲(左)。研究者敲除掉參與細胞骨架功能的蛋白後,扭轉了後腸的旋轉方向,得到了指向左側的後腸(右)。丨來源:M. INAKI ET AL., FRONT CELL DEV BIOL, 6:34, 2018.
萬羣也在研究鳥類的心臟發育。心臟屬於胚胎髮育中首批打破體軸對稱性的器官——這一過程起於一羣特殊的細胞,它們通常會形成向右偏轉的環路。萬羣團隊報道[15]説,從雞胚胎心臟分離出的細胞表現出內在的右手偏向,在培養條件下,可以通過藥物處理來翻轉手性偏向。可用的藥物一般是一些已知的破壞微絲細胞骨架手性和胞內結構的藥物。用這些藥物處理雞胚胎後,導致大量胚胎髮育出向左轉的心臟。萬羣説,“這給我們提供了某種證據,説明細胞手性很可能起到了某種作用”。他補充説,他的團隊還曾偶遇一枚天然發育出向左旋轉的心臟的雞胚。在這一枚特殊雞胚中,心臟細胞是逆時針的,就像被小分子藥物處理過一樣。他和同行們將這一工作拓展開,研究手性對人類健康和疾病的潛在意義,包括心臟發育、內皮細胞屏障的通透性[16],以及癌症細胞與正常細胞的競爭[17]等。
然而,儘管上述機制為不對稱器官的發育提供了部分解釋,在動物身體平面的更高水平上,這些機制如何起效仍不明確。研究者普遍認為,在發育的某個中間時間點(具體節點可能因物種而異),在胚胎的中線形成了某種分子屏障,這一屏障阻隔了身體兩側生長因子的自由擴散,加劇了基因表達產物的不對稱性積累。但是Levin也指出,對側模式異常個體的存在,比如一半雄性一半雌性的雌雄嵌體(如下圖的雌雄嵌體蝴蝶),暗示着在胚胎髮育的更早期就已經形成了基本的左右分離模式。
 圖8. 雌雄嵌體動物。儘管大部分雌雄嵌合體出現在昆蟲和蛛形綱動物中,但在一些相對高等的動物,包括甲殼類、北美紅雀、雞等之中也會出現。丨圖片來自新浪圖片站http://slide.tech.sina.com.cn/d/slide_5_453_35289.html#p=1
圖8. 雌雄嵌體動物。儘管大部分雌雄嵌合體出現在昆蟲和蛛形綱動物中,但在一些相對高等的動物,包括甲殼類、北美紅雀、雞等之中也會出現。丨圖片來自新浪圖片站http://slide.tech.sina.com.cn/d/slide_5_453_35289.html#p=1
“這些遺傳紊亂如果發生在胚胎髮育晚期,絕不會像現在這樣,雌雄特徵分居左右、涇渭分明。”Levin發表了用以描述細胞手性的模型[18],並特別指出,特定胞內蛋白沿着細胞骨架上的偏向運輸,可以通過在胚胎中建立電壓或pH值梯度,來幫助胚胎形成左右不對稱”。當然,他現在也認為,真正的機制仍然不明,“完全是個迷”。
道阻且長——細胞手性待解之謎
不論細胞手性在動物發育中起何作用,接受採訪的科學家都承認,仍有一些關鍵的基礎問題需要解答。首先,我們仍不清楚,為何有些細胞表現出順時針偏向,而另一些細胞卻是逆時針的?換句話説,這種差異是如何形成的?萬羣提到,他的同事曾指出肌肉細胞比其他細胞含有更多的微絲蛋白,這可能可以解釋為何哺乳動物肌肉細胞向左偏,而其他細胞向右偏或根本沒有多少偏向。另外,內皮細胞和上皮細胞通常有相反的手性,這一現象他很有興趣作進一步研究。
由於細胞和細胞羣體在傾斜的方向上不是百分百一致,一些研究者認為這是細胞手性領域的侷限之處,這意味着相關研究要依賴於統計手段來鑑定手性偏向。畢竟在萬羣2011年的論文中,僅有80%的肌肉細胞表現了逆時針旋轉偏向,這個比例遠少於人體內氨基酸左旋的比例,或是脊椎動物胚胎心臟形成右手偏轉的比例,後兩者都接近100%。對單個細胞的研究中也有同樣的侷限:大多數細胞表現了某一方向上的手性,但總有一些細胞向反方向傾斜。
復旦大學的分子工程師丁建東和同事們最近在多篇論文中呼籲,細胞手性研究的一致性較低屢見不鮮,大家應該謹慎分析結果[19, 20]。但這種不一致究竟是來源於實驗的人為誤差等因素,還是反映了細胞的真實差異,現在仍不好定論。
萬羣認為,細胞手性非常重要,使用細胞骨架干擾型藥物改變細胞和整個器官的手性的研究就有很好的重複性。即便有部分細胞的手性不統一,但細胞羣體可能依然足以驅動組織水平上的行為,尤其是細胞手性有可能只是發育過程中參與建立和放大不對稱性的眾多機制中的一員。
Matsuno補充説,一些研究者漸漸開始改變舊有的、二元的手性觀念,轉而認為這是一個在左右兩個方向上存在強弱不同程度偏好的多元組合。“細胞手性可能不是一個0或1的開關。我現在相信這是個非常複雜的現象。”
Bershadsky認為,細胞手性領域未來發展的研究議題中,必定會包含對這些謎題的解答。他正在和萬羣合作組織2022年7月份世界生物力學大會上關於細胞手性和打破對稱性主題的討論單元[21]。“這一領域仍然是個新鮮話題,這也是我們喜歡它的原因”, Bershadsky説,“事實上絕大多數動物是兩側對稱的,這也是我們不太容易理解的”,“對稱性上的偏差,某種意義上是大自然更改了對稱性的編碼公式,錯亂的編碼造就了不對稱之美。(我們所見的)不對稱不是隨機發生的,能夠很好地遺傳給後代,並精密地調控”。
參考文獻
[1] https://www.pnas.org/doi/10.1073/pnas.1103834108
[2] https://www.cell.com/current-biology/fulltext/S0960-9822(16)00056-7
[3] https://www.nature.com/articles/ncb3137
[4] https://onlinelibrary.wiley.com/doi/10.1111/gtc.12194
[5] https://www.pnas.org/doi/10.1073/pnas.0703153104
[6] https://www.pnas.org/doi/10.1073/pnas.1805932115
[7] https://www.tandfonline.com/doi/full/10.1080/19420889.2019.1605277
[8] https://www.nature.com/articles/nature14269
[9] https://www.sciencedirect.com/science/article/pii/S0012160613001693?via=ihub
[10] https://elifesciences.org/articles/04165
[11] https://www.biorxiv.org/content/10.1101/2021.04.22.440942v1
[12] https://www.science.org/doi/10.1126/science.1200940
[13] https://www.sciencedirect.com/science/article/pii/S0925477314000240
[14] https://www.mdpi.com/2073-8994/12/12/1991/htm
[15] https://www.pnas.org/doi/10.1073/pnas.1808052115
[16] https://www.science.org/doi/10.1126/sciadv.aat2111
[17] https://journals.plos.org/ploscompbiol/article?id=10.1371/journal.pcbi.1006645
[18] https://journals.sagepub.com/doi/full/10.1177/154411130401500403
[19] https://onlinelibrary.wiley.com/doi/10.1002/cjoc.201800124
[20] https://www.sciencedirect.com/science/article/pii/S1742706121001276
[21] https://www.wcb2022.com/programTracks.asp
本文經授權編譯自TheScientist 2月刊封面特別文章https://www.the-scientist.com/features/cell-chirality-offers-clues-to-the-mystery-of-body-asymmetry-69584
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。