癌症為什麼會復發、會轉移?謎底揭示攻克惡性腫瘤新策略_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2022-05-12 15:50
癌細胞與免疫系統之間的廝殺,還有太多謎團。每一次探尋,都帶來新的希望。
撰文 | Samuel F. Bakhoum(紀念斯隆凱特琳癌症中心)
編譯 | Kestrel
事情過去已有七年了,可當時失落的感受至今依然清晰。
那是2015年的一天,我拿到一位病人的腫瘤組織DNA測序結果,她的肺癌已經轉移到了腦部,但是在報告裏我找不到半點可以指明治療靶標的基因改變,同時,另一件事引起了我的注意:數據顯示,幾乎每條染色體在結構上、數目上都發生了很多變化。
正常細胞中,每條染色體有兩份拷貝,但癌細胞裏面的染色體則不然,拷貝數目多少不定,少的只有一份,多的可以有五六份拷貝,有時候還會出現染色體碎片。這種基因組混亂的現象稱為“染色體不穩定性”(chromosome instability),簡稱CIN。雖然癌症研究者和臨牀醫生早就知道CIN是癌症進展到晚期或有轉移的標誌,但我從來沒見過像這位病人這樣,才59歲情況就這麼嚴重的,更何況她才確診不久,而一般認為CIN是在比較長的時間跨度上逐漸發生的。
腫瘤科醫生對此束手無策,因為針對CIN沒有太好的靶向療法,病人只能簡單地接受多輪全身化療和放療。我的病人也一樣,除了一般性的副作用,她還得承受腦部放療帶來的神經毒性,可能會造成失憶和其它認知缺陷。
如此困境令我聯想起自己的細胞生物學背景。過去,我讀博期間的科研工作就是去搞清楚正常細胞有絲分裂過程中染色體是如何平均分配的。這個過程錯綜複雜,但每天都在許多組織中上演。生命體演化出多重備份機制,來確保這個過程不會出錯。若萬一出錯,染色體數目異常的細胞也會被迅速清除。但癌細胞就不一樣,它們對染色體異常的耐受性很強,且如此大尺度的基因變化與病程進展密切關聯。然而,我們並不清楚,在腫瘤的發展和轉移過程中,CIN是否扮演着積極的角色,又是怎樣起作用的。
直到幾年前,我開始着手研究CIN到底是會推動癌症發展,還是隻是一種伴隨癌症發生的現象。為此我與Lewis Cantley展開了合作,他當時是威爾·康奈爾醫學院(Weill Cornell Medicine)邁耶癌症中心(Meyer Cancer Center)的主任,現供職于丹娜-法伯癌症研究所(Dana Farber Cancer Institute)。我們對多種染色體不穩定且具有轉移性的癌細胞進行了遺傳操控,降低它們的CIN水平,又不影響它們所攜帶的其它遺傳學異常。結果非常明顯,失去CIN的癌細胞同時也失去了轉移的能力。還有一件事令我們驚訝,就是我們發現CIN是通過造成慢性炎症來促進癌細胞轉移的。所以,歸根結底,讓癌細胞得以脱離原發性腫瘤而去入侵其它器官的,正是機體自身的免疫反應。
2018年,我們的工作發表在《自然》(Nature)雜誌上。研究結果提示我們,讓遺傳物質變得不穩定這一步本身,對癌症的演進(evolve)至關重要。這可以成為新的治療思路的出發點:我們能否在這一步中尋找靶點,來治療CIN情況嚴重的癌症呢?能否想辦法穩定基因組,或者減輕CIN造成的慢性炎症,來遏止癌症轉移呢?能否改造免疫系統,讓它去清除染色體數目異常的細胞呢?

也是在2018年,我和Cantley以及另一位同事Olivier Elemento聯合創立了Volastra Therapeutics公司,以期相互補足我們在CIN方面的學術工作。公司的科研人員正在為多種癌症開發靶向CIN的療法。通過這樣廣泛的合作,我們希望為染色體不穩定性癌症患者探索和開發新的治療方法。
被忽視的癌症標誌
自從2006年科學家測得首個癌細胞基因組以來,我們一直在不斷深入瞭解是哪些遺傳物質的改變在促使癌症發生、發展。科學家們開發出了一個個靶向療法,作用於那些促進腫瘤發展的基因。這些療法的理念都基於這樣一個假設:如果我們能抑制這些基因,腫瘤就會停止惡化。因此,我們要對腫瘤組織進行基因組測序,找出每個病患身上的促癌基因,這一步已經成為MSK許多腫瘤科醫生的常規做法。但是,當測序未能幫我們找到靶點時,腫瘤個體化治療的侷限性就顯現出來了:的確有一些成功的病例,但是對大多數癌症晚期病人來説,效果還是十分有限。
即使靶向療法可以派上用場,可能也只有一開始有效,因為腫瘤會“進化”。它們經常能逃逸我們的用藥。而癌細胞最強大的武器之一,就是CIN。它們每一次分裂——託CIN的福——染色體都會發生隨機重排。於是,染色體分離過程中發生的錯誤積累起來,導致癌變的組織裏面各細胞在染色體組成和拷貝數上高度異質。這種現象稱為“非整倍性”(aneuploidy)。的確,多輪治療之後還是復發的晚期腫瘤,其特徵就是染色體高度不穩定及非整倍性,對這樣的腫瘤,抑制單個突變基因的藥物已經起不了效果,儘管這些藥物曾使癌症好轉。
早在數十年前,研究者就已知道非整倍性是人類癌症的一個特徵,但直到1997年,約翰·霍普金斯大學醫學院(Johns Hopkins University School of Medicine)的Christoph Lengauer和Bert Volgelstein才首次證明CIN在促進癌細胞異質性方面的作用。通過他們的工作,人們很快就理解到CIN有刺激腫瘤演進、惡化的潛力:CIN能夠調節染色體拷貝數,因而也調節這些染色體上基因的拷貝數。近期,哈佛大學醫學院的Stephen Elledge發現,人類的惡性腫瘤的確會儘可能地增加帶有致癌基因的染色體拷貝數,並減少帶有抑癌基因的染色體的拷貝數,從而提高自身的適應性。
儘管CIN對人類癌症來説很重要,但實驗室還是聚焦在基因突變上。新一代測序技術所帶來的方法學革命引導學界把目光都放在了單個基因對癌症發生的貢獻上,並由此得到了許多重要的發現,擴展了我們的認識,使我們瞭解了許多基因在腫瘤發生過程中所起的作用。但是,這種方法也有弊端,它忽視了大尺度染色體畸變及其對基因功能和癌細胞行為的影響。從整塊腫瘤組織樣本中純化出DNA,對其進行測序,固然能夠讓我們更清楚地看到染色體上的遺傳信息,但無法將序列發生改變的DNA片段定位到染色體上,而且模糊了細胞間染色體拷貝數的異質性。
在過去的十年間,研究者開始將更多注意力放到大尺度的染色體改變上。2010年,MSK的Robert Benezra等人發表了一項重要研究,表明已經獲得CIN的腫瘤不再依賴一開始引發癌症的致癌基因。具體來説,當研究者上調致癌基因KRAS誘導小鼠形成肺癌後,再取消上調,能觀察到腫瘤消褪;但如果採用基因工程手段,進一步往癌變的細胞中人工引入CIN,腫瘤消褪現象就觀察不到了。所謂靶向治療,就是去特異性地抑制像KRAS這樣的致癌基因,不讓它們驅動腫瘤發生,但惡性腫瘤會逐漸對這種療法產生抗性,這項工作就告訴了我們抗性是如何產生的。
此後,倫敦大學學院(University College London)及克里克研究所(Crick Institute)的Charles Swanton組給出了強有力的證據,表明CIN在人類癌症中十分重要。2017年,通過隨訪肺癌病人,Swanton團隊證明了是染色體不穩定——而不是腫瘤基因組中點突變的個數——與整體生存率的降低相關。他們後續的研究顯示,無論是腫瘤轉移還是癌細胞逃逸免疫監控,CIN很可能在腫瘤生物學的方方面面都扮演着重要的角色,癌細胞每次分裂伴隨的染色體拷貝數逐步改變,為腫瘤提供了能在各種選擇壓力下演進的能力。
正因為這些科學家們不斷研究CIN在癌症中的作用,癌症基因組學與細胞生物學之間的界限逐漸在消解。一方面,染色體所攜帶的遺傳密碼可以用複雜的基因組學手段破譯;另一方面,染色體生命週期與細胞分裂過程中的分離行為基本上可以用分辨率較高的光學顯微鏡來跟蹤。例如,分離過程中出現錯誤的染色體最終會出現在一個容納小段DNA的“微核”(micro-nuclei)中,與細胞核——即“主核”——分離。微核一直被看作是區分癌細胞及周圍正常組織的一個特徵。多個研究組的工作顯示,包裹微核的核膜經常破裂,把染色體灑到細胞質中,暴露在核酸酶下,同其它蛋白質一樣被降解,變得四分五裂。

發生大規模的染色體斷裂之後,有些片段會丟失,有些則會隨機接在一起,那麼片段與片段之間連接的方向和順序都可能出錯,從而形成新的、高度異常的染色體。這個過程稱為“染色體碎裂”(chromothripsis)。近期,研究者發現,染色體碎裂是刺激癌症惡化的重要機制。除了染色體數目一步步變化外,通過大規模的染色體重排,碎裂的染色體很快就形成一個能開出癌症的大獎池——癌症一發生,就已經很嚴重了。這個過程有可能快速擴增致癌基因,並丟失抑癌基因。我們現在還知道,染色體碎裂可能會把致癌基因置於高度活躍的染色體區域附近,還會促進環狀染色體外DNA的形成,兩者都會促使腫瘤細胞快速形成對靶向治療的抗性。
儘管研究者很早就發現了癌症中染色體的混亂狀態,但直到最先進的基因組學和顯微技術出現,我們對染色體碎裂過程的理解才逐漸清晰起來。2015年,丹娜-法伯癌症研究所的David Pellman及同事應用顯微技術捕捉到了出現染色體分離錯誤的單個癌細胞,並對其進行了基因組分析。通過這種方法(他們稱為Look-seq),研究者展示了在人類癌症基因組中常見的複雜染色體重排模式是怎樣在一個細胞週期內出現的。通過各種各樣的途徑,CIN似乎既可以促進漸進式的,也可以促進間斷性爆發式的腫瘤基因組演化。這,大概就是我那位病人的情況——確診沒多久就出現了大規模的染色體畸變。
微核的形成機制
細胞分裂過程中,有許多染色體分離錯誤都可能導致微核形成。即使最終染色體並沒有錯誤分離,也還是有可能形成微核。例如圖2所示的情況,雖然染色體最終是平均分配給了兩個子細胞,但由於分離滯後,左邊的子細胞還是形成了微核。這些事件不互斥,也不獨立,只是每一次發生都會加劇染色體的混亂。
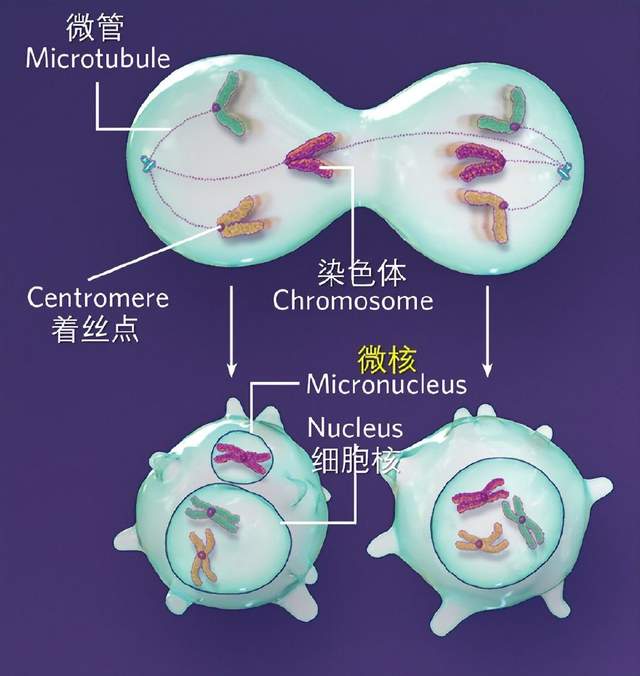
當分裂細胞兩極的微管附着到同一中心粒時(上),被附着染色體的分離會滯後於其它染色體,之後常常會被包裹到微核中,即使它最終還是分到了應該分去的細胞(左下)。

如果染色體分離真的出錯了,不管是由於微管錯誤附着還是由於其它的原因,錯誤分離的染色體可能會隨其它染色體被核膜包裹。要是沒有被包裹,形成的非整倍體細胞就可能帶有一條滯後的染色體,增加微核形成的風險。
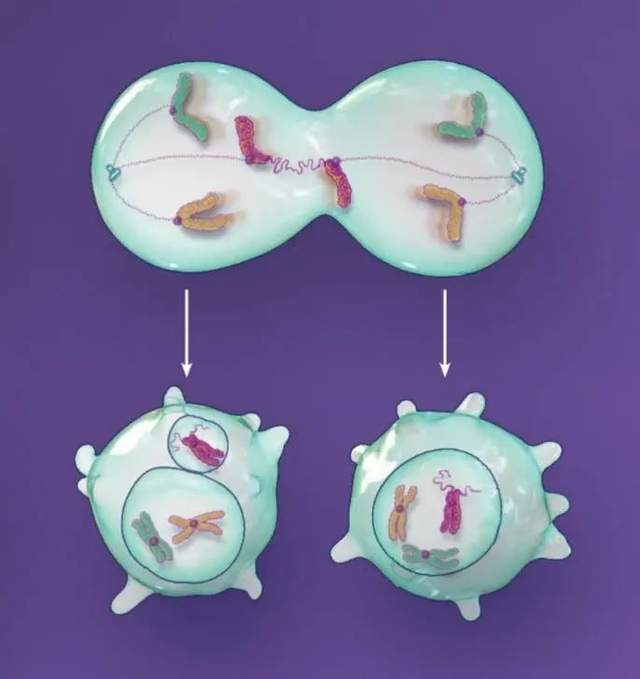
端粒的縮短或損壞能讓染色體融合更有可能發生。這樣的融合事件會產生帶有兩個中心粒的染色體。在下一次細胞分裂過程中,帶雙中心粒的染色體會被撕裂,分到兩個子細胞中。這些損壞的染色體要麼立即被隔離到微核中,要麼在下一次細胞分裂過程中由於無法正常完成複製,還是被隔離到微核中。
CIN與炎症
在研究染色體不穩定性會怎樣影響癌症轉移時,我們得到了意料之外的發現。具體來説,已經發生CIN的癌細胞,它的炎症相關信號通路是激活的,這就能讓癌細胞產生、分泌多種與癌症轉移相關的炎症因子。這件事情一開始挺迷的,因為這些細胞只是在實驗室裏養着,並沒有種到實驗動物體內,也就沒有任何接觸到免疫細胞的機會。那麼這些“炎症反應”是什麼引發的呢?
在顯微鏡裏苦尋良久,我們不僅觀察到,發生CIN的細胞內,微核佔了主體,還看到那些包含破裂微核的細胞帶有一種與免疫相關的酶,叫做cGAS。cGAS於2013年首次被德克薩斯大學西南醫學中心(University of Texas Southwestern)的James Chen(陳志堅)發現,它是一種定位於細胞質的雙鏈DNA感受器。於是我們設想,微核破裂後,隨之而來暴露在細胞質中的染色體可能會被癌細胞識別為危險信號,就像細胞識別出入侵的病原DNA那樣。當然,隨後我們便確認了,破裂的微核能夠強有力地激活cGAS及其相關蛋白STING,進而激活固有免疫應答。但不像幾天之內就能清除的急性病毒感染,癌細胞的細胞質中,微核破裂事件一起接着一起,導致炎症通路一直處於激活狀態,炎症一直持續。
至此,事情已經很清楚了:癌細胞一定是利用了某一條保護性的免疫通路,才能夠衝破這些炎症防線。雖然在腫瘤發生早期,固有免疫信號通路的激活可能保護人體,預防腫瘤出現,但到了一定階段,腫瘤細胞能夠越過這些保護性機制,耐受CIN所引發的炎症反應,並逐漸利用這些通路來驅動腫瘤生長。癌細胞維持炎症的能力對其向另一器官轉移至關重要。免疫細胞是機體內最機動的細胞,人體遭遇感染或出現傷口後的數小時內,它們就能穿過血管系統遷移到靜水壓升高的發炎組織中,到達受損區域。癌細胞就是利用CIN和其它基因組異常,通過模擬這一生理過程來實現轉移。
慢性炎症與癌症之間的關聯由來已久。事實上,古羅馬百科全書派學者Aulus Cornelis Celsus所描述的炎症最核心的特徵對癌症也適用——發紅、發熱、疼痛腫脹,幾百年來,臨牀醫生常常將腫瘤稱為“無法癒合的傷口”,因為它會持續不斷地發炎。我們還不十分清楚炎症信號通路對癌症的發展起着什麼樣的作用,但是將內在的基因組異常(例如染色體不穩定)與癌症中持續的炎症關聯起來,就能夠發現,CIN不僅能驅動腫瘤的遺傳異質性,也能通過非遺傳性的機制(即模擬炎症反應)刺激癌症轉移。
微核破裂如何促進癌症發展?

微核的核膜很脆,經常破裂,導致染色體散落到細胞質中。細胞質裏面的染色體會被核酸酶切成小的片段,這些片段要麼丟失,要麼被隨機連接到一起,要麼首尾相連,形成環狀染色體外DNA。這個過程就是所謂的“染色體碎裂”。這個過程形成的複雜的重排染色體會驅動腫瘤的產生。
與此同時,停留在細胞質中的DNA會引發cGAS-STING炎症通路。一般認為,這條通路是從抵抗病毒感染的機制演化而來的。cGAS與微核破裂散落的DNA結合,催化生成2’3’-環鳥腺苷酸(cGAMP),從而激活STING蛋白及下游炎症通路。由於癌組織中有很多微核,就有可能一直激活這條通路,引發持續的炎症反應,驅動腫瘤生長和轉移。
瞄準CIN
和癌細胞不同,正常的細胞無法耐受染色體分離錯誤。麻省理工學院(MIT)已故的Angelika Amon曾領導的研究發現,非整倍性與多重細胞缺陷有關聯,例如代謝紊亂和線粒體功能紊亂,以及蛋白質摺疊錯誤誘導的細胞應激反應。實際上,人體已經演化出多種機制,能夠最終清除非整倍體細胞。達特茅斯蓋澤爾醫學院(Geisel School of Medicine at Dartmouth)的Duan Compton等人發現,應對染色體分離錯誤,正常細胞會快速激活腫瘤抑制因子p53,停止細胞分裂,阻止非整倍體細胞蔓延。這些重要的保護機制是為了維護基因組的完整性,一般有了它們,基因組就沒事。但是在癌細胞中,這些防線被突破了。因此,理解腫瘤細胞是怎樣應對CIN的,可能會對治療癌症有啓發。
學界對腫瘤細胞耐受CIN的機制表現出越來越多的興趣。近期,多個課題組通過遺傳篩選發現了一些基因和一些細胞活動,它們對CIN程度高的腫瘤細胞不可或缺,缺乏則會致死。其中一個是驅動蛋白Kif18a,在有絲分裂期間、染色體運動過程中起作用。對帶有CIN的癌細胞來説,Kif18a蛋白在細胞分裂中必不可少,但是不帶CIN的癌細胞就不然。有趣的是,如果一隻小鼠缺乏有功能的Kif18a蛋白,它仍可以存活,只是表現出一些小的缺陷。那麼這個驅動蛋白就有可能成為一個安全有效的治療靶點。現在已經有一項一期臨牀試驗在癌症晚期病人中測試Kif18a抑制劑的療效。
還有多個課題組正在探索另一種治療策略,即,抑制那些讓腫瘤細胞克服慢性炎症的靶點。比如ENPP1蛋白,它一開始由哈佛醫學院的Timothy Mitchison及斯坦福大學的Lingyin Li(當時也在哈佛)找到,後來我們組發現,它在染色體不穩定的癌細胞中會被選擇性上調。ENPP1蛋白是定位在癌細胞外表面的酶,能降解會激發免疫反應的信號分子cGAMP。胞外的cGAMP被降解後,免疫細胞就不能發現癌細胞了。cGAMP降解還能產生腺苷,腺苷又加劇免疫紊亂,促進癌細胞遷移。癌細胞化敵為友、將免疫系統的保護機制挪作己用的能力讓我們刮目相看。
Volastra公司的研究者們正在不斷深入認識CIN的生物機制,再結合計算和遺傳篩選的方法,慢慢發現一些癌症治療策略。目前首要候選藥物的靶標作用於微管結合染色體的過程,它能選擇性地殺死染色體不穩定的癌細胞,而不會傷及其他細胞。該藥物計劃在2023年推向臨牀試驗。我們正在探索的其他治療策略包括:調節紡錘體的形成、改變細胞分裂期間染色體的組織,以及利用CIN驅動的炎症反應來抗癌。
尋找與CIN相關並且可作為治療靶標的通路是件令人興奮的事,它將打破部分癌症無藥可及的局面。CIN是個很有吸引力的藥物靶標,因為只有癌細胞會表現出染色體不穩定,那麼針對CIN的治療就不會錯傷無辜——這是癌症治療領域的聖盃。過去的十餘年間,細胞生物學、基因組學及癌症生物學領域逐漸交織在一起,跨學科研究方法和學術界與產業界的合作將帶來新的發現。這一切的終極目標是為病人服務——像我的那位腫瘤轉移到腦部的病人,和其他現有的治療選擇十分有限的病人。
本文經授權編譯自the-scientist.com,原標題為How Chaos in Chromosomes Helps Drive Cancer Spread
閲讀原文:
https://www.the-scientist.com/features/how-chaos-in-chromosomes-helps-drive-cancer-spread-69695
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。