“殺死”病毒的六種方法:哪款最適合新冠病毒?_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2022-05-19 14:26
 本文歸納了滅活病毒的若干種方式及其滅活原理,大家可據此尋找合適的消殺方法。同時,我們還會看到,新冠滅活疫苗也許還有更多的發展空間。
本文歸納了滅活病毒的若干種方式及其滅活原理,大家可據此尋找合適的消殺方法。同時,我們還會看到,新冠滅活疫苗也許還有更多的發展空間。
撰文 | 彭程(清華大學李賽實驗室博士研究生)、李賽(清華大學結構生物學高精尖創新中心研究員)
人類的發展歷史也是一部病毒抗爭史,回顧歷史長河,病毒已對人類展開過無數次猛烈的進攻。根據推測,天花病毒在一萬多年前就已經出現,直到1980年之前一直在世界各地橫行。天花致死率很高,僅在20世紀就造成全世界約3億人死亡[1]。流感病毒在近一百多年也多次肆虐全球,僅1918年的西班牙大流感便奪去了數以千萬計的生命[2]。此外,人類免疫缺陷病毒(俗稱“艾滋病毒”)、埃博拉病毒、肝炎病毒依舊對人類虎視眈眈,當前新型冠狀病毒也因其突變株的不斷出現而持續表現出強勁的傳播特性。截至目前,本次新冠疫情的死亡人數也已經上升到人類歷史上病毒瘟疫致死人數的第三位(自Wikipedia)。面對這個看不見的敵人,人類彷彿顯得有些被動,難道我們不能主動去“殺死”病毒嗎?
其實在還未認識病毒時,人類就已經摸石頭過河,摸索出了一些“殺死”病毒的方法。我國古代醫學對此也有所記載,有些方法現在來看仍具有科學指導意義。如李時珍在《本草綱木》中記載的“天氣瘟疫,取出病人衣服於甑上蒸過,則一家不染”就是利用高温“殺死”病毒的例子。隨着生物學、物理學、現代醫學和化學的進步,人類對病毒的認知也從原來的“邪氣”、“上帝的懲罰”到現在的“一種專營寄生的微小生物顆粒”,這也為“殺死”病毒的手段開發提供了生物學依據。
如今,人們已經擁有多種“殺死”病毒的手段,有些能破壞病毒結構而快速“殺死”病毒,如酒精(破壞囊膜)、高温(蛋白變性),這類也是目前消殺的常用手段,有些方法能在“殺死”病毒的基礎上保留病毒的免疫原性或結構完整性,如甲醛(固定蛋白)、β-丙內酯(破壞核酸),病毒被它們“殺死”後常被用來製備疫苗或用作病毒的結構生物學研究。
如何才能“殺死”病毒?
其實,“殺死病毒”這個表述並不準確。病毒可謂是大自然以“極簡主義”設計的生物體之一,其構造簡單到僅剩蛋白/脂膜包裹的核酸。在體外它不會自我複製,沒有能量消耗,也沒有物質的合成與分解,貌似就是個“死”的狀態,但它一旦侵入到細胞內,又可以將整個細胞變成自己的生產工廠,繁殖出更多的病毒顆粒來。因此,病毒是否有生命這個話題一直沒有明確的答案。前文所説的“殺死”,其實是指讓病毒失去繁殖的能力,也就是讓病毒哪怕遇到宿主也別再“活過來”。在體外,這一過程在病毒學界則被稱為“滅活”。
若想阻斷病毒的繁殖,首先得要了解病毒的生活週期。病毒顆粒通過其表面的蛋白作為“鑰匙”識別宿主並進入胞內,利用細胞的原料和能量複製自己的基因組,合成自己的蛋白,這些新合成的基因組和結構蛋白會裝配成子代病毒顆粒後被釋放到胞外。針對病毒的生命活動過程,滅活的思路大體分為三種,一種是破壞病毒的整體結或病毒的蛋白結構,使其喪失侵入細胞的能力,另一種是“鎖住”病毒的蛋白,使其無法發揮功能,最後是破壞病毒的基因組,使其基因組無法在胞內複製。
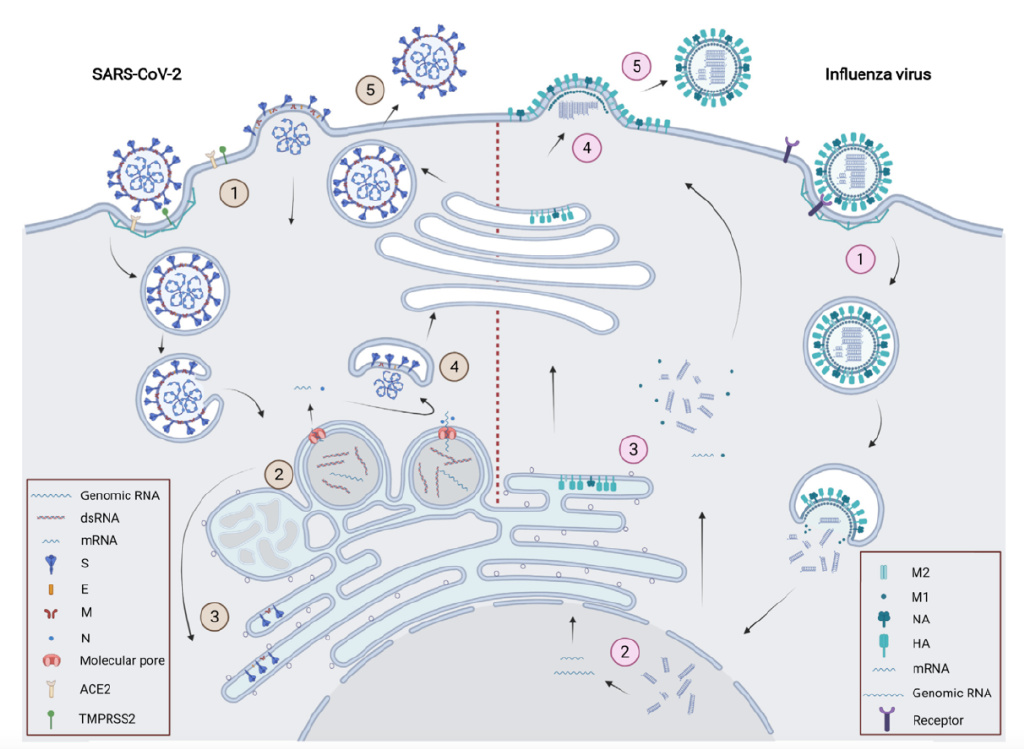 新冠病毒與流感病毒的生活週期[3]。
新冠病毒與流感病毒的生活週期[3]。
新冠病毒(左)和流感病毒(右)的生命週期都經歷以下步驟:
①進入細胞。病毒顆粒表面蛋白與受體識別,發生膜融合並釋放遺傳物質;
②基因組複製。新冠病毒誘導細胞產生雙膜囊泡(DMV)[4]作為其基因組複製的場所,流感病毒在細胞核中進行基因組複製;
③病毒蛋白翻譯;
④病毒顆粒組裝和出芽。新冠病毒的組裝發生在內質網-高爾基體中間體(ERGIC),流感病毒在細胞膜上組裝;
⑤子代病毒釋放。
基於以上思路,各種各樣病毒滅活的方法也隨之誕生。根據滅活方式分類,可分為化學滅活和物理滅活兩種。不同的滅活方法對病毒產生不同的影響,有的方法可以快速滅活病毒,有的方法能夠在滅活病毒的基礎上保留病毒的蛋白結構或免疫原性。科學家們也基於不同的滅活手段進行着下游的科研,如快速消毒手段的建立、病毒的結構解析、滅活疫苗的開發等。本文將簡要介紹幾種主要的病毒滅活手段及原理。
化學滅活
甲醛
大家對甲醛應該不陌生,它的水溶液就是大名鼎鼎的福爾馬林,是一種防腐劑和固定劑。甲醛含有一個電子缺失的中心碳原子,是親電子的,因此可以與親核體發生親核加成反應。它可以使蛋白質氮端的氨基以及側鏈含氮的氨基酸(如賴氨酸、精氨酸、酪氨酸等)單羥基化,並進一步脱水形成亞胺中間體,而這些中間體可以與與精氨酸、酪氨酸的殘基再次反應形成亞甲基橋,發生交聯。此外,甲醛也可以使腺嘌呤單羥基化,阻止基因的讀取[5]。因此,甲醛既可以對病毒的蛋白和基因組實現雙重打擊,還能通過交聯固定病毒蛋白的結構。由於甲醛能“鎖定”蛋白結構,甲醛滅活既是滅活疫苗開發的主要候選手段,也是結構生物學家在病毒結構解析中常用的病毒滅活方式[6]。
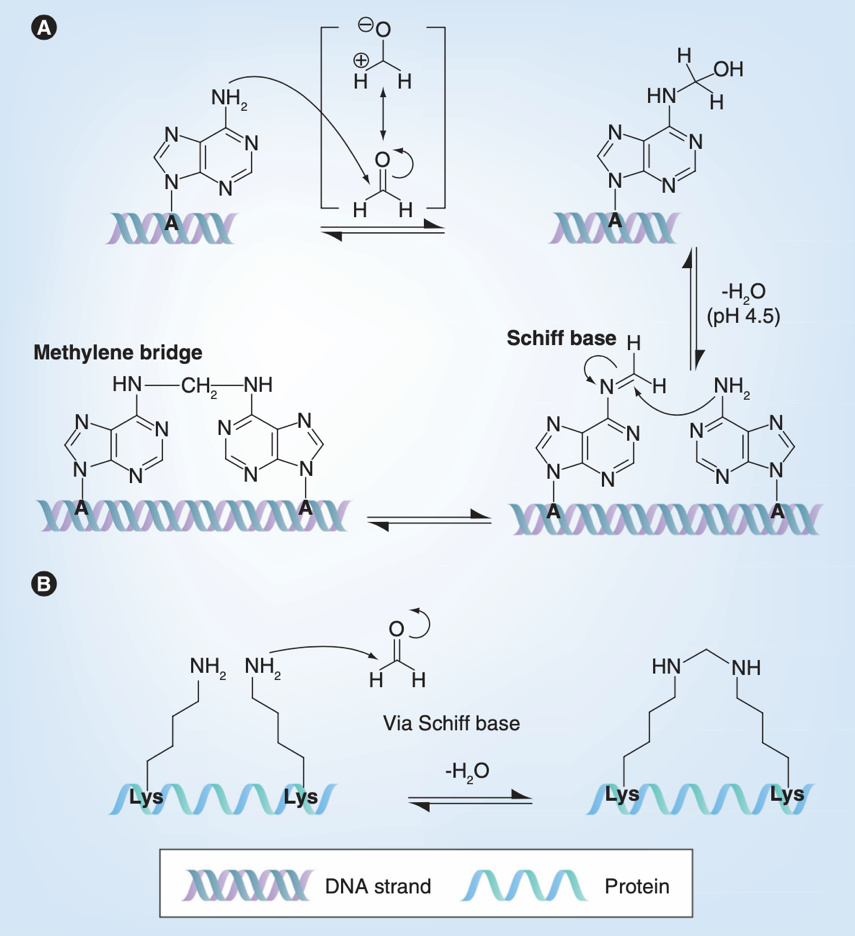 甲醛與腺嘌呤和賴氨酸的反應原理[5]
甲醛與腺嘌呤和賴氨酸的反應原理[5]
β-丙內酯
β-丙內酯是一種主要針對鳥嘌呤的烷化劑,也被認為是一種傾向於破壞核酸的滅活試劑。親電的β-丙內酯可與鳥嘌呤發生親核取代反應,使β-丙內酯開環和鳥嘌呤烷基化,導致病毒基因組失活[5]。目前,β-丙內酯是滅活疫苗開發中最廣泛使用的滅活劑,但有研究表明β-丙內酯也會對部分氨基酸進行修飾,發生酰化和交聯反應[7]。
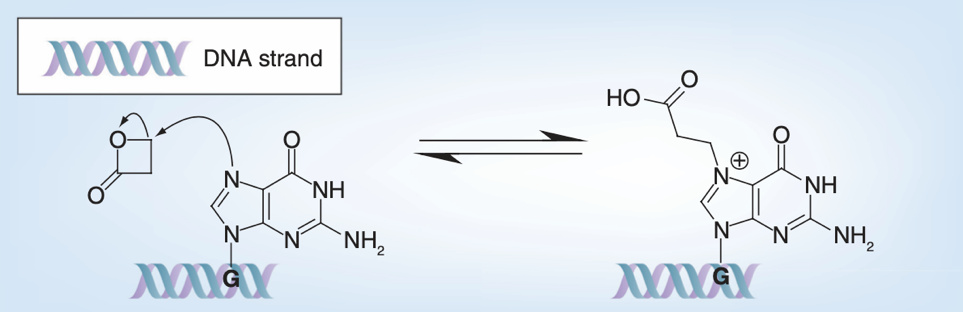 β-丙內酯與鳥嘌呤的反應原理[5]
β-丙內酯與鳥嘌呤的反應原理[5]
乙醇
乙醇也就是酒精。乙醇對病毒的滅活速度很快,尤其是囊膜病毒。囊膜病毒是一類外層由脂雙層包裹的病毒。由於乙醇具有脂、水雙親性,因此乙醇可以增強膜對水的親和力,同時減少非極性氨基酸殘基之間的相互作用,從而既能破壞病毒的整體結構,又能使病毒蛋白質變性[8]。
2021年,Das等人通過分子動力學模擬的手段描述了乙醇對囊膜病毒的破壞作用,病毒在75%乙醇溶液浸泡後,其囊膜會發生瓦解並導致內容物的釋放[9]。新冠病毒也是一種囊膜病毒,2020年Annika Kratzel經過實驗發現,新冠病毒在高於30%酒精溶液中浸泡30秒後其感染力可下降至本底水平[10]。除乙醇之外,還有很多醇類化合物也能表現出較快的滅活速度,如正丙醇、異丙醇等[10]。由於這些化合物具有滅活速度快,毒性小的特點,因此常被用作洗手液的主要成分和物品的表面消毒劑等。
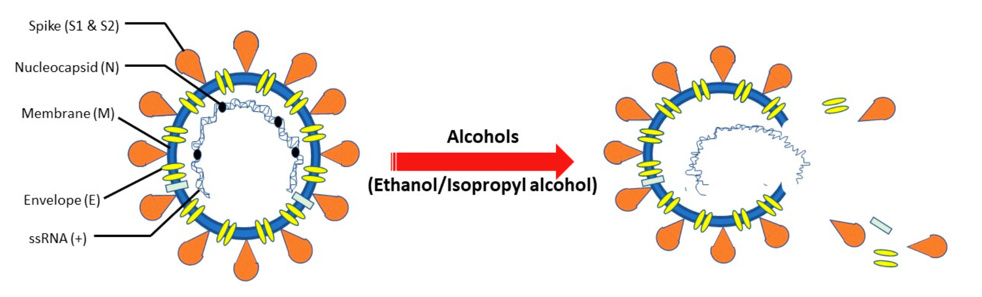 醇類化合物破壞新冠病毒的原理圖[8]
醇類化合物破壞新冠病毒的原理圖[8]
物理滅活
温度
高温也是一種常見和常用的滅活手段。在高温的作用下,維持病毒蛋白二級、三級結構的化學鍵會被破壞,導致蛋白質變性,使病毒喪失侵染細胞和複製的能力。加泰羅尼亞理工大學的Didac Martí等人利用分子動力學模擬發現高温會引起新冠病毒表面的蛋白尤其是表面蛋白的受體結合區域發生結構變化和氫鍵重排[11]。此外,高温還可以使核酸的骨架發生斷裂。
值得一提的是,目前認為“較低”高温(低於41℃)就可以使病毒基因組發生斷裂,而不影響蛋白結構和功能[5]。2020年,巴斯德研究院的Christophe Batéjat對新冠病毒的鼻咽拭子樣品進行56℃、65℃和95℃的高温處理,發現分別經過了20min、10min和3min便會使新冠病毒失活[12]。高温滅活的手段因其效果穩定且具有廣譜性,現在也是作為生物安全廢棄物處理的必需步驟。
紫外光
紫外光是頻率比藍紫光高的不可見光。根據國際標準化組織(ISO)的標準,紫外光可根據波長進一步分為UVA波段(320–400 nm)、UVB波段(280-320 nm)和UVC波段(200-280nm)等。其中,UVC對病毒最具有破壞性,隨後依次為UVB、UVA[13],因此UVC也是用來滅活病毒的主要波段。
紫外光對病毒核酸的破壞方式主要是誘導核酸內部形成嘧啶二聚體。當紫外光被病毒的核酸吸收後,病毒基因組中相鄰或相對的兩個嘧啶會發生光化學融合,形成共價連接的嘧啶二聚體。嘧啶二聚體由於共價作用會給基因組的骨架引入張力,導致基因組骨架斷裂[5]。對部分病毒而言,紫外光能在病毒完全滅活的基礎上保留病毒的融合活性[14]。對於新冠病毒,經過9分鐘的UVC照射(累計劑量1048 mJ/cm2)便可使高感染滴度(5 * 106 TCID50/mL)的新冠病毒徹底滅活[13]。雖然UVC的滅活效果好,但其穿透能力較差,普通透明玻璃、衣服、塑料等就能阻擋大部分UVC。因此,UVC常被用在器械物品表面及醫院、生物安全等級實驗室的室內空間消毒。
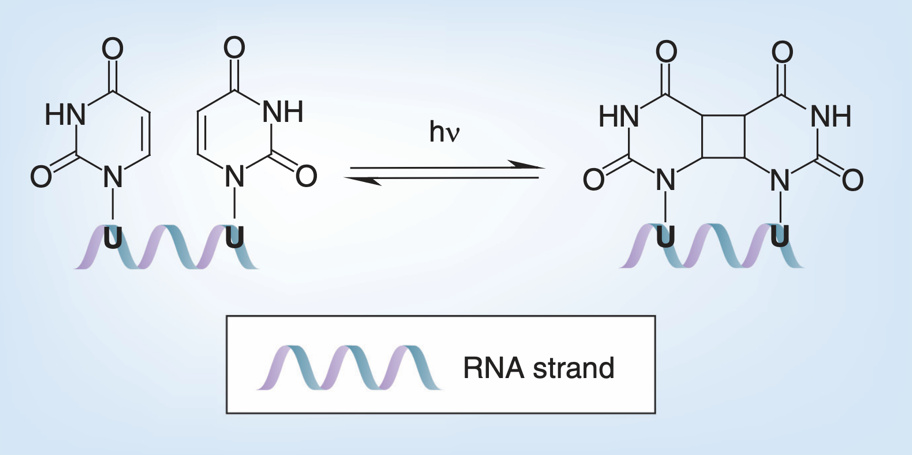 相鄰尿嘧啶經紫外光照射形成嘧啶二聚體原理圖[5]
相鄰尿嘧啶經紫外光照射形成嘧啶二聚體原理圖[5]
電離輻射
電離輻射是一種能導致物質原子或分子發生電離的能量。三種主要的電離輻射技術是γ輻射、電子束和X射線。γ射線是一種由原子衰變裂解時放出的射線。電子束(eBeam)即為從電子束加速器中產生的高能電子束。X射線是由原子核外電子的躍遷或受激等作用產生的射線[15]。雖然來源不同,但是對病毒滅活的機理基本類似。
電離輻射對病毒的破壞作用分為直接作用和間接作用。電離輻射可以直接將病毒體內分子的化學鍵打斷,也可以使水分子發生電離。水分子輻解會產生各種各樣的高活性自由基。儘管這些自由基的存在時間極短,但其可以與周圍的蛋白和核酸反應,產生極大的破壞性,間接對病毒造成損傷[15]。不過也有人認為電離輻射會主要攻擊病毒的基因組而非蛋白質[16]。電離輻射的滅活效果與輻射劑量有關,且不同病毒存在較大差異[16]。隨着發射源技術的更新與進步,電離輻射滅活技術也開始應用在了疫苗研發、進口國冷鏈包裝消毒等領域。
滅活的病毒就是滅活疫苗嗎?
談到病毒的滅活,自然就離不開滅活疫苗這個話題。疫苗的作用是為了讓我們的機體獲得抗原特異的適應性免疫。在佐劑的輔助下,疫苗特定的免疫原性可讓我們建立起特異的免疫記憶。當下次相同病原體侵襲時,機體便能快速激活相應的免疫系統,迅速清除病原體[17]。在由疫苗介導的免疫記憶的建立中,疫苗的免疫原性起着關鍵的作用,滅活疫苗也不例外。
雖然滅活病毒有一定的安全保障,但是並非被滅活的病毒都還具有正確的免疫原性。從分子層面來講,免疫原性的保留就是病毒表面蛋白完整性和完好性的保留。而從上文可知,病毒滅活的過程中會不可避免地影響蛋白結構。因此,在滅活疫苗研發的過程中需要尋找一個平衡點,即,在保證穩定徹底滅活病毒的基礎上,儘可能提高病毒的免疫原性。從上個世紀初開始,科學家便不斷嘗試用不同的方式製備具有免疫原性的滅活疫苗,其中也有不少已經可以使用和普及的疫苗,包括脊髓灰質炎病毒疫苗、甲型肝炎病毒疫苗和狂犬病疫苗等。
目前,滅活疫苗的滅活方式仍以化學試劑為主,其製備流程大致為:病毒擴增——病毒滅活——化學試劑去毒——病毒純化——添加佐劑——裝瓶。雖然工藝看起來比較傳統,但在研發的過程中仍有幾大難點亟待解決:
1、在製備疫苗之前,需要獲得一株具有良好免疫效應的穩定種子毒株;
2、需要選擇合適的滅活劑、劑量及處理方式,以保證疫苗的免疫原性;
3、需要對滅活病毒進行高標準的純化;
4、需要較高的工業水平以支撐超大規模的快速量產。
這些因素導致一般疫苗從開發到上市都會經歷大約10年之久。不過,出於科研、工藝水平的進步和時間的緊迫性,我國在分離出首株新型冠狀病毒毒種後不到一年半的時間內,自主研發並上市的滅活疫苗便已經獲得了世衞組織的緊急使用授權。
相比於其他疫苗,滅活疫苗具有研發週期短、工藝相對成熟、安全較有保證、易於保存和運輸的優勢。但滅活疫苗自身也有一些弱點,如為應對病原快速變異的疫情,常需針對變異毒株更新疫苗,核酸類疫苗的更新速度相對滅活疫苗可能更快。此外,對於一些抗原穩定性較差的病毒,傳統滅活方式難免會損壞免疫原性。有研究發現,新冠病毒經過0.05%的β-丙內酯4℃敷育36h後,其表面74%的蛋白構象已不再具備正確的免疫原性[18],這也側面説明滅活疫苗的研製仍有很大的開發潛力。
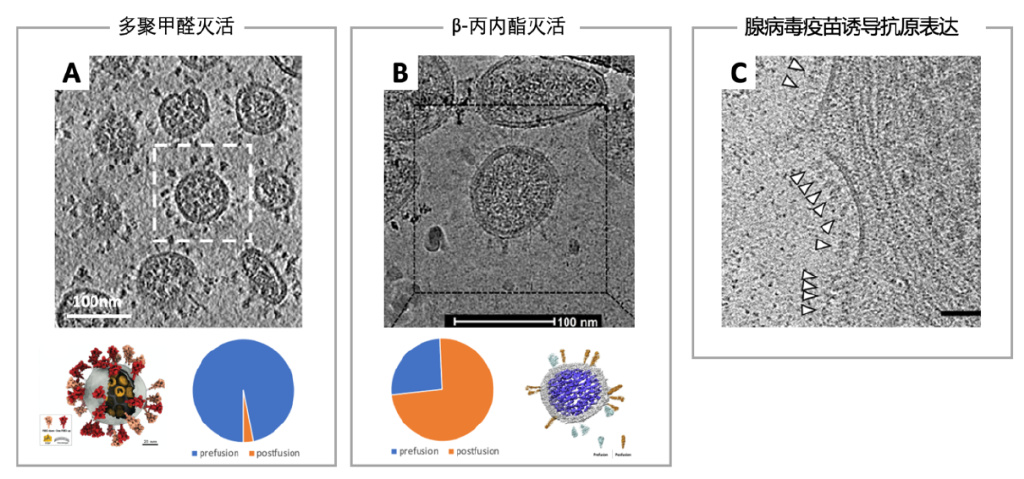 經多聚甲醛[6]與β-丙內酯[18]滅活的新冠病毒的結構和腺病毒疫苗誘導抗原在細胞表面表達的電鏡照片[19] 。
經多聚甲醛[6]與β-丙內酯[18]滅活的新冠病毒的結構和腺病毒疫苗誘導抗原在細胞表面表達的電鏡照片[19] 。
圖A和圖B:與多聚甲醛固定後的病毒相比,β-丙內酯滅活可能會造成刺突蛋白髮生巨大的構象變化,由倒三角形(餅圖中藍色)變為長柱形(餅圖中橘黃色)。但並不排除這劇烈變化是發生在病毒純化時,因為β-丙內酯處理後的刺突蛋白較甲醛處理後具有更高的自由度。不過,這也並不代表甲醛滅活的病毒免疫原性更高,經研究,經甲醛固定後可能減少了刺突蛋白上受體結合區域的暴露,反而影響了免疫反應的誘導[20]。
圖C:一類核酸疫苗——腺病毒疫苗可直接誘導宿主細胞表達抗原,刺激機體免疫反應,這種方法引入的抗原不會受到外界損壞。圖為細胞接種了腺病毒疫苗後表面表達出大量抗原。
展 望
滅活是我們主動對抗病毒的武器,除直接的消殺外,我們還可以利用滅活的病毒為我們自己添加一堵免疫城牆。尋找僅破壞核酸而不改變抗原結構、成本低、通量高、無毒性的滅活方式,是提升滅活病毒疫苗製備工藝的目標。目前,多種物理滅活的方法也在疫苗開發上表現出很大的潛力,甚至有些方面更有優勢。首先,物理滅活不會引入新的毒性,可以減去製備上去毒的操作;另外,物理滅活具有廣譜性,對不同種類或能快速變異的病毒適用性更強。此外,物理滅活還有保留較好免疫原性、製備成本低、通量高的研發潛能。目前已有利用電離輻射進行滅活疫苗研發的例子,如用γ射線滅活的流感病毒[15]、脊髓灰質炎病毒[21]等均表現出一定的開發潛能。
隨着免疫學理論的不斷累積和多種滅活技術的不斷成熟,相信在不久的將來,人類在面對疫情的時候可以當即反應,既能迅速消殺,也能快速製備疫苗,主動反擊,阻止病毒的擴散和傳播。
參考文獻
[1] Henderson, D.A., The eradication of smallpox--an overview of the past, present, and future. Vaccine, 2011. 29 Suppl 4: p. D7-9.
[2] Lemon, S.M. and A.A. Mahmoud, The threat of pandemic influenza: are we ready? Biosecur Bioterror, 2005. 3(1): p. 70-3.
[3] Li, S., Cryo-electron tomography of enveloped viruses. Trends Biochem Sci, 2022. 47(2): p. 173-186.
[4] Wolff, G., et al., A molecular pore spans the double membrane of the coronavirus replication organelle. Science, 2020. 369(6509): p. 1395-1398.
[5] Delrue, I., et al., Inactivated virus vaccines from chemistry to prophylaxis: merits, risks and challenges. Expert Rev Vaccines, 2012. 11(6): p. 695-719.
[6] Yao, H., et al., Molecular Architecture of the SARS-CoV-2 Virus. Cell, 2020. 183(3): p. 730-738 e13.
[7] Uittenbogaard, J.P., et al., Reactions of beta-propiolactone with nucleobase analogues, nucleosides, and peptides: implications for the inactivation of viruses. J Biol Chem, 2011. 286(42): p. 36198-214.
[8] Basak, D. and S. Deb, Sensitivity of SARS-CoV-2 towards Alcohols: Potential for Alcohol-Related Toxicity in Humans. Life (Basel), 2021. 11(12).
[9] Das, S., et al., The role of the envelope protein in the stability of a coronavirus model membrane against an ethanolic disinfectant. J Chem Phys, 2021. 154(24): p. 245101.
[10] Kratzel, A., et al., Inactivation of Severe Acute Respiratory Syndrome Coronavirus 2 by WHO-Recommended Hand Rub Formulations and Alcohols. Emerg Infect Dis, 2020. 26(7): p. 1592-1595.
[11] Marti, D., et al., Temperature effect on the SARS-CoV-2: A molecular dynamics study of the spike homotrimeric glycoprotein. Comput Struct Biotechnol J, 2021. 19: p. 1848-1862.
[12] Batejat, C., et al., Heat inactivation of the severe acute respiratory syndrome coronavirus 2. J Biosaf Biosecur, 2021. 3(1): p. 1-3.
[13] Heilingloh, C.S., et al., Susceptibility of SARS-CoV-2 to UV irradiation. Am J Infect Control, 2020. 48(10): p. 1273-1275.
[14] van Duijl-Richter, M.K.S., et al., Chikungunya virus fusion properties elucidated by single-particle and bulk approaches. J Gen Virol, 2015. 96(8): p. 2122-2132.
[15] Bhatia, S.S. and S.D. Pillai, Ionizing Radiation Technologies for Vaccine Development - A Mini Review. Front Immunol, 2022. 13: p. 845514.
[16] Abolaban, F.A. and F.M. Djouider, Gamma irradiation-mediated inactivation of enveloped viruses with conservation of genome integrity: Potential application for SARS-CoV-2 inactivated vaccine development. Open Life Sci, 2021. 16(1): p. 558-570.
[17] Vetter, V., et al., Understanding modern-day vaccines: what you need to know. Ann Med, 2018. 50(2): p. 110-120.
[18] Liu, C., et al., The Architecture of Inactivated SARS-CoV-2 with Postfusion Spikes Revealed by Cryo-EM and Cryo-ET. Structure, 2020. 28(11): p. 1218-1224 e4.
[19] Watanabe, Y., et al., Native-like SARS-CoV-2 Spike Glycoprotein Expressed by ChAdOx1 nCoV-19/AZD1222 Vaccine. ACS Cent Sci, 2021. 7(4): p. 594-602.
[20] Bewley, K.R., et al., Immunological and pathological outcomes of SARS-CoV-2 challenge following formalin-inactivated vaccine in ferrets and rhesus macaques. Sci Adv, 2021. 7(37): p. eabg7996.
[21] Tobin, G.J., et al., A novel gamma radiation-inactivated sabin-based polio vaccine. PLoS One, 2020. 15(1): p. e0228006.
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。