骨髓間充質幹細胞三系誘導分化技術_風聞
Cas9x海星生物-打造全球齐全的基因编辑细胞库和基因编辑技术平台2022-05-23 11:27
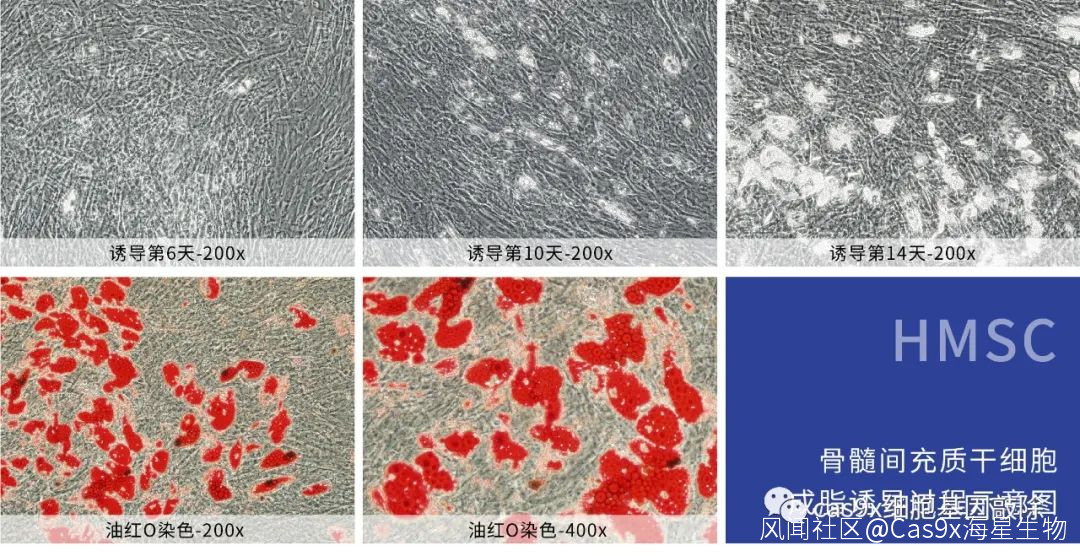
骨髓間充質幹細胞成脂誘導分化
1.1 接種幹細胞
取對數生長期的細胞,按照2.0x 10e4cells/cm2的細胞密度接種至培養器皿,於37°C,5% CO2培養環境下培養至匯合度90~100%,棄掉上清,加入成脂誘導分化培養基誘導液。NOTE:如細胞貼壁性較差,建議使用0.1%明膠對培養底面進行包被。
1.2 細胞分化誘導
於37°C, 5% CO2培養環境下培養約3天,更換為成脂誘導分化培養基維持液,培養1天后,再更換為成脂誘導分化培養基誘導液,繼續培養3天。按照以上換液頻率誘導14~21天,並注意觀察細胞形態變化。根據細胞誘導形成的脂滴數量和大小,決定終止細胞誘導的時間,並進行染色鑑定。
2. 染色鑑定
2.1 細胞固定
吸去培養基使用適量1xPBS清洗一次,棄去後取適量4%中性甲醛溶液覆蓋培養器皿底面,室温固定30~60min,棄去固定液再使用1xPBS清洗兩次。
2.2 油紅0染色
取生理鹽水或1xPBS與油紅O原液配製油紅0工作液(油紅0原液:生理鹽水=3:2),現用現配。配製後可對油紅0工作液進行離心,以沉澱染色液中的過飽和析出物。向清洗乾淨的誘導孔內加入適量油紅0工作液,靜置染色30min。吸走油紅0工作液,用1xPBS清洗兩次,並加入適量1xPBS避免細胞乾燥。
2.3 誘導評估
顯微鏡下觀察成脂染色效果,並進行圖像採集和誘導評估。誘導成功時,脂滴與油紅0染料結合後呈現紅色或橘紅色。NOTE:幹細胞的成脂分化水平因細胞類型、細胞供體來源,培養條件、細胞代次、細胞狀態和分化時間等因素而異。
骨髓間充質幹細胞成軟骨誘導分化 (平面誘導)
1. 細胞分化誘導
將對數生長期的細胞消化下來計數,成軟骨誘導分化培養基誘導液重懸細胞,離心後調整細胞密度密度1.0~2.0x 10e7cells/mL。吸取20 μl細胞懸液(約2.0~4.0x 10e5個細胞)懸滴至24孔板中央。置於37°C, 5% CO2培養環境下培養2~3 h使細胞貼壁。2~3 h後補充1 mL成軟骨誘導分化培養基誘導液正常培養。每隔2~3天換液一次。按照以上換液頻率誘導21~28天,並注意觀察細胞形態變化。
2. 染色鑑定
2.1 細胞固定
吸去培養基使用適量1xPBS清洗一次,棄去.後取適量4%中性甲醛溶液覆蓋培養器皿底面,室温固定30~60min後,棄去固定液再使用1xPBS清洗兩次。
2.2 阿利辛藍染色
向清洗乾淨的誘導孔內加入適量染色液,避光靜置染色30min。吸去阿利辛藍染色液,用1xPBS清洗兩次,並加入適量1xPBS避免細胞乾燥。
2.3 誘導評估
顯微鏡下觀察成軟骨染色效果,並進行圖像採集和誘導評估。誘導成功時,軟骨組織中的內酸性粘多糖可被阿利辛藍染成藍綠色。

成軟骨誘導分化操作(三維誘導)
1. 幹細胞的準備
將對數生長期的細胞消化下來計數,取3x 10e5個細胞轉移到15mL離心管中,250g離心4 min。棄上清,加入0.5 mL成軟骨誘導分化培養基預混液,重懸細胞,150g 離心5min。小心棄去.上清,加入0.5 mL成軟骨誘導分化培養基誘導.液,重懸細胞,150 g離心5 min。將15 mL離心管的管蓋稍稍旋開,放置於37°C,5% CO2培養環境下培養。
2. 細胞分化誘導
24h後觀察細胞沉澱形變團聚的情況,如有明顯的變化,則小心輕柔地撥動管底,嘗試讓細胞團脱離管底,全部浸潤在誘導液中。
置於37°C, 5% CO2培養環境下培養約21天,通常每2天更換一次新鮮配製的成軟骨誘導分化培養基誘導液。注意觀察細胞團成球情況及表面光滑度,決定終止細胞誘導的時間,並進行染色鑑定。
3. 染色鑑定
3.1 軟骨球固定
將軟骨球從離心管中轉移至EP管,並使用1xPBS清洗兩次,最後置於適量的4%中性甲醛溶液中。
3.2 石蠟包埋切片
軟骨球經石蠟包埋後切片。
3.3 阿利辛藍染色
將石蠟切片脱蠟和脱水,使用阿利辛藍染色液染色30 min,用自來水沖洗2 min,蒸餾水沖洗1次。
3.4 誘導評估
顯微鏡下觀察成軟骨染色效果,並進行圖像採集和誘導評估。誘導成功時,軟骨組織中的內酸性粘多糖可被阿利辛藍染成藍綠色。
NOTE:幹細胞的成軟骨分化水平因細胞類型、細胞供體來源,培養條件、細胞代次、細胞狀態和分化時間等因素而異

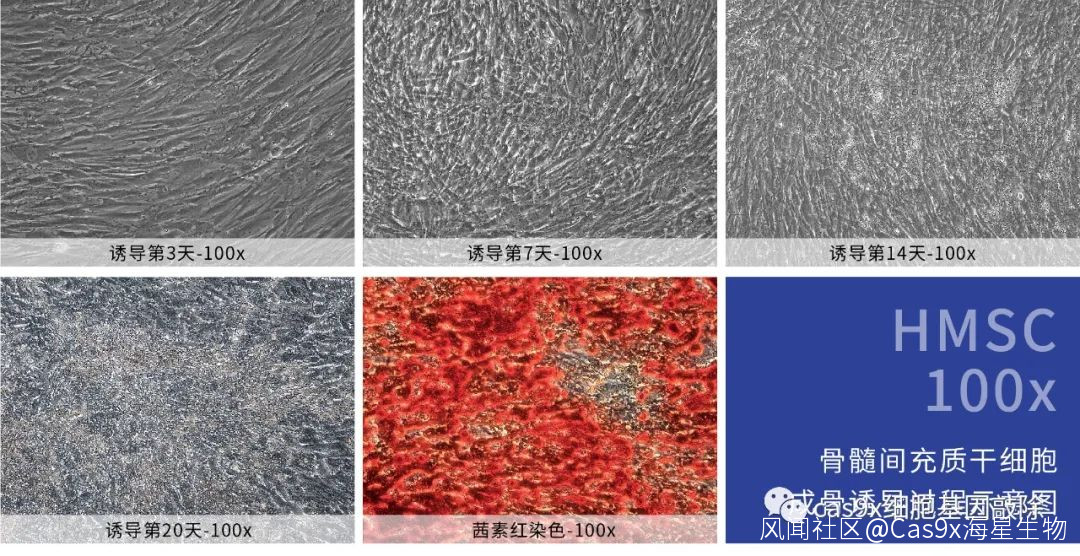
骨髓間充質幹細胞成骨誘導分化
1.1 明膠包被培養器皿
幹細胞培養較長時間後,可能會出現脱壁卷邊或漂浮現象,建議使用0.1%明膠溶液對培養器皿進行包被。準備合適的培養器皿,取適量明膠覆蓋底面37°C靜置30 min,吸取晾乾即可使用。
1.2 接種幹細胞
取對數生長期的細胞,按照2.0x 10e4cells/cm2的細胞密度接種至包被後的培養器皿中,於37°C,5% CO2培養環境下培養至匯合度60~70%,棄掉上清,加入成骨誘導分化培養基。
1.3 細胞分化誘導
於37°C, 5% CO2培養環境下培養約14~21天,每2~3天換液一次,並注意觀察細胞形態變化。根據細胞鈣鹽結晶析出和鈣質結節形成的情況,決定終止細胞誘導的時間,並進行染色鑑定。
2. 染色鑑定
2.1 細胞固定
吸去培養基使用適量1xPBS清洗一次,棄去後取適量4%中性甲醛溶液覆蓋培養器皿底面,室温固定30~ 60 min,棄去固定液再使用1xPBS清洗兩次。
2.2 茜素紅染色
加入適量茜素紅染色液染3~5 min,吸走茜素紅染色液,用1xPBS清洗兩次,並加入適量1xPBS避免細胞乾燥。
2.3 誘導評估
顯微鏡下觀察成骨染色效果,並進行圖像採集和誘導評估。誘導成功時,鈣質結節與茜素紅染料結合後呈現紅色或橘紅色。
NOTE:幹細胞的成骨分化水平因細胞類型、細胞供體來源,培養條件、細胞代次、細胞狀態和分化時間等因素而異。