更小、更強大!Science:科學家為下一代基因編輯工具提供了新起點_風聞
中国生物技术网-中国生物技术网官方账号-2022-05-30 09:39
CRISPR是細菌內部一種天然的“免疫系統”。當病毒入侵時,細菌可以捕獲外來遺傳物質的片段並將其整合到自身基因組的CRISPR序列中,隨後通過Cas核酸酶精準切斷病毒的DNA,從而抵禦病毒入侵。可以説,CRISPR是大自然擲了數十億次的骰子後(自然選擇)產生的強大工具之一。
自從十年前,兩位科學家首次證實CRISPR-Cas9可以在活細胞內編輯基因組以來,CRISPR便開創了自己的時代,從最初治療遺傳疾病,發展到艾滋病、癌症、慢性疼痛等多個治療領域,利用基於CRISPR-Cas9的基因編輯技術正在徹底改變生命科學。
CRISPR-Cas9系統使用RNA作為嚮導來識別DNA序列。當發現匹配對象時,Cas9蛋白會在正確的位置切割目標DNA,產生雙鏈斷裂,以實現在DNA水平上修復遺傳疾病。
然而,還有最後一公里的問題有待解決:越來越多的尖端應用需要將基因編輯器有效遞送到患者的每一個細胞中;而大多數Cas9太大,無法打包到目前成熟的基因組治療載體中,如腺相關病毒(AAV)載體。在小型化RNA引導的核酸酶方面,無論是結構引導方法還是定向進化也都不是很成功。因此,科學家們對Cas9小型化以擴展基因編輯工具的使用範圍產生了濃厚興趣。
北京時間2022年5月27日,發表在**《Science》上的一項最新研究中,來自康奈爾大學的研究團隊通過利用大自然的成功解決方案,讓Cas9小型化成為可能,從而為開發更小、更強大、更活躍的新一代基因組編輯工具提供了新起點。**
之所以大自然的生命系統如此令人歎為觀止,是因為一類奇特基因。越來越多的證據表明,CRISPR-Cas適應性免疫系統的核心成分可能是從這類奇特基因進化而來的。它就是轉座子。
轉座子(Transposon)是細菌內可移動的遺傳元件,它的位移不依賴於序列的同源性。轉座子被認為是CRISPR系統的進化前體。一個轉座子譜系編碼IscB,它的大小才不到Cas9的一半,但同樣可以進行DNA編輯。因此,用IscB替換Cas9將最終解決大小問題。
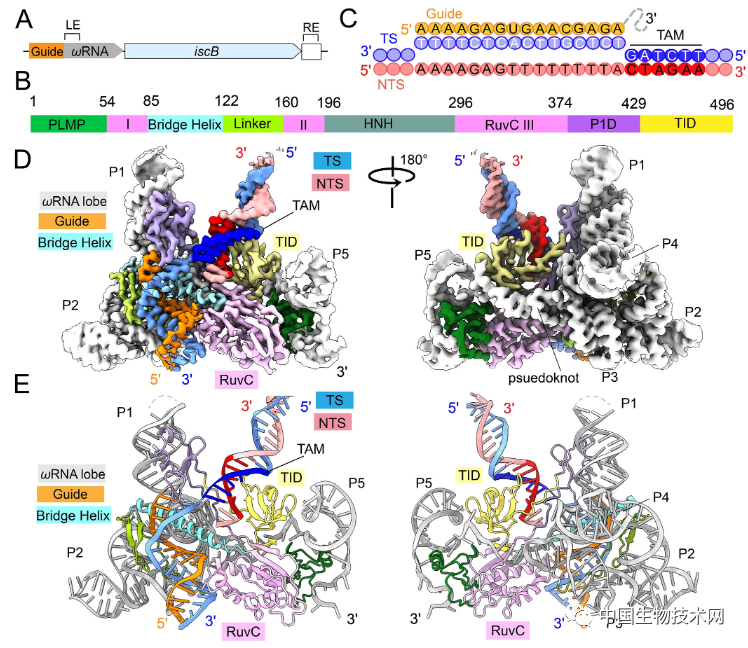
在這項新研究中,研究人員精確地定義了轉座子衍生系統如何以RNA引導的方式編輯DNA。
他們使用低温電子顯微鏡(Cryo-EM)對轉座子系統中的IscB-ωRNA分子進行高分辨率可視化,從而捕捉到該系統在不同構象狀態下的快照。 他們甚至還能通過從IscB中移除不必要的部分來設計更輕巧的IscB變體 。
研究通訊作者、康奈爾大學文理學院分子生物學和遺傳學教授可愛龍説:“許多亮眼的應用需要基因編輯器與其他酶和功能融合,而大多數Cas9s已經太大了,無法通過病毒載體遞送。我們正面臨着傳遞端的交通堵塞。如果Cas9可以被打包在基因治療領域已經用了幾十年的病毒載體中,如AAV,那我們就可以確定它們可以被遞送。因此,我們要把研究重點完全放在基因編輯工具本身的有效性上。”
該團隊從低温電子顯微鏡收集的數據表明,IscB-ωRNA系統以類似的方式工作,其更小的尺寸是通過將Cas9蛋白部分替換為與引導RNA融合的結構化RNA(ωRNA)來實現的。 通過用RNA替代較大Cas9的蛋白質成分,IscB蛋白依然保持核心化學(DNA切割)反應中心。
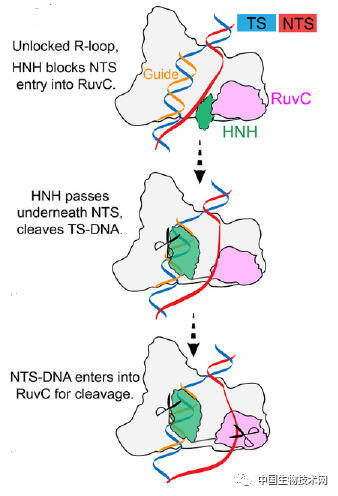
IscB功能機制圖
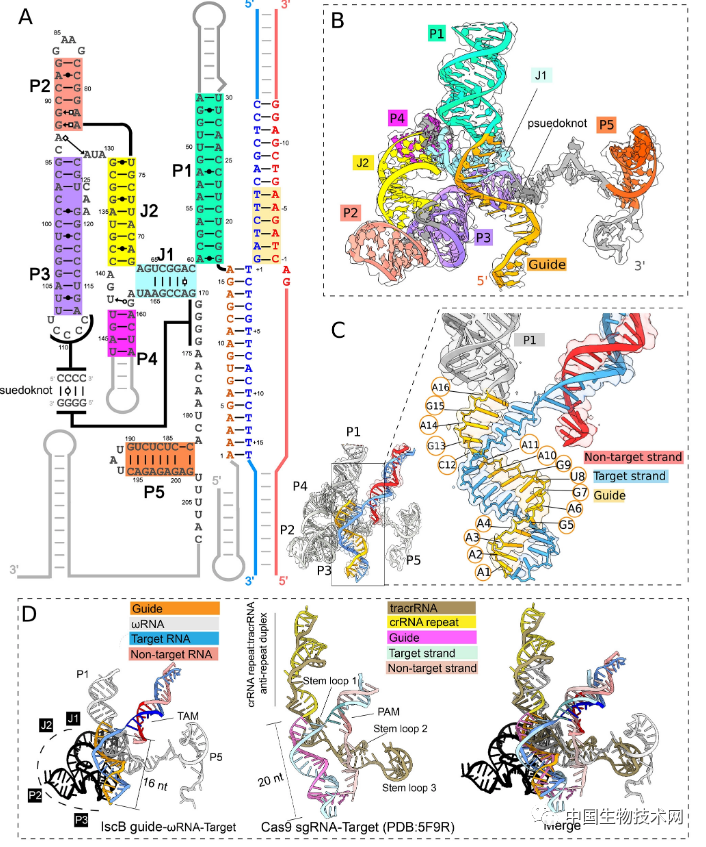
ωRNA的結構及其與Cas9 crRNA-tracrRNA的比較
該研究第一作者、微生物學系博士生Gabriel Schuler説:“這項研究讓我們瞭解分子的結構以及它們如何進行化學反應。研究這些Cas9遠古結構為我們提供了一個新的起點,可以生成更強大、更易於使用的基因編輯工具。”
可愛龍説:“轉座子是專門的遺傳搭便車者,一直在融入和剪接我們的基因組。特別是細菌內部的系統正在不斷地被選擇。大自然基本上已經擲了數十億次的骰子,併產生了真正強大的DNA工具,包括CRISPR。現在,通過高分辨率定義它們,我們可以使用大自然的力量。”
與CRISPR Cas9相比,IscB更小,研究人員相信他們還可以將其縮得更小。他們已經在不影響IscB活性的情況下去除了55個氨基酸,並希望使下一代版本的基因組編輯工具更小、更強大,從而變得更加有用。
該研究共同第一作者、康奈爾大學分子生物學和遺傳學系博士後胡純一説,更好地理解伴生引導RNA的功能是這項研究背後的另一個動機。但仍然有很多謎團待解,例如為什麼轉座子使用RNA引導系統?這個RNA有沒有可能還扮演着其他角色?
此外,研究人員仍面臨的一個挑戰是,雖然IscB-ωRNA在試管中非常活躍,但它在人類細胞中改變DNA的效率卻不高。該團隊下一步的研究將是利用分子結構來探索導致上述問題的可能性,並將其進一步優化。
論文鏈接:
https://www.science.org/doi/10.1126/science.abq7220