PCSK9單抗爭奪戰背後,國內藥企的執行力之爭_風聞
氨基观察-生物医药新时代的商业智库和价值灯塔2022-06-16 11:07
藥物研發速度的競爭,早已從仿製藥延伸至創新藥。
6月13日,信達生物宣佈,自主研發的託萊西單抗注射液(PCSK-9單抗,IBI306)遞交上市申請,這大概率讓其成為首款獲批上市的國產PCSK-9單抗。
現階段,PCSK9依然屬於藍海市場。目前,全球僅三款PCSK9靶向藥物獲批上市,分別是安進的單抗Repatha、賽諾菲/再生元的單抗Praluent以及諾華的siRNA藥物Leqvio。
2021年,全球PCSK9藥物市場規模達15.5億美元,其中安進的Repatha更是以11.17億美元的銷售額,獨佔約72%的市場份額。
雖然市場競爭並不算激烈,但Repatha和Praluent均已進入國內,並順利通過談判進入醫保。
目前,信達生物之外,包括恆瑞醫藥、康方生物等在內的6家藥企均處於臨牀階段。
這種背景下,信達生物若順利獲批上市,無疑提前搶到了身位優勢,有望憑藉對國內市場的瞭解搶下一定的份額。
隨着後續競爭對手的相繼獲批,無疑留給國內PCSK9玩家的機會也將越來越少。
這場PCSK9單抗爭奪戰,背後不僅是藥企商業能力之爭,更是執行力之爭。
/ 01 /
執行力即競爭力
提到創新藥企,人們首先想到的一定是研發能力,畢竟只有頗具創新力的藥物才能給企業帶來成長。
研發、創新固然重要,而藥企如何將設計好的管線變成藥物也同樣值得關注,尤其是對於臨牀試驗的執行能力,也是藥企的核心競爭力,但這一點往往卻被人們所忽略。
所有關注PCSK9單抗的中國藥企中,信達生物佈局並非最早的。2017年2月,信達生物提交IND,同年5月,康方生物也提交IND,恆瑞醫藥則在2018年3月才開始提交IND。剩餘三家公司提交IND的時間則在2019年之後,並不具有太強的競爭力。
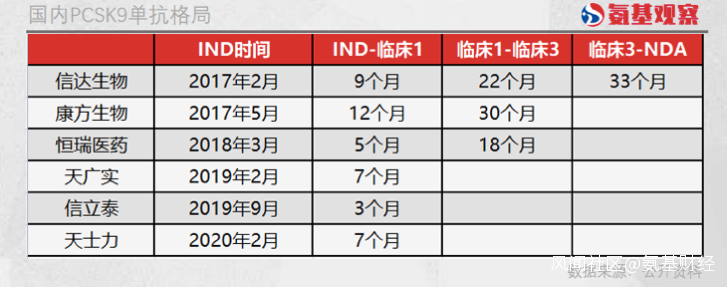 可以看到,信達生物與康方生物基本同一時間段提交IND,前後相差3個月,但在後續臨牀階段卻拉開了差距。信達生物進入臨牀1期和臨牀3期的時間分別為9個月和22個月,康方生物則分別用了12個月和30個月。
可以看到,信達生物與康方生物基本同一時間段提交IND,前後相差3個月,但在後續臨牀階段卻拉開了差距。信達生物進入臨牀1期和臨牀3期的時間分別為9個月和22個月,康方生物則分別用了12個月和30個月。
依靠超強的執行能力,信達生物在臨牀3期的時候,領先其他競爭對手1年時間以上,而這也成為其率先獲批的保障。按照信達生物臨牀3期約33個月的週期計算,那麼第二款國產自研的PCSK9單抗獲批也將有1年以上的時間差。
除了信達生物,在傳統藥企恆瑞醫藥身上,我們同樣看到了執行力帶來了競爭力。恆瑞醫藥雖然是全國第四個提交IND的藥企,但其距第三個提交的康方生物也有10個月的差距。
在恆瑞醫藥提交IND的時候,信達生物已經進入臨牀1期,康方生物也即將進入臨牀1期。但原本機會並不大的恆瑞醫藥,卻憑藉驚人的臨牀執行力,僅用5個月時間就進入臨牀1期,18個月時間進入臨牀3期,成功超越康方生物成為進度第三的PCSK9單抗藥企。
橫向對比不難發現,同樣由臨牀1期進入臨牀3期,恆瑞醫藥的耗時只有康方生物的六成,與信達生物相比,恆瑞醫藥也要快上4個月的時間。或許依靠超強的臨牀執行力,原本不佔優勢的恆瑞醫藥已經具備角力第二款PCSK9單抗的資格。
由此可見,臨牀執行力已經成為衡量藥企競爭力的關鍵一環。
/ 02 /
PCSK9單抗的時間窗口
之所以我們如此看重PCSK9單抗的上市時間,是因為單抗並非PCSK9靶點唯一的選擇。
在《PCSK9單抗,不是降血脂藥物的最終答案》的文章中,我們曾對PCSK9的前景進行了詳細分析,並得出對於降血脂藥物而言,單抗競爭力相對有限的結論。
概括而論,目前一線的降血脂藥物依然為他汀類藥物,尤其是隨着他汀類藥物仿製藥的崛起,他汀類藥物的價格已經接近白菜價,患者一年的花費可能也僅為數百元。
雖然PCSK9單抗為了進入中國醫保,已經將每針1300元的價格降至300元,但每年24針的頻率使得患者每年依然需要支出7000多元,明顯高於他汀類藥物。
另一方面,PCSK9單抗的最主要應用場景為他汀類藥物嚴重不耐受的患者,以及單獨使用他汀類藥物不達標的患者,但這個市場的空間實則並不大。
此前,《European Heart Journal》上進行的一項涵蓋400萬餘例患者的大規模薈萃分析中,他汀類藥物不耐受總患病率僅為9.1%。即使算上單用他汀類不達標的患者,這一比例也很難超過20%。
也就是説,PCSK9單抗目前只是一個降血脂藥物的補充療法,市場份額可能並沒有他汀類藥物那麼大。
在海外, PCSK9單抗還要面臨siRNA藥物的競爭。諾華siRNA藥物Leqvio的用藥頻率更低,每年僅需兩針,且每年的費用約6500美元,與海外PCSK9單抗相差不多。
2021年,Leqvio的所有銷售收入僅為1200萬美元,但今年一季度,其銷售額就已經突破了1400萬美元,全年有望實現數倍增長。不少觀點認為siRNA藥物才是人類降血脂的最佳方案,PCSK9單抗或許只是一個過客。
相對而言,國內siRNA類藥物發展較為緩慢, PCSK9單抗在中國市場依然有機會,畢竟其相對進口的siRNA類藥物依然有先發優勢和經濟優勢。
只不過,這個時間紅利期,可能並沒有其他藥物那麼長,所以,中國的PCSK9單抗藥物必須爭分奪秒,藥企的執行力自然格外重要。
/ 03 /
藥物研發“快”時代
天下武功,唯快不破。
如果説仿製藥時代,藥企是為了“首仿”爭得不可開交,那麼創新藥時代,“first in class”和“fast-follow”同樣要求藥企重視速度。
尤其是在國家鼓勵創新的大背景下,藥物的審批流程得到了大幅的簡化,創新藥的上市速度也得到了全面的提升。
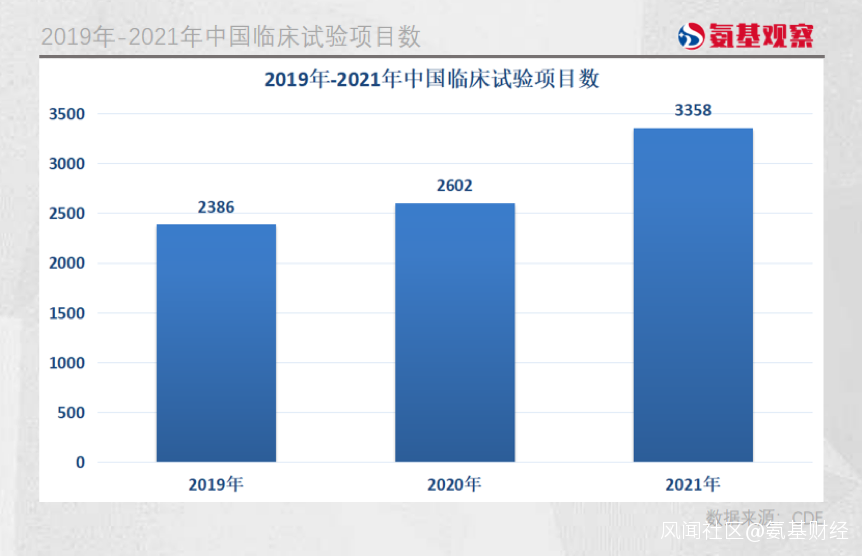
6月8日,CDE剛剛發佈《中國新藥註冊臨牀試驗現狀年度報告2021》,2021年我國藥物臨牀試驗登記數量首次突破3000項,合計3358項,2020年和2021年登記總量分別同比增加9.1%和29.1%,增速明顯加快。
 從臨牀試驗啓耗時這項數據分析,2021年已登記國內有效首例受試者知情同意書(ICF)的登記共819項,時間跨度為3天-91個月,平均耗時為12.2個月,這一數據較去年同期發佈的23.4個月也有了明顯的提升。
從臨牀試驗啓耗時這項數據分析,2021年已登記國內有效首例受試者知情同意書(ICF)的登記共819項,時間跨度為3天-91個月,平均耗時為12.2個月,這一數據較去年同期發佈的23.4個月也有了明顯的提升。
同時,有51.4%的臨牀試驗在6個月以內就開始啓動受試者招募,這也意味着,各藥企也開始注重臨牀執行力這項指標。
回過頭來看,PCSK9單抗並不是一個特別大的藥物市場,單純通過PCSK9單抗的試驗進度並不能直接衡量各藥企間臨牀執行力的高低。但毫無疑問,通過PCSK9單抗這個案例足以説明,如果執行力足夠強,那麼即使研究進度落後也是存在反超機會的。
藥物研發“快”時代下,藥企除了應該關注研發能力和管線佈局方向,同時也應該更加聚焦臨牀執行力,這也是藥企的核心競爭力所在。
