兩人行,可能就有一感染者,這束光來破局?_風聞
中科院之声-中国科学院官方账号-2022-07-18 14:17
新冠疫情三年,我們對於“病毒感染陽性”有了更加深刻的認識。對於一種與胃癌、胃淋巴瘤密切相關的細菌來説,它的傳染率可比新冠病毒厲害多了,全球一半人口都是它的陽性感染者。也就是説,我們周圍潛伏着億萬個“小陽人”,而且大部分是有較高傳染能力的無症狀感染者。

(圖片來自網絡)
約個飯就感染?這個細菌不簡單
我們的胃是一個充滿鹽酸和胃蛋白酶的腔體,其中的胃液不僅腐蝕性強,且對各種組織和細胞都有很強的破壞作用,因此胃就像一個“大熔爐”,可以消滅通過口腔進入胃腸道的絕大多數微生物。
幽門螺桿菌(Helicobacter pylori,Hp)是在胃中發現的第一種微生物,也是唯一能夠在胃中長久生活的霸主。它們主要聚集在胃的幽門部位,且外型彎曲呈螺旋狀,其大名也由此而得。此外,口腔、食管、糞便中也會出現Hp的身影,因此它們可能潛伏在唾液、食物、碗筷上,我們約飯過程中的一個不留神,Hp便趁機在胃中安營紮寨。

(青島能源所單細胞中心供圖)
雖然Hp出生很早,5300年以前的木乃伊身上都有它們的身影,但是人們真正認識它們還是費了一番周折。曾經醫學界認為胃是無菌的環境,胃炎、胃潰瘍都被認為是一種精神疾病。1982年,澳大利亞臨牀微生物學家羅賓·沃倫(Robin Warren)和巴里·馬歇爾(Barry Marshall)從胃黏膜標本中成功分離培養出Hp,不僅打破了“胃內無菌”的科學界共識,也讓胃炎、消化性潰瘍等疾病由“不治之症”變成了人類最普通的疾病之一。

巴里·馬歇爾(圖左)和羅賓·沃倫(圖右)(圖片來自網絡)
點此展開
幽門螺桿菌的編年史
1. 1979年,澳大利亞一家醫院的病理科醫師羅賓·沃倫(Robin Warren),發現活體胃粘膜組織上存在一種彎曲樣桿菌。
2. 1981年,實習醫生巴里·馬歇爾(Barry Marshall)和羅賓·沃倫發現胃炎病人的胃粘膜標本中大概率存在彎曲樣桿菌。
3. 1982年,兩人通過微氧培養法,成功分離獲得彎曲樣桿菌。
4. 1983年,世界微生物組織細菌命名委員會正式命名這種彎曲樣桿菌為幽門螺桿菌(Helicobacter pylori)。
5. 1984年,幽門螺桿菌與胃炎和消化性潰瘍的關係在醫學權威期刊 Lancet 發表。
6. 1984年,巴里·馬歇爾以身試菌,喝下10億幽門螺桿菌,驗證幽門螺桿菌就是胃病的元兇。
7. 2005年,巴里·馬歇爾和羅賓·沃倫獲得諾貝爾生理或醫學獎,授予原因:發現胃炎和潰瘍性疾病是幽門螺桿菌感染引起的。
治療靠經驗,想治癒困難重重
據世界胃腸病學組織估計,全球至少有50%人口感染Hp。大部分感染者沒有明顯的症狀,然而諸如口臭、痤瘡、噁心、嘔吐等,甚至70%以上的胃癌,都與Hp感染脱不了干係。
既然Hp是一種細菌,吃點抗生素殺死它們不就好了?
事實卻沒這麼簡單。Hp對生長環境中氧氣含量、營養成分、pH值均有一定的要求,並且生長緩慢,臨牀分離和培養它通常需要7~10天。之後,通過藥敏試驗(AST)獲取殺滅Hp的最優抗生素類別和劑量信息,同樣耗時很長,技術要求高。因此臨牀醫生主要依賴經驗用藥,根據患者的藥物過敏史和抗生素使用情況選用抗生素治療。由於治療過程中可能存在的“藥不對症”及“劑量不足”,經驗治療容易導致Hp根除的失敗。
同時,隨着抗生素在Hp根除治療中的大範圍使用,Hp耐藥率不斷升高。中國幽門螺桿菌分子醫學中心耐藥監測數據顯示,我國克拉黴素、左氧氟沙星、甲硝唑的耐藥率已經處於較高水平。日益嚴重的Hp耐藥性,讓本就可能失敗的經驗治療,面臨更加嚴峻的挑戰。
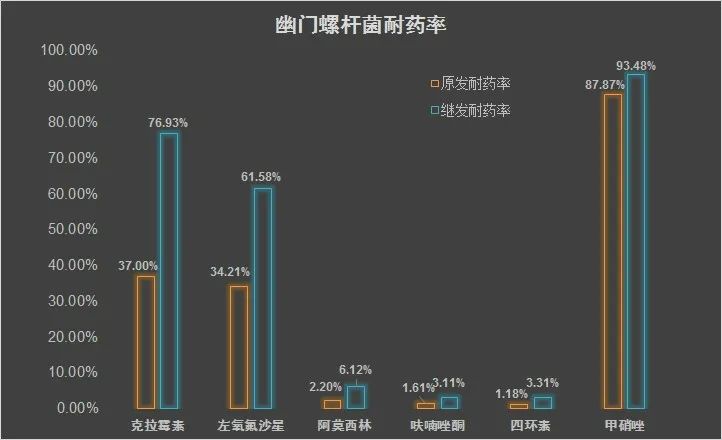
來自中國5個地區Hp感染者胃活檢樣本中的4242株Hp的耐藥表型結果(數據來源:中華醫學雜誌)
病不等人,拉曼光譜與時間賽跑
既然Hp的臨牀治療面臨的最大難題是藥敏檢測的及時性、簡便性和準確率的問題,那麼有沒有什麼新技術能夠解決這個問題呢?
這裏不得不提到一個與光有關的技術——拉曼光譜技術。
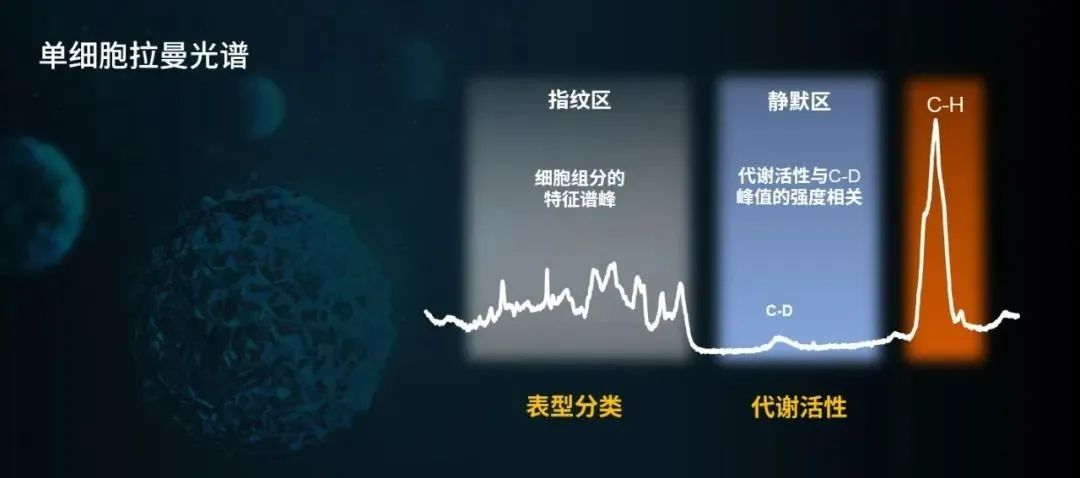
單細胞拉曼光譜(青島能源所單細胞中心供圖)
拉曼光譜是激光照射到物體表面而產生的散射光譜,它反映的是物質的固有性質。科學家通過分析單個細胞拉曼光譜信息(指紋區400-1850 cm-1),可以獲得所有物質的組成、含量等信息,不僅刻畫細胞的代謝活動,而且可以鑑定細胞的種類。
與光譜信息豐富的指紋區相反,單細胞拉曼光譜在靜默區(1850-2850 cm-1)通常沒有光譜信號。科學家利用這一特性,開發了一種重水標記單細胞拉曼藥敏快檢技術(D₂O-Ramanometry)。氫元素大家應該都不陌生,它有幾個同位素——氕氘氚。我們日常生活中的水,由氕和氧原子組成,而重水,是由氘和氧原子組成。細胞喝下重水之後,如果生命狀態良好,氘就會通過合成各種生物大分子(如蛋白質、脂質)而遍佈細胞全身,進而產生拉曼光譜的變化, 即在靜默區產生C-D峯。
重水標記單細胞拉曼藥敏快檢技術原理
藉助拉曼光譜捕捉細胞在抗生素處理下生命狀態的改變,是一種快速獲得病原菌藥敏信息的手段。目前,科學家發現D₂O-Ramanometry技術可以應用於口腔根管沖洗液抑菌效能的評價,以及血液感染中常見病原菌的藥敏評價中,能夠實現十倍加速。
借光出戰,力求首戰告捷
對於Hp陽性感染者,2018美國休斯敦共識、2015京都全球共識均建議治療。世界胃腸病學組織在2021年更新的Hp診療指南中指出,Hp根除治療成功的主要決定因素是在治療前瞭解抗生素耐藥性。
拉曼光譜技術的發展,會不會給Hp的診療帶來新的希望呢?

幽門螺桿菌單細胞精準診療技術CAST-R-HP(青島能源所單細胞中心供圖)
近日,中科院青島能源所單細胞中心與中國疾控中心傳染病所帶領的醫產學研團隊,基於D₂O-Ramanometry技術,建立了全流程一體化的Hp診療技術CAST-R-HP。首先,對於臨牀收集的胃黏膜樣品,通過單細胞拉曼光譜採集及數據分析,可完成細胞種屬識別和鑑定,準確率達98.5 ± 0.27%。其次,通過採集Hp細胞在重水和抗生素孵育後的單細胞拉曼光譜,獲得與傳統方法高度一致的藥敏信息。從臨牀樣品到藥敏結果的完整流程可大幅縮短至3天,而傳統方法通常需要7~10天。最後,通過自主研發的微流控芯片,可進行Hp單細胞分選及下游的測序工作,從而實現溯源。
這項技術為臨牀Hp快檢提供了光譜學解決方案,同時針對臨牀Hp治療過程中必須的藥敏檢測環節,提供了單細胞水平、便捷、快速、無損的檢測手段。此外,由於該技術可分選近乎無損狀態的單個耐藥的Hp細胞,後續的全基因組測序與數據分析將服務耐藥機制研究與精準溯源。
結語
對於病原菌感染,為了避免在抗生素使用過程中病原菌由於基因突變而產生耐藥性,即繼發性耐藥性,抗生素使用的種類和劑量力求準確、適合,確保首戰告捷,把病原菌一次性殺死,不給死灰復燃的機會。對於Hp這種高感染率、高傳染性、高耐藥率的病菌,希望拉曼光譜技術能夠切實解決臨牀需求,早日應用到Hp根除性治療中,相信人類戰勝Hp指日可待。
參考文獻:
1. Liu M, et al., Single-cell identification, drug susceptibility test, and whole-genome sequencing of Helicobacter pylori directly from gastric biopsy by Clinical Antimicrobial Susceptibility Test Ramanometry. Clin Chem, 2022.
2. Zhu PF, et al., Rapid, automated, and reliable antimicrobial susceptibility test from positive blood culture by CAST-R. mLife, 2022.
3. Yuhan Liu, et al., Single-cell Raman microspectroscopy-based assessment of three intracanal disinfectants’ effect on Enterococcus faecalis. J Raman Spectrosc, 2022, 53(5): 902-910.
4. Fan Li, et al., Assessing efficacy of clinical disinfectants for pathogenic fungi by Single-cell Raman Microspectroscopy. Front Cell Infect Microbiol, 2022, 12:772378.
5. Tao YF, et al., Metabolic-activity-based assessment of antimicrobial effects by D₂O-labeled single-cell Raman microspectroscopy. Anal Chem, 2017, 89(7): 4108-4115.
6. 千年木乃伊體內現幽門螺旋桿菌 揭示人類複雜活動
7. 差點不被承認的幽門螺旋桿菌——驚心動魄的發現和認證
8. 胃部微生物 | 扒一扒幽門螺旋桿菌的那些事兒
9. 一項中國幽門螺桿菌耐藥表型和基因型的回顧性研究. 中華醫學雜誌, 2022,102(22): 1665-1665.
來源:中國科學院青島生物能源與過程研究所