又一起驚天學術造假?震盪阿爾茨海默病研究領域_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2022-07-24 21:21
撰文 | 吳友仁
來源 | “醫學界”公眾號
這種看起來只能在電影中才會出現的局面,出現在了Science(《科學》)雜誌7月21號的置頂新聞中,該新聞直指一項與阿爾茲海默症發病機制有關的奠基性工作涉嫌學術不端。事件的緣由是青年科學家範德堡大學神經科學學家Matthew Schrag對另一名阿爾茲海默症(AD)領域的新星Sylvain Lesné的系列工作提出公開質疑,認為其自2006年至今,圍繞Aβ*56的工作存在的開創性工作以來,可能存在科學不當行為。《科學》雜誌已為此進行了為期6個月的調查,為Schrag的懷疑提供了強有力的支持。
關於AD的假説眾多,Aβ致病理論假説久負盛名,該理論認為Aβ在細胞外聚集形成纖維狀聚集物——β-澱粉樣蛋白寡聚體,進而形成澱粉樣斑塊,導致局部組織炎症、神經細胞凋亡。其實,關於這個理論一直爭議不斷……
首先了解這個理論的由來
1906年,慕尼黑大學附屬醫院的精神病學家愛羅斯·阿爾茨海默(Alois Alzheimer)和埃米爾·克雷佩林(Emil Kraepelin)在一場學術會議上做了題為《關於一個奇特的大腦皮質疾病》的報告。在報告中,他們描述了對一名具有痴呆和精神病性症狀的50歲女性患者的診療過程,並注意到了患者屍檢時大腦所存在的特殊斑塊樣改變和神經原纖維纏結。
隨後不久,作為阿爾茨海默的同事和摯友,克雷佩林將具有這一類表現的疾病以他的名字命名為阿爾茨海默病(Alzheimer’s disease),又稱“早老性痴呆”。

慕尼黑大學精神病院的組織病理學實驗室團隊,他們隨後發現了阿爾茨海默症的存在
儘管阿爾茨海默病因診斷繁瑣而被遺忘了近50年之久,但隨着全球範圍內符合阿爾茨海默病表現的患者數量不斷增長,醫學界也開始認識到這並非一種少見疾病。而阿爾茨海默最初描繪的病理表現,也成為了攻克阿爾茨海默病的重要線索——阻斷斑塊的形成,或者是解除斑塊和纖維纏結,似乎都可以逆轉阿爾茨海默病的病程。
1984年,研究人員從阿爾茨海默病患者大腦內的斑塊中提取出了β澱粉樣蛋白(Aβ);而在1991年,另一隊學者從一個遺傳性早發性阿爾茨海默病家系中檢測到了β澱粉樣前體蛋白(APP,可在人體內加工後形成Aβ)基因的突變,這些結果都表明Aβ和阿爾茨海默病患者大腦內的澱粉樣斑塊形成有着千絲萬縷的聯繫。
John Hardy於1992年在Science雜誌提出了阿爾茨海默病發病的澱粉樣蛋白級聯瀑布假説(Hardy JA, et al. Science. Alzheimer’s disease: the amyloid cascade hypothesis. 1992 Apr 10;256(5054):184-5.),從此,醫學界開始專注於研究Aβ在阿爾茨海默病中的作用,部分藥企和科研機構也在發力於開發針對於Aβ的藥物。
而在2006年,明尼蘇達大學的一名普通研究生Sylvain Lesné在Nature發表了自己的研究,讓Aβ從“和阿爾茨海默病有潛在聯繫的物質”直接成為了“阿爾茨海默病的致病元兇”。Lesné在研究中使用了表達人APP的Tg2576小鼠,這種小鼠會隨年齡增長而在大腦內出現澱粉樣斑塊,但並不會出現晚期阿爾茨海默病所具有的神經原纖維纏結、神經元丟失等特徵,故被認為是研究早期阿爾茨海默病的理想動物模型。而在表現出了類似人早期阿爾茨海默病症狀的Tg2576小鼠的腦組織中,Lesné從無數種不溶性Aβ中分離出了一種獨特的可溶性Aβ形式Aβ*56,且當他們把純化後的Aβ*56注射給健康大鼠以後,這些大鼠也表現出了記憶力部分缺失的症狀。Lesné就此推斷,可溶的Aβ*56是導致阿爾茨海默病相關的記憶力缺失的一個潛在原因。
這項研究的意義無疑十分重要:如果Aβ*56或者是類似的可溶性Aβ蛋白是導致阿爾茨海默病症狀的原因,那麼檢測可溶性Aβ將有助於診斷早期阿爾茨海默病;而由於可溶性Aβ廣泛存在於不溶性Aβ中,則針對可溶性Aβ的藥物將有助於緩解阿爾茨海默病的部分症狀,甚至可能清除大腦澱粉樣斑塊。
基於這一項研究,Aβ成為了醫學科研領域的大熱門,針對Aβ的阿爾茨海默病診斷手段和治療藥物開發更是如火如荼地進行着——自2012年起,美國食品藥品監督管理局(FDA)陸續批准了3種基於PET下Aβ成像的阿爾茨海默病診斷用藥。
Lesné和他的導師Karen Ashe也因為這項研究而成為了大紅人。Ashe憑藉這項研究獲得了阿爾茨海默病領域的“諾貝爾獎”——波坦金獎(Potamkin Prize for Research in Pick’s, Alzheimer’s, and Related Diseases),Lesné直接入職明尼蘇達大學並擁有了一個受美國國立衞生研究所(NIH)資助的實驗室。2020年,Lesné更是升職為明尼蘇達大學神經科學研究生項目負責人,還在2021年5月獲得了NIH最長至5年的R01資助,成為了人人羨慕的“青年科學家”。
但在醫學界為Lesné的理論狂歡時,在讀醫學院時就開始研究阿爾茨海默病的Schrag坐不住了。
“經典理論”不斷被質疑
十幾年前,在洛馬林達大學修讀醫學博士課程的Schrag看到了一項研究,研究人員通過動物模型發現阿爾茨海默病和鐵代謝有關。Schrag隨即想起在2006年,他自己發表的一篇文章也有類似的發現——在高膽固醇飲食兔子模型中,於兔子大腦的同一部位出現了Aβ斑塊和鐵的沉積量增加。
感到興奮的Schrag試圖將人體鐵代謝和阿爾茨海默病聯繫在一起,但大量研究均以失敗告終,此時的他開始認識到,阿爾茨海默病的動物模型可能和真正的人類疾病存在着巨大差別。而在看了更多研究之後,Schrag更意識到,阿爾茨海默病的研究存在高度的不確定性,很多研究結果的重複度並不佳。
機緣巧合,2021年8月,有個正準備對一家研發阿爾茨海默病治療藥物的企業進行買空投資的朋友來問Schrag,一種阻止可溶性Aβ沉積於大腦的藥物Simufilam為何會出現理論基礎與臨牀試驗數據完全不符的現象時,Schrag就想起了讀書時的這一故事。而在看過Simufilam的理論基礎過後,他瞬間覺得,朋友的買空投資給了他一股靈感——一股準備挑戰“權威研究”的靈感。
當然,質疑這一“權威研究”的,遠不止Schrag一人。
在NIH於2021年將資助“澱粉樣蛋白、寡聚物與阿爾茨海默病”的資金升至2.87億美元,將阿爾茨海默病的近一半研究預算投入到與Aβ有關的項目時,部分研究非Aβ致病理論的科學家直呼出現了“Aβ黑幫”。眾多研究人員還發現,即使按照Lesné提供的方法,自己的實驗室也並不能提取到Aβ*56,而只能提取到一堆可溶性寡聚物的混合物,這樣的話,Aβ*56在大鼠中的致病作用就難以預測了。
正是在這樣的背景下,機緣巧合,Schrag在2021年12月接觸到了著名論文審查網站PubPeer,見識到了圖片加工對論文最終結果的巨大影響。他將“阿爾茨海默病”作為關鍵詞在PubPeer搜索,無意中見到了Lesné署名的一些文章被人發帖指出問題,而也許是興趣使然,他開始用自己學到的圖像分析知識,來審查Lesné沒有被貼在PubPeer的更多文章,包括髮表在Nature的那篇大作。
Schrag通過對Lesné文章中涉及Aβ*56的Western Blot圖像進行反覆加工處理,發現Lesné對Aβ*56條帶進行了切割處理,又對多個區域的條帶進行了複製-粘貼操作,從而捏造了Aβ*56經Western Blot驗證存在於組織中的結果。雖然Ashe很快在PubPeer回應了Schrag,併發出了自己手中的“原始”圖像,但Schrag在“原始”圖像中發現了幾乎一模一樣的問題。而根據Science雜誌對圖像分析師Jana Christopher和分子生物學家Elisabeth Bik的採訪,Schrag對這篇文章中所有Western Blot圖像的分析結果大多數是正確的。Bik更表示“(Lesné)取得的實驗結果可能不符合預期結果,所以將不同實驗中取得的圖像拼接在一起合成了新的圖像,數據也可能被篡改,以更符合他們的假設”。
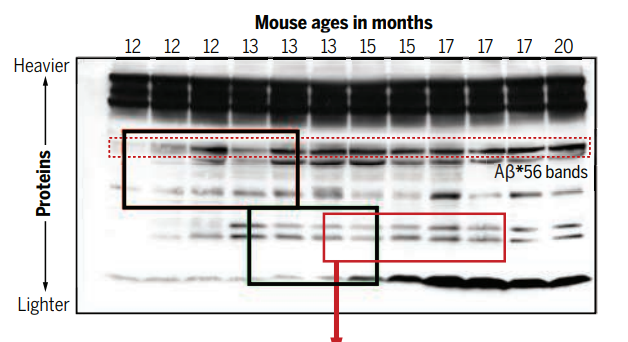
Lesné所使用的造假手段 圖:Science
**需要注意的是,涉嫌造假的論文僅研究了Aβ*56,而Aβ*56並不是Aβ研究的主流,除了該課題組外,其它課題組鮮有相關報道。**Aβ研究的主流寡聚體是Aβ*42/Aβ*40等形式。其實,Aβ*56並非是該領域研究最豐富的寡聚形式,這篇論文引發的涉嫌造假事件遠沒有顛覆Aβ的毒性假説。期待未來有更多的權威研究來給予最終定論。
學術造假,後果從不侷限於“學術”
自今年年初起,Schrag就嘗試聯繫包括Nature在內的、Lesné發表過Aβ相關研究的雜誌,以及資助Lesné的NIH,試圖曝光這場“驚天騙局”。一開始,Lesné對兩篇文章進行了圖片訂正,但Schrag很快發現,其中一篇文章訂正後的圖片存在大量人工添加/刪減條帶的痕跡,讓不少人感到震驚。
如今,Nature編輯部已經表示正在重新審核Lesné的文章,NIH也將Schrag的投訴轉到美國衞生與公共服務部(DHHS)下屬的研究誠信辦公室(ORI)進行處理,如果Lesné的投訴被ORI和Nature雜誌認定成立,Lesné和Ashe的學術造假行為,將可能是美國有史以來影響最惡劣的學術造假案。
Lesné的案件的獨特之處在於,他的研究不僅在16年間帶偏了無數科研項目的方向,更是在一定程度上推動了上百種針對可溶性Aβ的藥物進入了各家藥企的研發管線,而除了少數還沒有進入後期研究階段的藥物,其他藥物的臨牀研究均告失敗,這也使得近半數曾經擁有阿爾茨海默病治療藥物研發管線的頂尖藥企宣佈永久退出阿爾茨海默病領域,嚴重削弱了阿爾茨海默病治療藥物的研發力量。
而醫學學術造假波及臨牀的事件並不只有這一次。2009年,德國麻醉學家、重症監護液體復甦領域的權威Joachim Boldt被Anesthesia&Analgesia編輯部發現在一篇關於羥乙基澱粉對比白蛋白用於體外循環的文章中出現了未經倫理委員會批准、缺乏知情同意、捏造數據等多種問題,隨後針對Boldt的調查發現,他在羥乙基澱粉領域的大量研究都存在類似問題,而結果無一例外——都是為了證明羥乙基澱粉在液體復甦中優於晶體液、白蛋白等傳統藥物。但根據JAMA的一篇文章,在危重症病人中使用羥乙基澱粉復甦,將明顯增加病人的急性腎損傷和死亡風險,考慮到歐美曾受Boldt的言論影響數年,羥乙基澱粉也曾一度被認為是理想的復甦膠體液,死於羥乙基澱粉的患者可能不在少數。

讓“大造假家”露餡的論文
圖:Anesthesia&Analgesia
2011年2月,Boldt被任職的吉森大學解聘,很快消失於學術界中。截至目前,Boldt已經有163篇論文被撤稿,在學術界僅次於日本麻醉學家藤井善隆(183篇)。關於Boldt,著名醫學雜誌BMJ曾評論其為“大造假家”,然而在很多學者看來,他既是“大造假家”,可能也是“大劊子手”。
參考文獻:
[1]Charles Piller. BLOTS ON A FIELD? Science. 2021. doi: 10.1126/science.ade0209
[2]Hippius H, Neundörfer G. The discovery of Alzheimer’s disease. Dialogues Clin Neurosci. 2003;5(1):101-8. doi: 10.31887/DCNS.2003.5.1/hhippius
[3]Glenner GG, Wong CW. Alzheimer’s disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein. Biochem Biophys Res Commun. 1984;120(3):885-90. doi: 10.1016/s0006-291x(84)80190-4
[4]Chartier-Harlin MC, Crawford F, Houlden H, et al. Early-onset Alzheimer’s disease caused by mutations at codon 717 of the beta-amyloid precursor protein gene. Nature. 1991;353(6347):844-6. doi: 10.1038/353844a0
[5]Lesné S, Koh MT, Kotilinek L, et al. A specific amyloid-beta protein assembly in the brain impairs memory. Nature. 2006;440(7082):352-7. doi: 10.1038/nature04533
[6]Wise J. Boldt: the great pretender. BMJ. 2013;346:f1738. doi: 10.1136/bmj.f1738
[7]Zarychanski R, Abou-Setta AM, Turgeon AF, et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. JAMA. 2013;309(7):678-88. doi: 10.1001/jama.2013.430